一例小孢根霉菌引起的肺部感染
时间:2022-10-13 15:51:51 热度:37.1℃ 作者:网络
前言
毛霉病是一种侵袭性真菌病,以前称之为接合菌病,是由毛霉目真菌引起的危害较大的感染性疾病。毛霉病的全因死亡率40%~80%,取决于宿主基础状况和感染部位,主要致病菌包括根霉菌属、毛霉菌属1,根毛霉菌属等。
毛霉感染的常见侵入途径是经鼻窦或气道吸入真菌孢子,因此鼻窦和肺脏是毛霉的入侵门户,也是最常累及的器官2,肺毛霉病好发于免疫功能低下患者,糖尿病是最常见的基础疾病。根霉菌属于毛霉目,是引起人类毛霉病的常见菌,其中小孢根霉菌为第二常见的病原菌3。本例为高血压膜性肾病并发糖尿病患者感染小孢根霉菌,现对诊断经过进行汇报。
案例经过
患者,男,70岁,入院前1周(4月7日)着凉后间断咳嗽,咳痰,无胸痛,无咯血,无发热,无明显气短,外院4月8日行肺CT检查提示“左肺上叶复杂密度影”(图1),给予“头孢哌酮”、“左氧氟沙星”静点3天后为继续治疗“肾病综合征”出院并前往我院肾内科。4月14日门诊化验血常规白细胞9.00*10^9/L,中性粒细胞绝对值8.31*10^9/L,中性粒细胞百分比92.4%,红细胞2.53*10^12/L,血红蛋白80g/L,血小板292*10^9/L,C反应蛋白71.87mg/L,降钙素原0.086ng/mL。高血压病史50余年,血压最高200/100mmHg,现口服“诺欣妥”33mg/日;风湿性关节炎病史40年;肾病综合征、膜性肾病病史4个月,目前口服美卓乐,定期静点环磷酰胺;糖尿病1个月,目前应用赖脯胰岛素(早4中2晚6)、重组甘精胰岛素(晚6);阑尾炎术后30年,肺结节病史7年;影像学检查提示肺部感染、胸腔积液。初始治疗方案:给予氨曲南抗感染,甲泼尼龙36mg/d,并对症治疗。入院后开始出现间断发热,体温最高升至39℃,4月17日影像学检查:胸部CT平扫显示:右肺条状高密度影,右侧膈面抬高,双肺炎症性病变,考虑伴间质性改变,左肺上叶空腔或空洞样病变,双肺微小结节,双侧胸膜肥厚左侧少量胸腔积液,内毒素含量(血浆)0.516 ↑ EU/mL;1-3-β-D葡聚糖浓度662.1 ↑pg/ml,4月18日复查阴性,考虑为G实验影响因素多,阴性预测值更有参考意义。
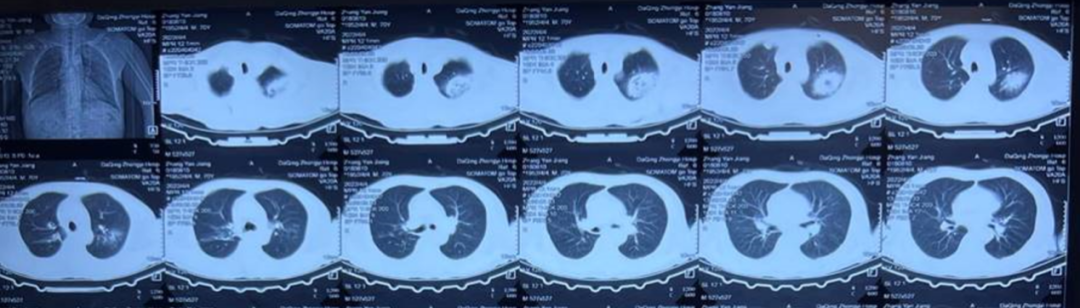
图1 4月4日肺CT
4月19日转入呼吸科治疗,考虑肺CT可见反晕征,空气半月征,肺部病变范围广(见图2),痰抗酸染色、结核分枝杆菌DNA检测阴性,WBC7.57×109/L,中性粒细胞百分比85.5%,血红蛋白89g/L,C-反应蛋白49.24mg/L,超敏C-反应蛋白>10mg/L,不除外细菌感染及不典型病原体感染,考虑真菌感染可能性大,给予盐酸莫西沙星联合氟康唑抗感染治疗,EB病毒DNA检测阳性,考虑合并EB病毒感染,给予喜炎平抗病毒治疗,同时与微生物沟通隐球菌检测。

图2 4月17日肺CT,对比4日结果,双肺多发斑片影较前明显进展,空洞变大
4月24日,2次真菌培养及一次细菌培养均培养出根霉菌(见图3),MALDI-TOF鉴定结果:小孢根霉菌(见图4),GM实验结果阴性,结合肺CT表现,肺毛霉病诊断成立,痰涂片可见大量中性粒细胞,未见真菌丝,由于结合菌菌丝宽大壁薄,直接涂片容易破碎,革兰染色容易漏检,与呼吸科沟通,依据《2019年欧洲毛霉病诊疗指南》,建议给予两性霉素B脂质体或泊沙康唑治疗,患者由于经济问题拒绝应用,因有膜性肾病,两性霉素应用受限,自行咨询北京协和医院,建议应用伏立康唑治疗。
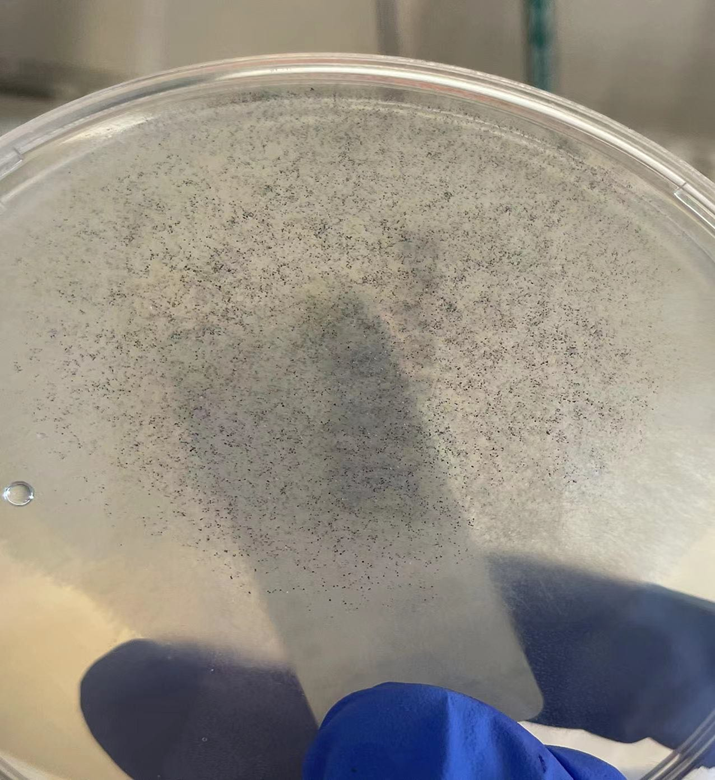
图3-1 72小时TTC上生长形态,产生大量气生菌丝
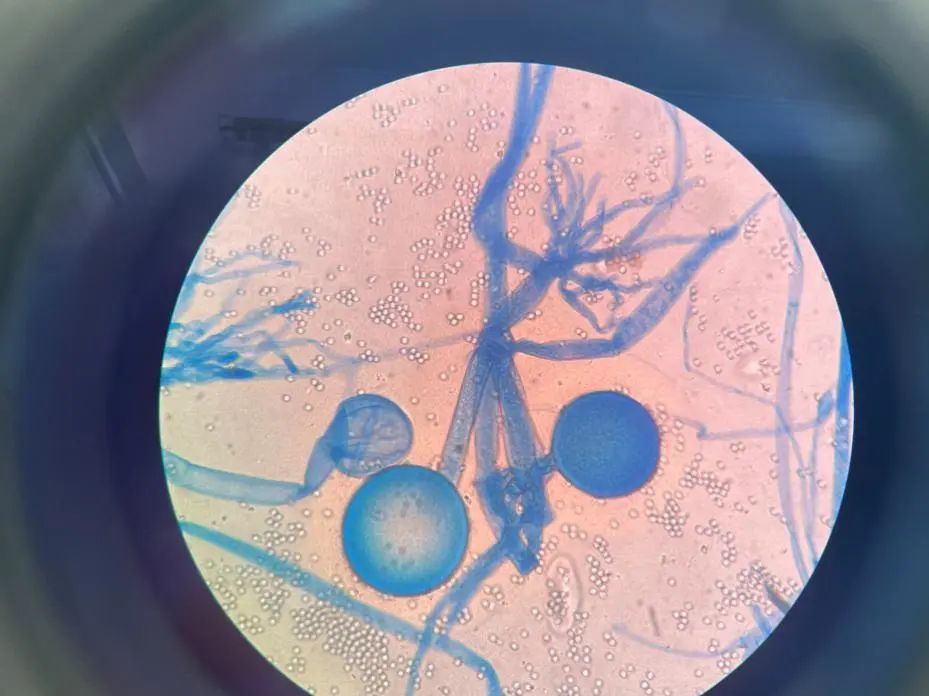
图3-2乳酸酚棉兰染色镜下典型特征:分生孢子头呈圆形,对生假根
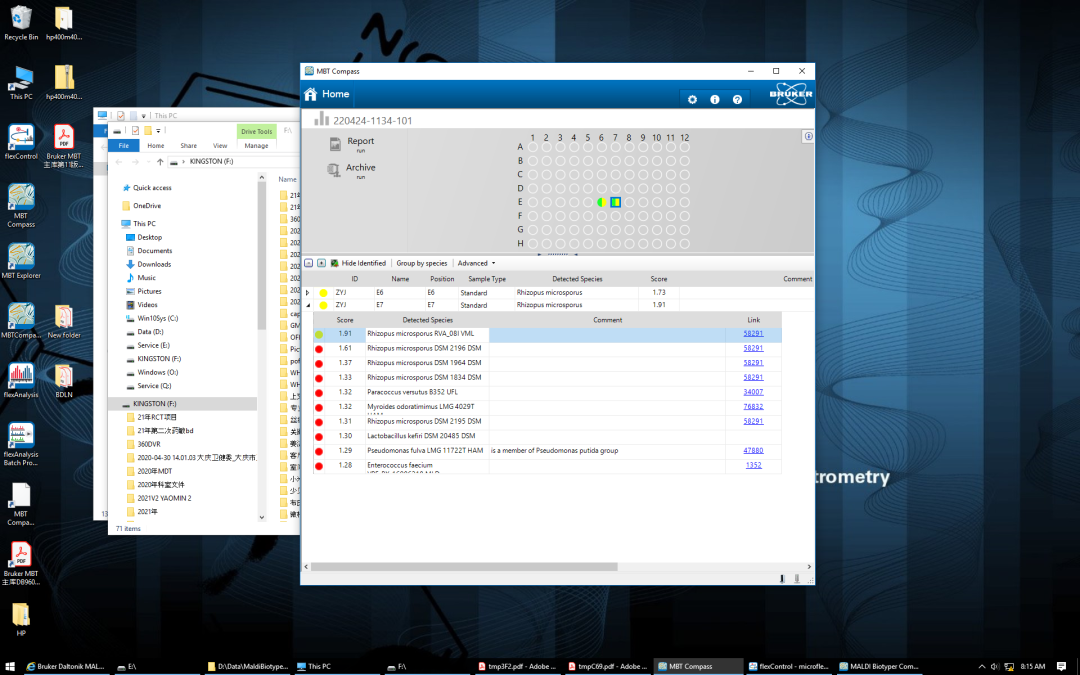
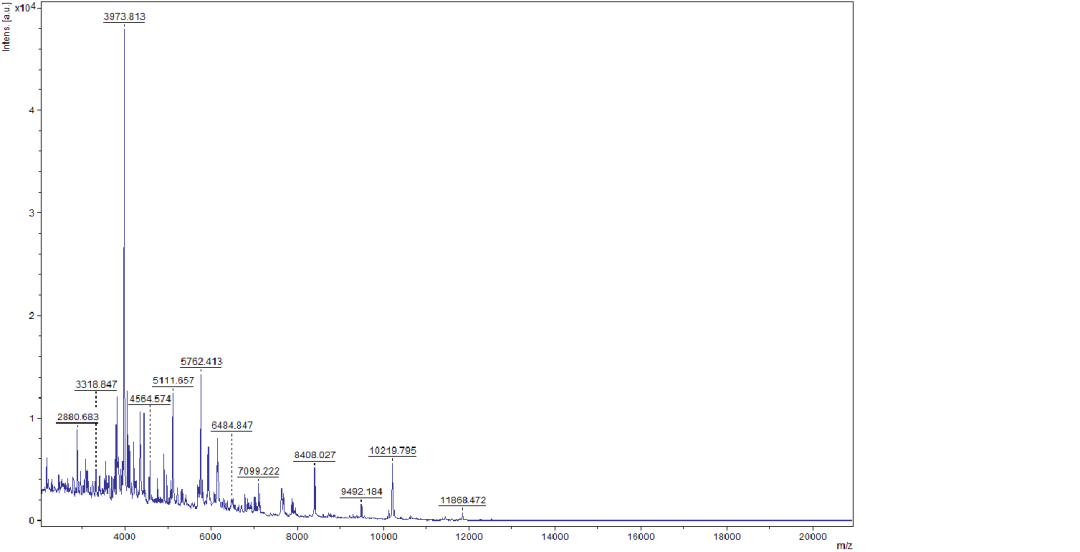
图4 质谱鉴定结果
5月12日呼吸科邀请CT室,胸外科,检验科,肾内科进行多学科会诊,微生物专业参与会诊,根据患者的病程和进展情况,建议应用两性霉素B或泊沙康唑治疗,由于病灶较大,患者高龄,胸外科建议病灶包裹较好时再考虑切除病灶。结合4月28日和5月9日肺CT影像表现(见图5),可见双肺炎症有所吸收,左肺空洞性病变边缘清洗,空洞内充气征增多,患者无发热,病灶得到控制,考虑非单一病原体感染,混合性感染可能性大,继续给予伏立康唑治疗,出院后定期复查。
6月12日随访,肺CT炎症减轻,病灶未扩大,空洞融合,空气征增多,WBC13.48×109/L,中性粒细胞绝对值9.91×109/L,中性粒细胞百分比73.5%,C反应蛋白24.46mg/L,超敏C反应蛋白>10mg/L,对比出院前,白细胞总数有所增加,建议继续随访复查。

图5-1 4月17日肺CT

图5-2 4月28日肺CT双肺炎症有吸收

图5-3-a 4月28日肺CT
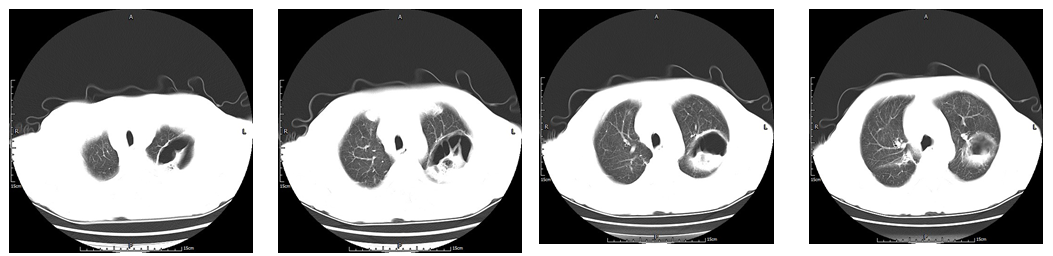
图5-3-b 5月9日肺CT显示空洞内空气征
案例分析
临床案例分析
肺真菌病是最常见的深部真菌病,近年来由于抗肿瘤药物、免疫抑制剂、细胞毒药物、糖皮质激素的长期应用,体内介入治疗、器官及造血干细胞移植的开展等,肺真菌病有增多的趋势,肺真菌病病原菌以曲霉菌最常见,其次为隐球菌、毛霉菌、肺孢子菌、念珠菌等。
该患者因肾脏疾病长期应用糖皮质激素和免疫抑制剂,高血压病史,新发糖尿病,患者居住在一楼,北方4月停止供暖,居住环境阴冷潮湿,这些均为感染毛霉病的危险因素。该患者GM实验为阴性,结合肺CT结果,呈现“反晕征”,而曲霉菌感染GM实验阳性,肺CT表现为“晕轮征”,治疗毛霉病除系统性抗真菌治疗外,优先推荐尽早对毛霉病进行完整的外科手术治疗1,抗真菌治疗首选两性霉素B脂质体,而该患者有肾脏基础疾病,故推荐泊沙康唑治疗,因患者经济问题,改用伏立康唑,症状有好转,炎症得到控制,可能患者为混合性感染,患者先后应用了头孢哌酮、氨曲南、莫西沙星等抗菌药物,可能出现菌群失调,念珠菌数量一过性升高。
检验案例分析
患者初期G实验阳性,可能为多种原因引起,如抗生素的应用、为纠正贫血进行的输血,应用免疫抑制剂等,复查后为阴性,G实验阴性预测更有参考价值,G实验和内毒素均需进行动态监测,建议隔天监测一次,连续两次阳性有临床意义。
小孢根霉菌感染在北方比较少见,患者自身有基础疾病,是肺真菌病感染的易感人群,存在危险因素。临床微生物工作中,丝状真菌的结果回报通常比较慎重,首先会考虑标本留取是否合格、送检是否及时,该病例在送检真菌培养前,医生曾与微生物人员沟通,因为G实验阳性,所以考虑不除外隐球菌感染,沟通后送痰真菌培养,培养出小孢根霉菌后,找出原始标本进行涂片,痰直接涂片未见到宽大菌丝,因丝状真菌需要排除污染因素,沟通后再次送检1次真菌培养及细菌培养,2份标本菌培养出该菌,故确定病原菌。治疗毛霉病首选两性霉素B或泊沙康唑,患者拒绝应用,改用伏立康唑后,出现好转,可能为混合感染,小孢根霉菌产生大量气生菌丝会影响其他病原菌的检出。
案例总结
本病例为老年男性患者,有肾病综合征、糖尿病等基础疾病,长期应用免疫抑制剂,是肺真菌病易感人群。依据细菌培养结果和CT影像结果,肺毛病诊断明确,治疗首选外科切除病灶,抗真菌治疗首选两性霉素B脂质体,或泊沙康唑、艾莎康唑。
目前对少见真菌的鉴定有一定难度,本病例通过应用甲酸提取法,经布鲁克MALDI-TOF质谱仪鉴定为小孢根霉菌,将真菌鉴定到种的水平,给予临床明确病原菌结果回报。在本次病例中,有效的临床沟通起到了很大的作用,在送检初期,及时沟通,锁定目标为真菌感染,微生物室人员给予足够重视,及时对培养结果进行分析,3次培养阳性,确定致病菌。
知识拓展
小孢根霉菌隶属于毛霉目跟足科根霉属,菌落呈浅棕灰色,产生高的气生菌丝,区别于根毛霉的低气生菌丝,孢子梗大部分不分支,与假根相对,小孢根霉菌是毛霉病中第二常见的病原菌,可以从土壤或木制品中分离出来。毛霉目大部分的抗菌药物敏感度相同,体外实验和感染动物模型显示两性霉素B对大多数毛霉目菌株最有效,被列为一线治疗药物1,但毒性明显,且存在剂量积累效应,故仅在无可选药物时才可使用,艾沙康唑效果与两性霉素B制剂治疗效果相当,新的唑类药物中伏立康唑活性差,相比之下泊沙康唑具有相对较低的MIC3。
糖尿病和糖皮质激素的应用是毛霉病的典型危险因素4,2021年印度爆发毛霉病提示COVID-19也是毛霉病感染是危险因素,主要类型为未进行控制的糖尿病患者感染鼻-眶-脑型毛霉菌病5,亦有报道免疫功能正常患者感染毛霉病,肺毛霉病影像学表型可为肺叶或肺段实变影,也可出现晕征、反晕征、胸腔积液。侵犯起到可致肺实变或肺不张,侵及血管壁则易导致血栓、梗塞灶形成,少数会形成动脉瘤或假性动脉瘤6。
专家点评
王成英,主任技师,大庆油田总医院检验科副主任
该患者因发热就诊,先后进行了抗革兰氏阴性菌和抗革兰氏阳性菌治疗,效果均不佳,因肾脏基础疾病,长期应用免疫抑制剂,于我院就诊初期,肺部影像结果显示间质性变化,有空洞形成,约两周后病变进展迅速,入院3周后痰细菌培养出根霉菌属,采用甲酸提取法,经MALDI-TOF鉴定为小孢根霉菌,且3次痰培养结果一致,病原菌明确,G实验GM实验均阴性,结合肺部影像学表现,诊断明确,多学科MDT讨论中,给予患者治疗意见为泊沙康唑治疗,患者并未同意,患者自己咨询协和医院后,坚持使用伏立康唑治疗,症状有好转,然而伏立康唑对于毛霉菌无效1,考虑混合感染,出院后复查,白细胞总数相比出院前升高,并未继续进行真菌培养。
丝状真菌生长迅速,根霉菌形态学上需与毛霉菌、根毛霉菌相区别,乳酸酚棉兰染色可鉴定到属,MALDI-TOF质谱技术可鉴定到种水平,传统培养技术和显微镜形态学技术是微生物专业人员应掌握的基本知识,新的质谱技术从蛋白质水平对细菌、真菌进行快速诊断,需要与传统检验技术相结合,进一步完善对丝状真菌的鉴定。
【参考文献】
[1]梁官钊,刘维达.2019年欧洲毛霉病诊疗指南解读,[J]中国真菌学杂志.2021.4vol16(2)
[2]张文娜等.毛霉病综合治理的临床决策,[J]中华医学杂志,2018,98(10)
[3]第12版美国临床微生物学
[4]A.S. Ibrahim, B. Spellberg, T.J.Walsh, D.P. Kontoyiannis, Pathogenesis of mucormycosis, Clin. Infect.Dis. 54 (2012)S16-S22
[5]Fernández-GarcíaO, Guerrero-Torres L, Roman-Montes CM, et al. Isolationof Rhizopusmicrosporus and Lichtheimia corymbiferafrom tracheal aspirates of two immunocompetent critically illpatients with COVID-19. Med Mycol Case Rep. 2021 Sep;33:32-37.
[6]石宇博,吴小康等,肺毛霉病伴动脉瘤形成1例。[J]中国感染与化疗杂志,2021.1vol22(1)98-101.


