JCO:靶向BCMA的cilta-cel治疗中国复发/难治性多发性骨髓瘤的II期结果,18个月 OS 率为78.7%
时间:2022-10-25 06:00:16 热度:37.1℃ 作者:网络
对于多发性骨髓瘤(MM),近二十年新药如雨后春笋,不同的蛋白酶体抑制剂、免疫调节剂、CD38单抗、XPO1抑制剂等在国内都有上市,而BCMA CAR T细胞疗法在国内目前还多数处于临床试验阶段,仅有驯鹿生物/信达生物合作开发的伊基仑赛注射液和科济药业的泽沃基奥仑赛注射液申报上市。
Ciltacabtagene Autoleucel(cilta-cel)是杨森和传奇公司合作开发的BCMA CAR T产品,2月已经在美国获批上市。CARTIFAN-1 是cilta-cel治疗既往接受≥3线(包括 PI 和IMiD)治疗的中国 RRMM 患者的关键II期研究,近日《Journal of Clinical Oncology》发表了CARTIFAN-1研究中位18个月随访的初步疗效和安全性结果,通讯作者为陈赛娟教授,共同第一作者为糜坚青、赵万红、景红梅和傅卫军四位教授。

研究设计
CARTIFAN-1研究是一项进行中的II期、开放标签、确证性研究,旨在评估cilta-cel治疗中国RRMM患者的疗效和安全性,纳入的患者既往接受≥3线治疗(包括 PI 和IMiD)。根据参研机构标准进行单采(目标为6 X 109外周血单核细胞)。
如果有临床指征可在单采和清淋之间给予患者桥接抗骨髓瘤治疗。单采后约4-6周清淋,环磷酰胺 300 mg/m2每日一次 和氟达拉滨 30 mg/m2 每日一次静脉给药持续3天。对于年龄≥70岁、ECOG 1分的患者,研究者可酌情将环磷酰胺剂量减少至 250 mg/m2 每日一次;如果肌酐清除率为40-70 mL/min/1.73 m2,氟达拉滨剂量可减少至 25 mg/m2 每日一次。清淋开始后5-7天单次输注cilta-cel单次输注(目标剂量0.75 X 106 CAR [0.5-1.0 X 106 CAR]阳性活 T 细胞/kg)。
研究结果
患者和治疗
64例患者入组研究并接受单采(图1),其中16例患者在cilta-cel输注前因疾病进展 (n=5)、AE(n=3)、医生决定 (n=2)、死亡 (n=2) 或拒绝进一步研究治疗 (n=4) 而中止研究。与继续接受 cilta-cel 治疗的患者相比,最终停药的患者需要桥接治疗的比例更高,ECOG为1的比例更高。

接受cilta-cel治疗的患者(n=58)入组时的中位年龄为61.0岁;从诊断至cilta-cel输注的中位时间为3.7年(表1)。所有患者均有可评估的骨髓活检或穿刺样本;20.8%的患者浆细胞30%-60%,16.7%的患者浆细胞≥60%;21例患者 (43.8%) 具有高危细胞遗传学特征(22.9% t(4,14)、20.8% del17p、0% t(14;16)),此外5例 (10.4%) 伴髓外浆细胞瘤。
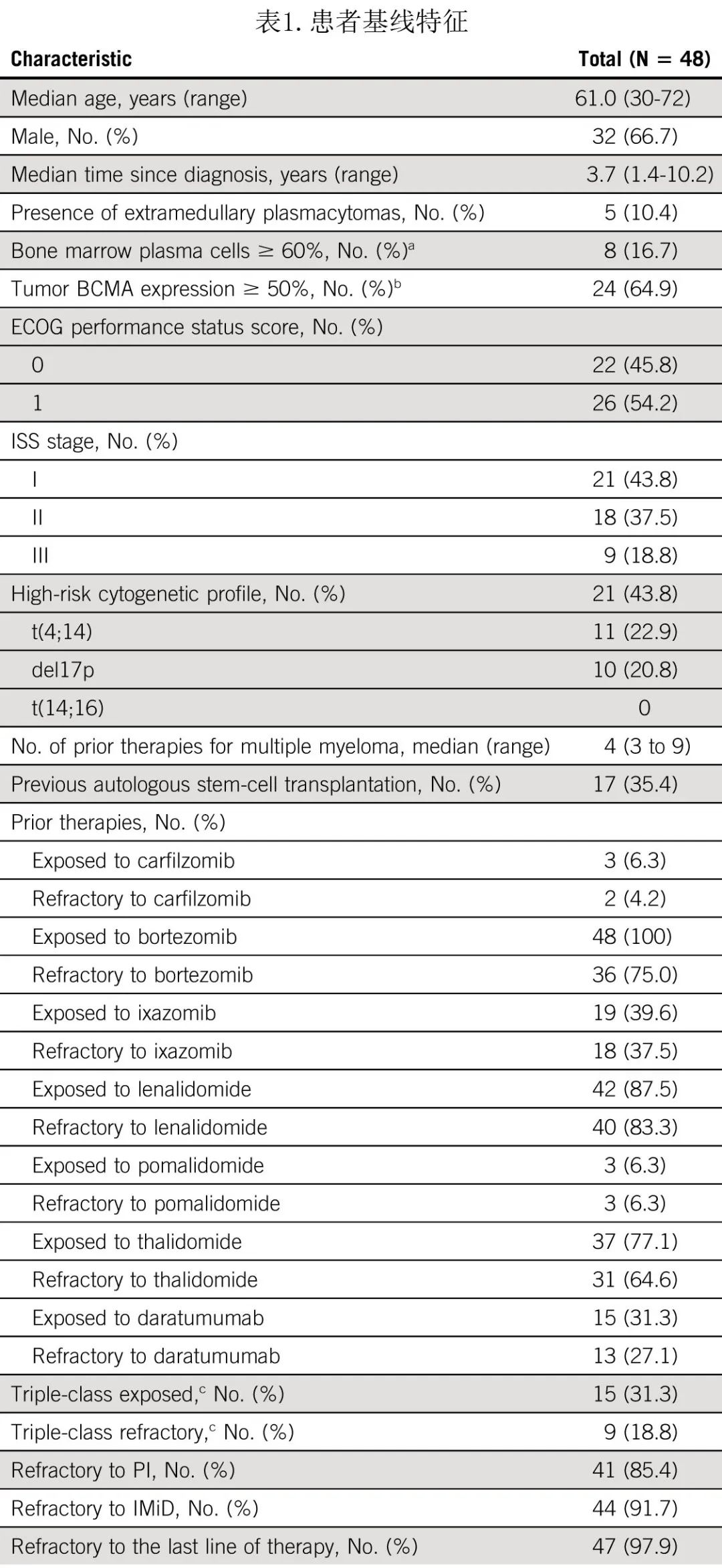
入组时,患者既往中位治疗线4线,31.3%为三类暴露;85.4%为 PI 难治,91.7%为 IMiD 难治,79.2%为 PI + IMiD 难治,27.1%为达雷妥尤单抗难治,18.8%为三类难治,97.9%为末线难治。17例 (35.4%) 患者既往接受过自体干细胞移植 (ASCT)。
中位 cilta-cel 剂量为0.67 X 106 CAR阳性 T 细胞/kg,研究中仅1 例患者剂量低于目标剂量范围(0.42 X 106)。数据截止日期2021年07月19日,38/48例患者仍在参加研究。
疗效
基于独立审查委员会(IRC)的缓解评估结果见表2。在中位随访18.0个月时,IRC评估显示 ORR 为89.6%,77.1%达到≥CR。至首次缓解的中位时间为0.95个月,至最佳缓解的中位时间为3.25个月,至≥CR的中位时间为3.32个月。40例样本可评估患者中的39例 (97.5%) 达到 MRD 阴性(10-5阈值),其中35例患者达到≥CR。
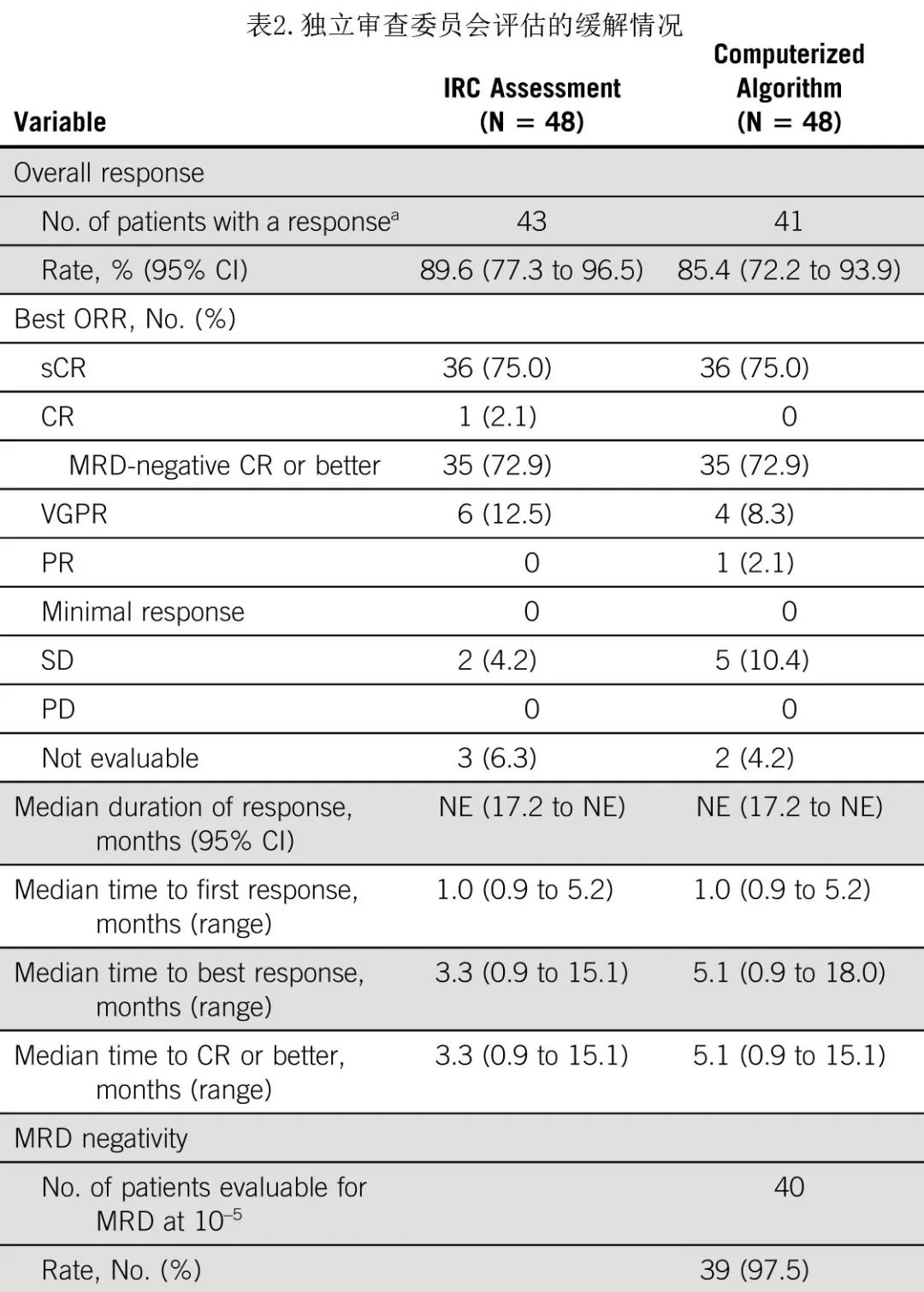
中位DOR未达到;43例缓解者中,67.2%的 DOR 达≥18个月。在数据截止时,33例 (76.7%) 患者的缓解仍在持续(图2),包括那例接受低于目标范围的 cilta-cel 剂量的患者也维持 sCR达28 个月。6例患者PD,其中4例是因为新发髓外浆细胞瘤和/或溶骨性病变,其最佳缓解为sCR (n=4)、VGPR (n=1) 和疾病稳定 (n=1)。
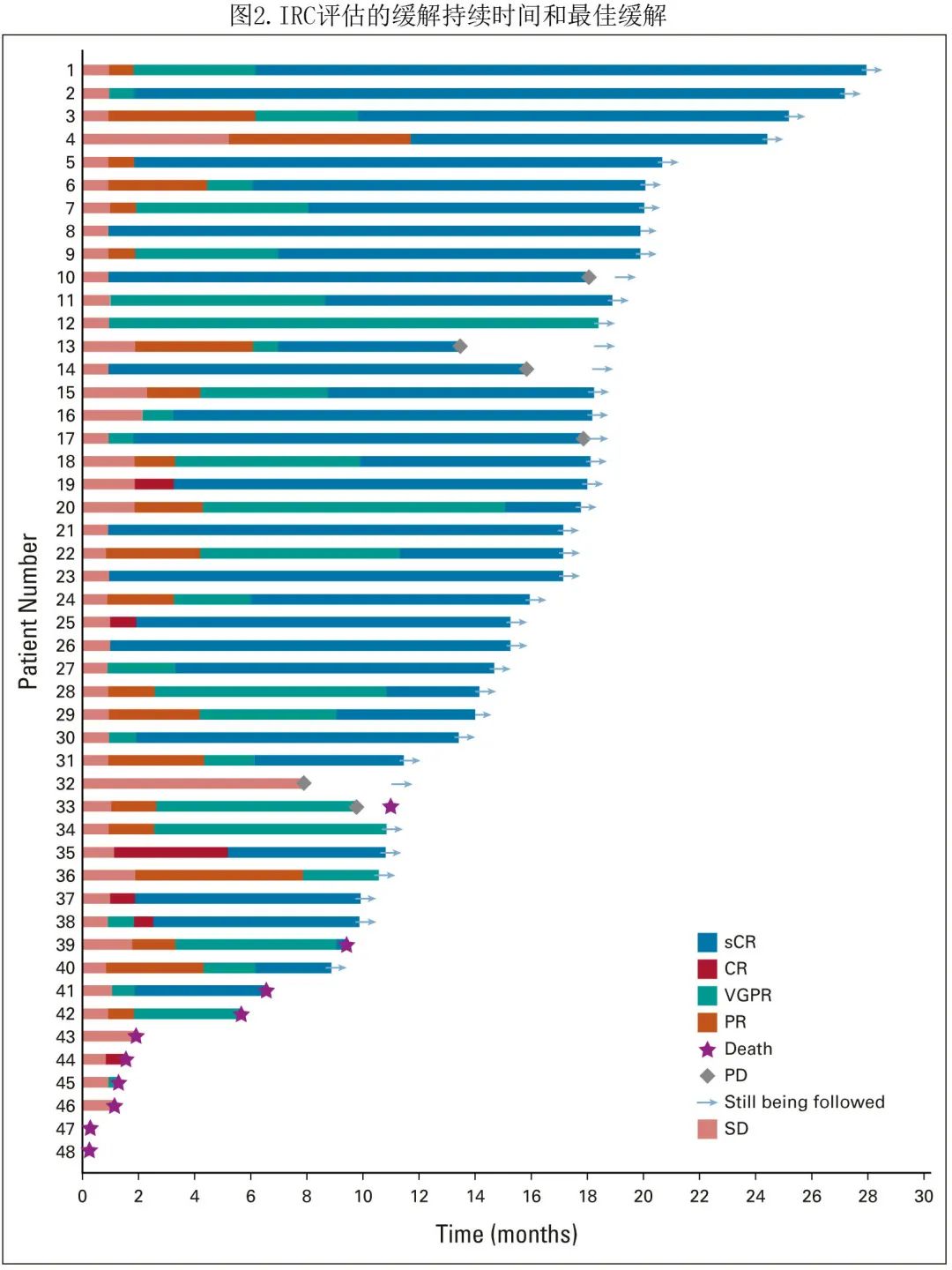
中位PFS未达到(图3A),12个月和18个月 PFS 率分别为77.0%和66.8%。中位OS未达到,18个月 OS 率为78.7%(图3B)。
此外多数患者亚组的ORR >80%,此外在CAR–T细胞明显扩增并进行了≥1次疾病评估的45例患者中M蛋白均显著降低
安全性
所有患者均发生治疗期间出现的AE(TEAE;表3)。最常见血液学 TEAE 为贫血 (100%)、白细胞减少(97.9%)、中性粒细胞减少(97.9%)、淋巴细胞减少(95.8%) 和血小板减少(87.5%)。52.1%的患者发生3/4级贫血,31.3%的患者接受了红细胞输注。在发生3/4级血小板减少的患者中 (n=26),14例接受了血小板输注,15例在第30天恢复至≤2级,20例在第60天恢复至≤2级。在46例发生3/4级淋巴细胞减少的患者中,43例在第60天恢复至≤2级。在发生3/4级中性粒细胞减少的患者中 (n=47),38例在第30天恢复至≤2级,43例在第60天恢复至≤2级。最常见的非血液学 TEAE 为CRS (97.9%)、AST升高 (68.8%)、低钙血症 (66.7%)、低钾血症 (62.5%)、ALT升高 (54.2%) 和低白蛋白血症 (50.0%)。

47例患者发生了CRS,其中17例 (35.4%) 为3/4级(附录图A3,仅在线)。中位发作时间为7天,中位持续时间为5天。在报告的52起 CRS 事件中,47起 (90.4%) 在数据截止时已消退;5例患者的5起 CRS 事件在死亡时尚未消退。46例患者 (95.8%) 接受CRS支持治疗,最常见的是托珠单抗 (91.7%)、镇痛药/抗炎药 (79.2%)、辅助供氧 (58.3%)、皮质类固醇激素 (41.7%)、静脉输液 (39.6%) 和/或血管加压药 (18.8%)。5例患者发生第二次CRS,3例患者发生噬血细胞性淋巴组织细胞增生症。
Cilta-cel输注后,1例患者发生了2例1级免疫效应细胞相关神经毒性综合征事件 (2.1%);另1例患者发生其他神经毒性,1级记忆受损和2级白质脑病。无患者发生运动和神经认知TEAE。
41例患者 (85.4%) 发生感染,其中37.5%(n=28) 为3/4级。最常见的感染为感染性肺炎 (35.4%)、上呼吸道感染 (33.3%) 和带状疱疹(18.8%)。5例 (10.4%) 患者发生 HBV 再激活,另外3例 (6.3%) 患者发生新的 HBV 感染。从输注至所有8例 HBV 事件发生的中位时间为205天,中位持续时间为129天。无患者发生新冠肺炎感染。
Cilta-cel输注后低丙种球蛋白血症很常见:约70%的患者在前200天内有≥1次最低免疫球蛋白 G(IgG) 测量值<400 mg/dL。大多数患者的 IgG 水平逐渐恢复,但在第400天后仍有6例 (20%) 患者保持在<400 mg/dL,3例 (10%) 保持在<200 mg/dL。
cilta-cel 输注后10例患者死亡(图1):2例发生在前30天内(首次疾病评估前),其余发生在60天内 (n=4) 或>100天 (n=4)。8例死亡由研究者评估为治疗相关:4级血小板减少时发生的出血,无法输注血小板(第7天);心源性猝死伴血红蛋白<50 g/L,无法输血(第9天);脓毒性休克(第35天);肝衰竭(第39天);肺炎(第47天); 4级血小板减少时颅内出血,血小板输注不足(第58天)、多器官衰竭(第172天)和肺真菌病(第199天)。与治疗无关的死亡是由于肺炎(第287天)和PD(第335天)。
结论
单次输注cilta-cel治疗既往中位治疗4线的中国 RRMM 患者带来了早期、深度和持久缓解,ORR可达89.6%。在达到≥CR的患者 (n=37) 中,35例也达到 MRD 阴性。此外数据截止时中位DOR、PFS和OS均未达到。
中国 RRMM 患者对有效治疗方案仍存在高度的未满足需求,目前已批准的治疗方案ORR 仅为29%-36%。CARTIFAN-1 研究的结果证实了其I期 Legend-2 研究的结果,并与美国Ib/II期CARTITUDE-1 研究的结果一致。这些研究表明,在该类重度预治疗的复发/难治性患者人群中,cilta-cel具有积极的风险-获益特征,提供了可有意义地改善临床结局的潜在治疗选择。
参考文献
Jian-Qing Mi, Wanhong Zhao, Hongmei Jing,et al.Phase II, Open-Label Study of Ciltacabtagene Autoleucel, an Anti-B-Cell Maturation Antigen Chimeric Antigen Receptor-T-Cell Therapy, in Chinese Patients With Relapsed/Refractory Multiple Myeloma (CARTIFAN-1).J Clin Oncol . 2022 Oct 21;JCO2200690. doi: 10.1200/JCO.22.00690.


