双重CRISPR疗法+长效抗逆转录病毒药物,清除体内HIV病毒
时间:2023-05-04 09:36:28 热度:37.1℃ 作者:网络
艾滋病(AIDS)是获得性免疫缺陷综合征的简称,由感染HIV病毒引起。HIV是一种能攻击人体免疫系统的逆转录病毒,它把人体免疫系统中最重要的CD4 T细胞作为主要攻击目标,大量破坏该细胞,经过数年、甚至长达10年或更长的潜伏期后发展成艾滋病病人,使人体丧失免疫功能,因抵抗力极度下降会出现多种感染,后期常常发生恶性肿瘤,以至全身衰竭而死亡。根据世界卫生组织(WHO)报告,全世界有超过3800万艾滋病患者。
虽然抗逆转录病毒疗法(ART)可以控制艾滋病的进展,甚至能让艾滋病感染者像正常人一样生活,但该疗法并不能治愈艾滋病,只是将体内的HIV病毒压制在较低的水平。 患者必须终生坚持每日服药,一旦停药,体内的HIV病毒就能够迅速复制,进而导致艾滋病发展。
对于绝大多数艾滋病患者来说,彻底治愈艾滋病的最大障碍就是体内的病毒库,也就是隐藏在细胞中的HIV病毒,如何彻底清除体内病毒库,才是治愈艾滋病的关键。
2023年5月1日,美国天普大学和内布拉斯加大学医学中心的研究人员在《美国国家科学院院刊》(PNAS)上发表了题为:CRISPR editing of CCR5 and HIV-1 facilitates viral elimination in antiretroviral drug-suppressed virus-infected humanized mice 的研究论文。
该研究表明,使用CRISPR-Cas9基因编辑技术,敲除CCR5基因,并靶向HIV-1病毒的LTR-Gag,结合长效缓释抗逆转录病毒疗法(LASER ART),能够在约60%的人源化小鼠模型中完全清除HIV-1病毒。

2019年7月,该团队在 Nature Communications 期刊发表论文【2】,该研究开发了一种长效缓释抗逆转录病毒疗法(LASER ART),将其与CRISPR-Cas9基因编辑技术结合,29%的人源化小鼠模型体内的HIV病毒被完全清除。这是首次从活体动物的基因组中清除HIV,标志着在治愈HIV感染中的关键突破。一年后,该团队将这项研究推进到了非人灵长类动物中,该研究结果于2020年11月发表在了 Nature Communications 期刊 【3】。
在感染后不久,HIV病毒就会将自身基因组整合到人类基因组中,因此,仅依靠目前的抗逆转录病毒疗法(ART)只能抑制HIV病毒而无法治愈。HIV病毒仍然存在于患者全身,因此必须在余生中的每一天服用药物来抑制它们,而这可能导致耐药性和其他并发症。这也是为什么我们需要开发一种能够清除体内HIV病毒的治疗方法,只有这样才能真正治愈艾滋病。
在这项最新研究中,研究团队制定了一项严谨的研究方案,首先给感染了HIV的人源化小鼠模型注射长效缓释抗逆转录病毒药物(LASER ART)。一个月后,研究团队使用CRISPR-Cas9基因编辑技术来敲除这些小鼠的CCR5基因。CCR5是HIV-1病毒感染和入侵人类细胞的受体,CCR5基因的缺失会导致HIV病毒无法进一步感染和在细胞间扩散。根据此前的研究数据,基因编辑后7天,CCR5表达水平降至最低。此时,研究团队进行了第二次CRISPR-Cas9基因编辑,靶向LTR-Gag,用来清除整合在基因组中的HIV-1 DNA,这一步与该团队在2019年发表的研究一致。
接下来,研究团队继续观察了这些小鼠2个月时间,研究团队使用多种高灵敏性检测技术,以确保不遗漏任何一个HIV拷贝,包括血液和已知的的HIV病毒会感染的所有器官。结果显示,治疗组的10只小鼠中有6只体内的HIV病毒被完全清除,再次重复实验结果显示,9只接受治疗的小鼠中有5只体内的HIV病毒被完全清除。
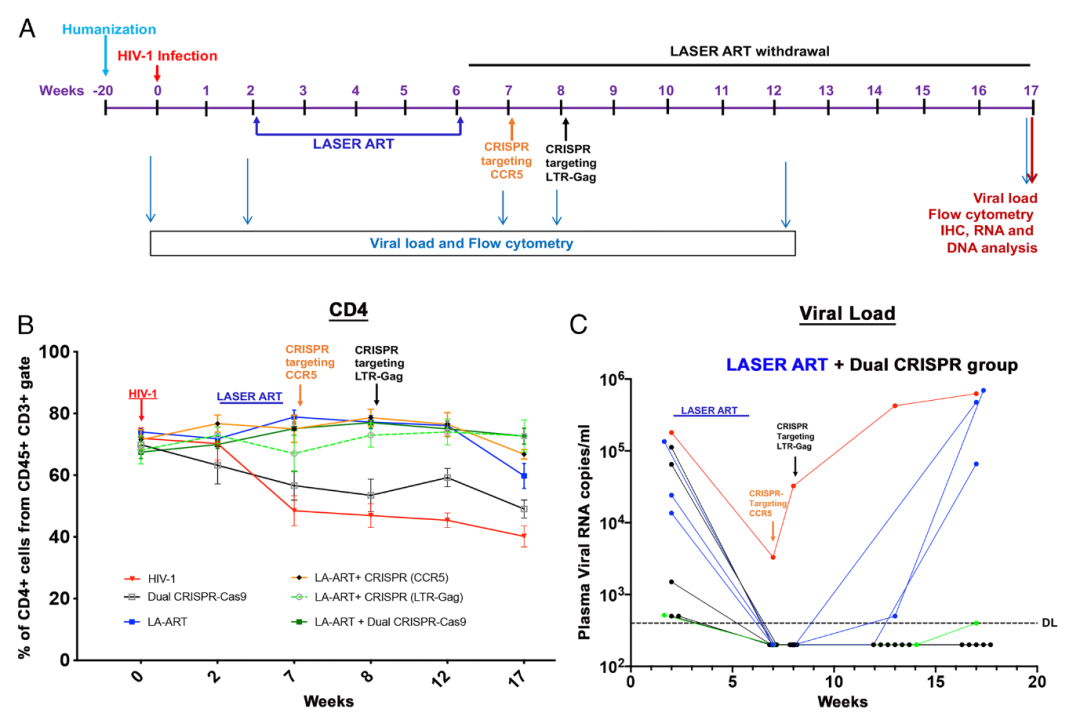

研究团队表示,这种治疗策略的优点有两方面,首先,CRISPR基因编辑仍然是永久清除HIV病毒的首选方法,其次,通过CRISPR基因编辑敲除CCR5,可以进一步促进对HIV病毒的清除。至于为什么还有一部分小鼠模型在治疗后仍出现了HIV病毒的反弹,很可能是药物递送系统的效率还不足。这种CRISPR+抗逆转录病毒的组合疗法的有效性是毫无疑问的,但还需要一个更高效的递送系统。

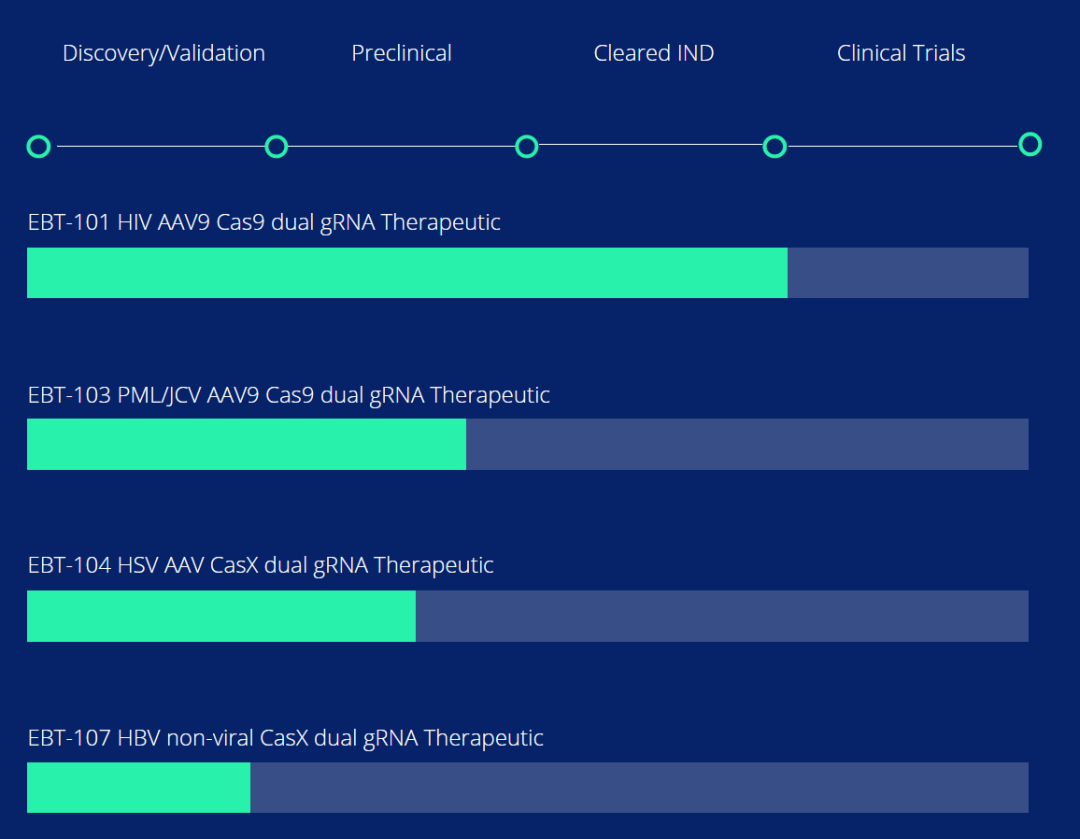
值得一提的是,研究团队基于这些成果创立了一家名为Excision BioTherapeutics的公司,并在2021年获得美国FDA批准开展基于CRISPR基因编辑的艾滋病治疗临床试验。该疗法目前正处于1/2期临床试验中。此外,由于研究中使用的腺相关病毒载体(AAV)只能一次性给药,研究团队也在开发可重复给药的纳米载体,以及其他病毒类载体。
除了治疗艾滋病,Excision 公司的研发管线还包括使用CRISPR基因编辑技术清除乙肝病毒(HBV)、单纯疱疹病毒(HSV)、乳头多瘤空泡病毒(JCV)等。
论文链接:
1. https://www.pnas.org/doi/10.1073/pnas.2217887120
2. https://www.nature.com/articles/s41467-019-10366-y
3. https://www.nature.com/articles/s41467-020-19821-7


