ASH 2022:CD123靶向ADC药物Pivekimab对复发/难治性AML效果良好,ORR为51%
时间:2022-12-14 06:00:05 热度:37.1℃ 作者:网络
Pivekimab Sunirine是一种CD123靶向抗体药物偶联物(ADC),临床开发用于血液恶性肿瘤,包括母细胞性浆细胞样树突状细胞肿瘤(BPDCN)、急性髓性白血病(AML)和其他CD123+血液恶性肿瘤。目前正在评价Pivekimab单药治疗BPDCN患者联合Vidaza®(阿扎胞苷)和Venclexta®(venetoclax)治疗未经治疗和复发性/难治性AML患者的情况。
Pivekimab使用ImmunoGen的新型吲哚苯二氮卓(IGN)有效载荷之一,使DNA烷基化,在无交联的情况下引起单链断裂。IGN被设计为对肿瘤细胞具有高效能,同时证明对正常骨髓祖细胞的毒性小于其他DNA靶向有效负荷。欧洲药品管理局(EMA)于2020年6月授予pivekimab治疗BPDCN的孤儿药资格。Pivekimab也在美国获得该认定。2020年10月,FDA授予pivekimab治疗复发/难治性BPDCN的突破性疗法资格。

在ASH年会上,公布了一项Ib/II期研究评估了Pivekimab联合阿扎胞苷+维奈托克治疗CD123阳性的R/R AML的患者。
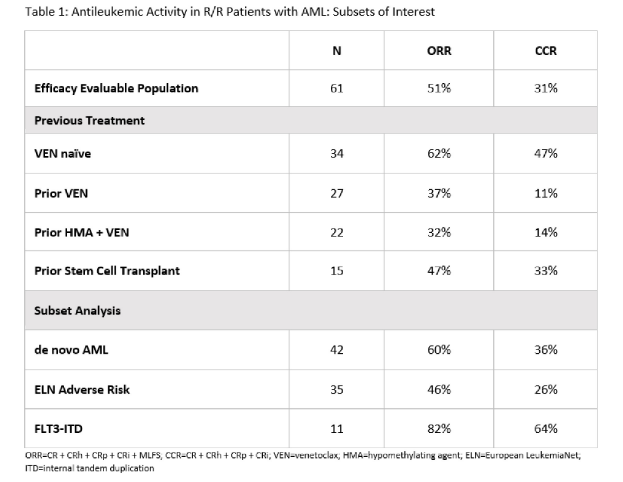
在61例疗效可评估人群中,ORR为51%,复合完全缓解率(CRR)为31%。34例维奈托克初治患者的ORR和CCR分别为62%和47%,而27例维奈托克经治患者的ORR和CCR分别为37%和11%。
亚组分析可知,42例原发AML患者的ORR和CCR分别为60%和36%。在11例携带FLT3-ITD突变的AML患者中,有9例观察到响应,ORR达82%,CCR为64%。
安全性方面,最常见的不良反应包括发热性中性粒细胞减少症(30%)、输液相关反应(21%)和肺炎(16%)。10%的患者因不良反应而中止了Pivekimab治疗,不过这些不良反应大多与Pivekimab无关。值得注意的是,患者30天死亡率为3%。
另外,几天前,吉利德将与ImmunoGen合作,该合作预计将于 2023 年启动,将成为 ImmunoGen 802 研究中的一个新队列,并将在多达 42 名 R/R CD123阳性 AML 患者中评估 pivekimab 与 magrolimab 联合使用。 该队列的主要终点是完全缓解 (CR) 率。 ImmunoGen 的 802 研究是一项开放标签、多中心、1b/2 期试验,旨在确定 pivekimab 的安全性和耐受性,并评估该药物与 Vidaza®(阿扎胞苷)和/或 Venclexta® 联合给药时的抗白血病活性( venetoclax)用于复发和前线 CD123 阳性 AML 患者。


