ICU急性重症胰腺炎患者的液体治疗
时间:2022-12-16 21:02:03 热度:37.1℃ 作者:网络
ICU急性重症胰腺炎患者的液体治疗
重症行者翻译组
摘要
急性胰腺炎(AP)患者经常需要入住ICU,尤其当出现多器官功能衰竭的迹象时,这种情况下将AP定义为急性重症胰腺炎。其特点是胰腺大量释放促炎因子,导致全身炎症反应综合征(SIRS)和严重的血管内液体流失。导致混合性的低血容量性休克和分布性休克,最终导致多器官衰竭(MOF)。积极的液体复苏传统上被认为是AP的主要治疗方法。事实上,所有现有指南都强调了液体治疗的重要性,尤其是在发病后最初的24-48小时内。然而,目前对于液体类型、最佳输液速度、总液体量或液体治疗的目标都没有一致的意见。一般说来,乳酸林格氏液的起始量为5-10ml/kg/h,24小时为宜。液体输注应在入院后的前几个小时内积极进行,并仅在适当的时间范围内持续,通常在入院后24-48小时后停止或显著减少。密切的临床和血流动力学监测以及明确复苏目标的定义是基础。密切的临床和血液动力学监测以及明确的复苏目标的定义是非常必要的。普遍接受的目标是尿量、心动过速和低血压的好转以及实验室指标的改善。然而,不同复苏终点对指导液体治疗的有用性却存在着很大争议。大多数现有指南都认可密切监测液体输注和液体平衡的重要性,以避免液体过量的有害影响。对于重症急性胰腺炎患者而言,如同在ICU内其他需要大量液体治疗的常见疾病,如脓毒性休克和烧伤患者一样,其液体治疗的决策应当审慎。在严重AP的早期,临床医生应当在无创和有创性血液动力学参数以及实验室标记物的联合指导下,通过正确的液体治疗以满足器官灌注需求,同时也应避免液体超载。在这篇叙述性综述中,讨论了关于重症急性胰腺炎液体治疗的最新证据,并提出了一种基于个体化方法的液体治疗的操作算法。
前言
急性胰腺炎(AP)是胰腺的急性炎症性疾病,是需要住院治疗的最常见的胃肠疾病之一。大约80%的急性胰腺炎患者病情轻微,具有自限性,在非危急情况下只需简单治疗。然而,15-20%的急性胰腺炎发作为中度严重或重度,可能导致多器官功能衰竭(MOF),其死亡率高达20-40%。
根据亚特兰大胰腺炎分类,急性胰腺炎可分为2种类型(间质性和水肿性/坏死性),严重程度可以分为3级(轻度、中度、重度)。间质性胰腺炎是指弥漫性炎症性水肿,而坏死性胰腺炎的特征是涉及胰腺实质和/或胰周组织的坏死。间质性和坏死性胰腺炎都可能是严重的;然而,间质性胰腺炎通常是轻度的,通常在48小时内好转,病死率低于5%。另一方面,坏死性胰腺炎(在5-10%的AP患者中观察到)通常表现出更严重的病程。AP的严重程度与MOF的发展密切相关,通常涉及心脏循环、肾脏和肺部系统。如果器官衰竭持续不到48小时,AP被定义为中度严重,而如果器官衰竭持续超过48小时,则AP被定义为严重(急性重症胰腺炎,SAP)。与多器官功能衰竭无直接关系的并发症(如胰腺假性囊肿和空腔脏器穿孔)的讨论不在本综述的范围内,可在其他地方找到。
在器官衰竭的情况下,需要进入重症监护室(ICU)。除了一些特殊情况(如内镜逆行胰胆管造影术,ERCP),无其他特殊的治疗方法。因此,SAP的治疗是支持性的,主要基于液体治疗、肠内营养和疼痛处理。很多作者认为静脉(IV)液体治疗是SAP的治疗基础,尤其是在发病后的第一个24小时内。
本综述的目的是讨论关于急性重症胰腺炎液体治疗的最新证据,并提出一个基于临床、血流动力学和实验室监测的、个体化的静脉输液方法的可操作算法。
低血容量和器官衰竭
病理生理
体液流失和细胞因子释放是导致AP严重程度的两个主要病理机制。一方面,促炎因子(IL-1、TNF-α和IL-6)的大量胰腺释放导致SIRS、血管扩张和细胞功能障碍。另一方面,一些因素导致了广泛的血管内液体流失(图1)。首先,呕吐和腹痛会影响进食,并增加胃肠液的损耗。第二,与疼痛、全身炎症和发热有关的呼吸急促和出汗会增加非显性失水。最后,也是最重要的,胰腺炎症和SIRS与局部和全身毛细血管通透性增加有关,导致血管外液体积聚。值得注意的是,局部微循环功能障碍会导致胰腺组织灌注不足和缺血,这可能会扩散到全身,并进一步加剧胰腺损伤。这种恶性循环也可能对空腔脏器造成损害。尤其是,肠腔内可能会发生肠梗阻和液体积聚。此外,液体扣留经常发生在腹膜后间隙,并可导致腹内高压和腹腔间隔室综合征。
总之,SAP患者通常表现为严重的低血容量和分布性休克,最终导致MOF的发生。然而,液体损耗/转移的程度却难以精确评估。据报道,在48小时内,轻症胰腺炎的液体损失可高达4000ml,在更严重的情况下可高达6000ml。一些研究发现,液体损失量越多,其并发症发生率和病死率也就越高。
液体复苏:总体推荐建议
现有的AP治疗指南都强调了早期液体治疗的重要性。然而,目前有关液体治疗的类型和最佳液体速率或输液目标均没有达成一致性意见 (表1)。在这种情况下,应该记住AP的三个主要特征。首先,AP是一种动态疾病,在最初的发病后病情会恶化。因此,需要持续地监测和反复地评估液体需求。其次,AP被认为是一种时间依赖性疾病,其结果可能会受到干预措施是否及时的影响。
事实上,疾病发作的最初的几个小时被认为是防止SIRS、MOF和/或胰腺坏死恶化的关键。然而,另一方面,在毛细血管通透性增加的情况下,给予过量液体也可能是有害的。第三,SAP背景下的低血容量并非单纯的血管内容量减少,而是SIRS导致的低血容量和微循环功能障碍的综合结果。此时请注意,液体治疗可能会在调节炎症和降低毛细血管通透性方面发挥作用。
一些研究表明,低血容量状态的快速逆转与患者的预后改善是相关的。另外,很多动物实验表明,充足的液体治疗可以减少胰腺损伤,甚至在某些情况下还可以降低病死率。基于这些结果,因此大多数指南提倡早期和充分的液体复苏。
一些实验室指标,比如红细胞压积(Hct)和血尿素氮(BUN)传统上被认为是低血容量的标志,它们可能有助于评估液体状态。因此,如果这些指标在入院时是高的以及在最初24-48小时内的增加可能表明液体复苏不充分。
血液浓缩(即高Hct)与大量液体扣留(比如集聚在腹膜后)和血液粘度增加有关,这本身可导致胰腺微循环受损,促进胰腺坏死。有几项研究报告了在患者入院时Hct ≥ 45%时,后续出现病情严重的可能性更高。同样,未能在第一个24小时内降低Hct与液体治疗不足和更差的结果相关。
此外,低血容量可能会导致血尿素氮增加。但其特异性较低,因为其增加的因素可能是多方面的:低血容量、肾衰竭、蛋白质分解代谢增加和消化道出血。然而,入院时的高BUN值(≥20 mg/dL(7.12 mmol/L)),无论其潜在原因如何,以及在24小时内BUN值的增加,都被认为是器官衰竭/死亡的预测因素。
尽管文献中讨论了这两个参数,但与BUN相比,Hct可能是指导液体复苏的更有吸引力的终点,因为BUN更容易受到危重患者常见的其他病理状况的影响。此外,Hct的测量相对简单,因为它通常是根据床旁动脉血气分析的结果计算而来的。
输液速度和液体总量
目前,液体治疗的最佳时机和速度依然未知。但现有指南推荐早期和积极的液体治疗。该定义指的是在发病的最初几个小时内使用较快的输液速度,而在随后的几天较慢的输液速度。
Gardner等人回顾性分析了一组45例SAP患者住院的前72小时的液体治疗情况。当在第一个24小时内输注超过三分之一的液体总量时,该治疗被定义为“早期液体复苏”,而如果在第一个24小时内输注不足三分之一的液体总量时,则该治疗被定义为“晚期液体复苏”。如同预期的那样,在最初的24小时内,液体量的差异是显著的:“早期”复苏组几乎达到了5000ml,而“晚期”复苏组则不到2000ml。
有趣的是,与“晚期”组相比,“早期”组的死亡率显著降低。基于Gardner和其他类似的发现,在SAP的早期阶段已经给予了越来越多的液体。
目前,不同的指南对表现为低血容量的AP患者提出了几种不同的初始液体速度(表2)。
-
前24小时为5-10 ml/kg/h,直至达到复苏目标。建议的目标是心率(HR) < 120 bpm,平均动脉压(MAP) > 65 mmHg,尿量(UO) > 0.5 ml/ kg/h,Hct 35–44%。
-
前12-24小时250-500 ml/h的等渗晶体,超过这段时间后益处很小,目的是降低BUN和Hct。
-
休克或脱水患者为150-600 ml/h,直到MAP > 65 mmHg,UO > 0.5 ml/ kg/h,无严重低血容量表现的患者为130-150 ml/h。
其他输液策略见表2。在早期的关键阶段之后,液体速度通常会降低到2–3 ml/kg/h。密切的临床监测和明确的复苏目标的界定是基础。普遍接受的目标是尿量,心动过速和低血压的逆转,以及实验室指标的改善,如BUN和Hct。但不同的复苏终点对指导液体治疗的有效性仍有争议。然而,对于密切监测液体状态的重要性却是大家普遍认可的共识,以减少液体超负荷的风险。
在大多数情况下,在第一个24小时内累积输注2500–4000 ml 的液体已被证明足以达到复苏目标。然而,临床医生应该意识到在初始阶段每天可能需要多达5000ml,甚至更多的液体。
过量输液的并发症
尽管静脉输液治疗有明显的好处,但过量输液会导致一些并发症。总体而言,显著的液体正平衡与危重患者的更差结局相关。
渗漏的液体可能滞留在间质中,导致间质性水肿、器官灌注受损,甚至可导致急性肺水肿。在SAP的特定情况下,肠壁水肿和腹膜后积液会导致腹腔间隔室综合征的发生,这个并发症是令人担忧的。在持续性全身炎症(即高毛细血管渗漏)和累积体液量正平衡(即水肿形成和多间隔室综合征)并伴有持续性器官衰竭的情况下,可能会出现全身通透性增加综合征(GIPS)。因此,最重要的是要精心设计液体疗法。
很多作者在观察性研究中描述了较高的静脉输液量与腹内压增加、器官衰竭增加以及AP特定情况下病死率之间的关系。尽管进行了多次校正和标准化,但这些观察性研究的本身限制了研究结果的可靠性,因为更严重的AP患者通常需要更多的液体,预后更差。因此,在这些情况下,很难确定液体量和结果之间的因果关系。
迄今为止,只有少数的随机临床试验(RCT)比较了更积极和更保守的复苏策略。一个中国小组对SAP患者进行了两次随机临床试验。在第一项研究中,一组接受10-15 ml/kg/h的固定输液速度,而另一组接受5-10 ml/kg/h,这是实现血流动力学稳定所需的。在第二项试验中,一组患者在入院时快速接受静脉输液,目标是Hct < 35%,而另一组患者的目标Hct > 35%。在这两项研究中,作者报告了大容量输液时脓毒症的发生率、因液体超负荷导致的并发症和病死率都较高。然而,这些研究的结果不是决定性的,因为在这些研究中已经发现了几个缺陷(随机方法不明、胰腺坏死发生率未报告、液体输注量的数据矛盾)。
总之,目前尚不知道如何确定正确的静脉液体量和输注速率,以防止或逆转器官衰竭的发展,并减少由于液体超负荷引起的并发症。
根据最近的证据和专家意见,液体治疗应根据患者的实际需要而量身定制,可在最初的几个小时内加强,并只在适当的时间框架内继续。由于这个原因,液体治疗通常在患者入院后的第一个24小时后停止或显著减少。
值得注意的是,那些在经过液体治疗的前6-12小时后仍然没有表现出快速临床改善的患者可能不会从大量液体治疗中获益。
静脉液体的类型
SAP情况下的理想液体应该是能够通过恢复细胞外液体容量从而改善血流动力学/器官灌注,同时在毛细血管通透性改变的情况能够下调炎症反应。晶体液和胶体液是重症监护环境中可用的两大液体类型。理论上,它们二者在液体室中有着不同的分布,从而导致血管内容积扩张的程度不同。重要的是,二者之间表现出的副作用也不同。
在比较急性胰腺炎不同液体管理策略的研究中使用了不同液体类型或组合的液体:生理盐水(NS)、平衡晶体液或晶体和胶体组合的混合策略(如白蛋白、淀粉和新鲜冰冻血浆)。不同的液体类型可能对某些临床结果产生不同的影响。在一项回顾性研究中,Ye等人观察到积极的复苏策略与SAP患者急性肾损伤的发生率增加相关。值得注意的是,大容量复苏(最初24小时内> 4000 ml)和因输注生理盐水导致的高氯化物暴露都是急性肾损伤(AKI)的独立危险因素。在其他研究中,高氯血症与危重患者的肾衰竭有关。
晶体液
生理盐水(0.9%氯化钠溶液,NS)和平衡晶体溶液(如乳酸林格氏液,RL)是临床广泛使用的液体。平衡溶液更类似于细胞外液,因为它们包含一些有机阴离子(缓冲剂),一旦输给患者,这些阴离子就会代谢,从而降低患者体液中的氯化物浓度。不同的晶体具有不同的强离子差异(SID),即强阳离子(主要是[Na+])和强阴离子([Cl-])的差异。根据Stewart的酸碱方法,SID是影响生物溶液pH值的独立变量。根据使用的定义,正常血浆SID范围在33-40 mEq/L之间。SID减少会导致系统酸中毒,而SID增加会导致碱中毒。因此,输注的类晶体中的SID(有机阴离子代谢后)可能会显著改变血浆SID,从而影响pH值。生理盐水的SID为0 mEq/L,因为Na+和Cl-具有相同的浓度,因此其净效应总是酸化。另一方面,平衡晶体的输注SID范围在28-55 mEq/L之间,对血浆酸碱的影响减少。
乳酸林格氏液(RL)是一种轻度低渗、平衡的晶体液,在一项小型的RCT中,对于AP患者将乳酸林格氏液与0.9% NaCl进行液体复苏比较。结果在这项试验中,随机分配到RL组的患者在入院后24小时SIRS的患病率降低,C反应蛋白浓度降低。其他作者也描述了类似的发现。
对这些发现的解释如下,可能是因为乳酸具有免疫调节、抗炎和器官保护作用,但也可能是因为高浓度氯化物的有害作用。事实上,动物研究表明,外源性盐酸负荷可能会恶化急性胰腺炎,因为胰腺腺泡水平的局部酸化可能有促进胰腺水肿/坏死的作用。尽管缺乏这方面的临床数据,但这些发现为避免大量输注0.9% NaCl导致的外源性酸负荷提供了额外的理论依据。最后,值得一提的是,等渗液体除了提供水之外,还含有大量的钠,这可能导致水和盐超载,最终促进水肿的形成。
胶体液
胶体液是基于溶解在晶体中的半合成或血浆衍生分子的溶液。人血白蛋白、淀粉、明胶和葡聚糖都是临床实践中使用的胶体液。理论上,这些胶体的分子大到足以被半透膜截留,并且应该能比晶体液发挥更高的胶体渗透压。其公认的优势是以更少的液体输注量就能实现更大的容量扩张效应,并在血管腔内持续更长时间,从概念上讲具有更少的水肿形成和更好的血液动力学稳定性。然而,它们在危重患者中的使用也备受争议。事实上,在死亡率方面,与晶体液相比,胶体液并不存在明显的益处,恰恰因其潜在的有害作用而被人们所诟病。
在急性胰腺炎的特殊情况下,动物实验表明,右旋糖酐复苏可能优于晶体液,这可能是由于改善了胰腺灌注。在人类中,只有少数研究评估了胶体液在AP/SAP患者液体复苏中的应用。赵等人将接受羟乙基淀粉(HES)和生理盐水(NS)1:1比例治疗的患者与接受生理盐水单独治疗的患者进行了比较,观察到第一组患者在血液动力学稳定和微循环灌注改善所需的时间更短。然而,HES色使用已在危重患者中进行了大量研究,其不良反应已在大型随机对照试验中显示。因此,目前的证据并不支持在大多数入住ICU的患者中使用HES,包括SAP患者。
因此,鉴于现有证据为中等质量,显然没有关于SAP中理想液体的结论性证据,指南中也没有提供明确的指示。然而,大多数专家和指南推荐晶体液,其中,RL通常是液体的选择。
液体复苏:个体化方法
最近的数据支持在SAP需要转入ICU的情况下,量身定制和个体化液体治疗的重要性。如上所述,早期和积极的液体治疗对一些患者有益,但对另一些患者有害。轻度急性胰腺炎患者可以耐受积极的液体治疗,因为患者能够排除多余的液体。相反,SAP患者具有持续的器官衰竭和显著增加的血管通透性。在此情况下,大量的静脉输液可能会导致水和盐超载,并进一步恶化病情。考虑到危重病人不适当输液的潜在危害,需要对病人进行仔细监测。
可以指导SAP患者液体复苏的临床终点可以分为三组:(1)无创的临床参数、(2)有创性血液动力学参数和(3)实验室指标。
-
无创的临床参数
通常容易监测的临床参数包括:平均动脉压(MAP)、心率(HR)和尿量(UO)。心率快和/或低平均动脉压和UO均可提示低循环血量、低氧输送和受损的终末器官灌注。HR < 120/min,MAP在65-85 mmHg之间,UO > 0.5 ml/kg/h是SAP治疗的理想终点。上述的参数单独异常值或伴有器官灌注不足的其他迹象提示应在早期液体治疗。皮肤花斑评分和毛细血管再充盈时间(CRT)是微血管灌注的其他有用的临床标志,并且在这种情况下可以是有用的临床参数。
-
有创性血液动力学参数
侵入性的血液动力学参数,例如从中心导管或从动脉脉搏轮廓分析获得的参数,可用于评估血容量减少和液体反应性。心脏前负荷的静态指标,如中心静脉压(CVP)仍然在临床实践中使用,尽管它们的使用备受争议。在右心衰竭的情况下,CVP值作为避免液体超负荷的安全界限可能是有用的。经校准的血液动力学监测系统,如PiCCO(德国Feldkirchen的Pulsion Medical Systems SE)基于经肺热稀释法。这种系统在ICU中很常见,并且在SAP的特定环境中也进行了研究,结果令人鼓舞,表明PiCCO参数可以更好地与心输出量的变化相关联,并且可以指导液体复苏,获得良好的临床结果。
-
实验室指标
乳酸(Lac)水平和中心静脉饱和度(ScvO2)是器官灌注和氧输送的间接标志。器官灌注不足和细胞水平的氧利用不足是SAP早期大量液体流失的最终结果,也是血液动力学休克状态的关键特征。此外,如前所述,Hct和BUN也是有用的实验室标记物,可以帮助估计入院时液体丢失的严重程度。
最近提出了危重患者液体复苏的四个不同阶段,并通过R.O.S.E .助记(复苏Resuscitation、优化Optimization、稳定Stabilization、清空Evacuation)概念化,这同样也适用于SAP患者。在超急性期(阶段1,复苏),患者可能处于低血容量性休克,因此医生必须通过大量补液以提供早期、充分的目标性液体管理。为了实现足够的灌注,液体正平衡是不可避免的,并且也是可以接受的。在优化阶段(第2阶段),尽管血容量仍然不足,SAP患者更多的表现为代偿性休克。必须定期评估个人的液体需求。目标是维持足够的组织氧合以限制器官损伤,并维持液体正负平衡以避免液体超载。腹内压的测量已被提倡用于有腹部问题的患者,以监测腹腔间隔室综合征的发展情况。稳定期(3期)在接下来的几天内逐渐发展,循环性休克的表现消失。此阶段只需补充正在流失的液体。最后,当急性损伤消退时,清空(阶段4)从自发清空(“流动”阶段)开始。当自发性清空效果欠佳时,可主动采用利尿剂清除液体。如果将该模型应用于早期SAP的临床情况,则大多数液体治疗旨在逆转复苏阶段和优化阶段的低血容量。在这两种情况下,都提倡个体化的液体管理方法。
单一的临床参数不太可能单独反映出总体的容量状态,同时评估多个参数被认为更加可靠。在第一个24小时内,应经常对患者进行重新评估,最好是每2-3小时评估一次,以便根据这些参数的变化及时调整液体用量,从而避免液体治疗的不足或过度问题(图2)。
在第一个复苏阶段以及随后的优化阶段,可以考虑使用血管加压药(如去甲肾上腺素)。在SAP期间,低血压部分是由于血管舒张导致的,液体复苏后通常出现高动力循环状态。在非常早的阶段,液体实际上是必须的,但在液体复苏进行的同时,血管加压药可能作为一种辅助药物来暂时提升过低的MAP。在接下来的几个阶段,需要不断地重新评估对液体的需求:当担心MAP低时,可以使用血管加压药,尽管患者貌似血容量正常。然而,有显著低血容量迹象的SAP患者不应单纯使用血管加压药而应尽快给予液体治疗,因为单纯使用血管加压药可能存在进一步器官灌注不足的风险。一旦患者液体状态得到优化,则应考虑进入清空液体阶段。
最近的和正在进行的研究
关于SAP期间液体治疗的三个主要问题依然没有完整的答案。首先,在疾病的早期阶段液体治疗的最佳速度和程度。第二,用以指导液体复苏的最准确的临床终点和实验室终点。第三,大容量液体复苏时,能够同时保证最好疗效和最大安全性的最佳液体是哪种液体。
WATERFALL研究(de Madaria E, et al. Aggressive or moderate fluid resuscitation in acute pancreatitis. N Engl J Med. 2022;387(11):989–1000.)是最近发表的随机对照研究。该研究旨在比较急性胰腺炎患者积极液体复苏和适度液体复苏方案。但在该研究的基线资料中,符合中-重度或重度胰腺炎标准的患者却被排除在外。其中122名受试者接受了积极的液体复苏(RL 20 ml/kg 快速输注,持续2小时,然后以RL 3 ml/kg/h 的速度持续静脉输注),其他127名受试者接受了适度液体复苏(对于血容量不足的患者以RL 10ml/kg的速度快速输注,或对于血容量正常的患者不予快速输注,然后以RL 1.5 ml/kg/h的速度持续静脉输注)。与适度复苏组相比,积极复苏组的患者出现明显液体超负荷的情况更多,但其临床结果并无改善。
其他正在进行的随机对照试验主要集中在生理盐水和其他晶体液之间的比较。Farrell等人计划招募80名接受RL或NS治疗的儿科急性胰腺炎患者,以评估24小时和48小时的炎症标记物和SIRS状态(clinicaltrials.gov NCT 03242473)。Poropat等人旨在招募276名患有急性胰腺炎的成年患者,在随机分组后的第一个60分钟内以10 ml/ kg的初始剂量接受勃脉力(译者注:Plasmalyte,勃脉力,一种复方电解质注射液)或生理盐水,然后在接下来的72小时内以2 ml/kg的速度输注(Clinicaltrials.Gov NCT 04688645)。该研究的主要终点是SIRS的发生率。
结论 
液体治疗是急性重症胰腺炎患者入住ICU的关键治疗方法。它是一种被广泛接受的早期的和积极的液体疗法,但它却在最近因为潜在的危害和在临床试验中不确定的疗效而受到质疑。由于使用固定的输注速度时可能存在复苏不足的风险,因此需要一种更加精准的方法。它应该基于对患者容量状态的仔细评估,对于最严重的病例,在入院的最初几个小时增加容量扩张。晶体样液体,尤其是RL,是首选液体,建议初始液体输注速度通常在5-10 ml/kg/h之间。然后,如果在第一个24小时内达到复苏目标,则可将液体速度降低至2-3 ml/kg/h。SAP患者应在ICU中接受严格监测,并且在ICU中有先进的血液动力学监测系统可以指导临床医生。
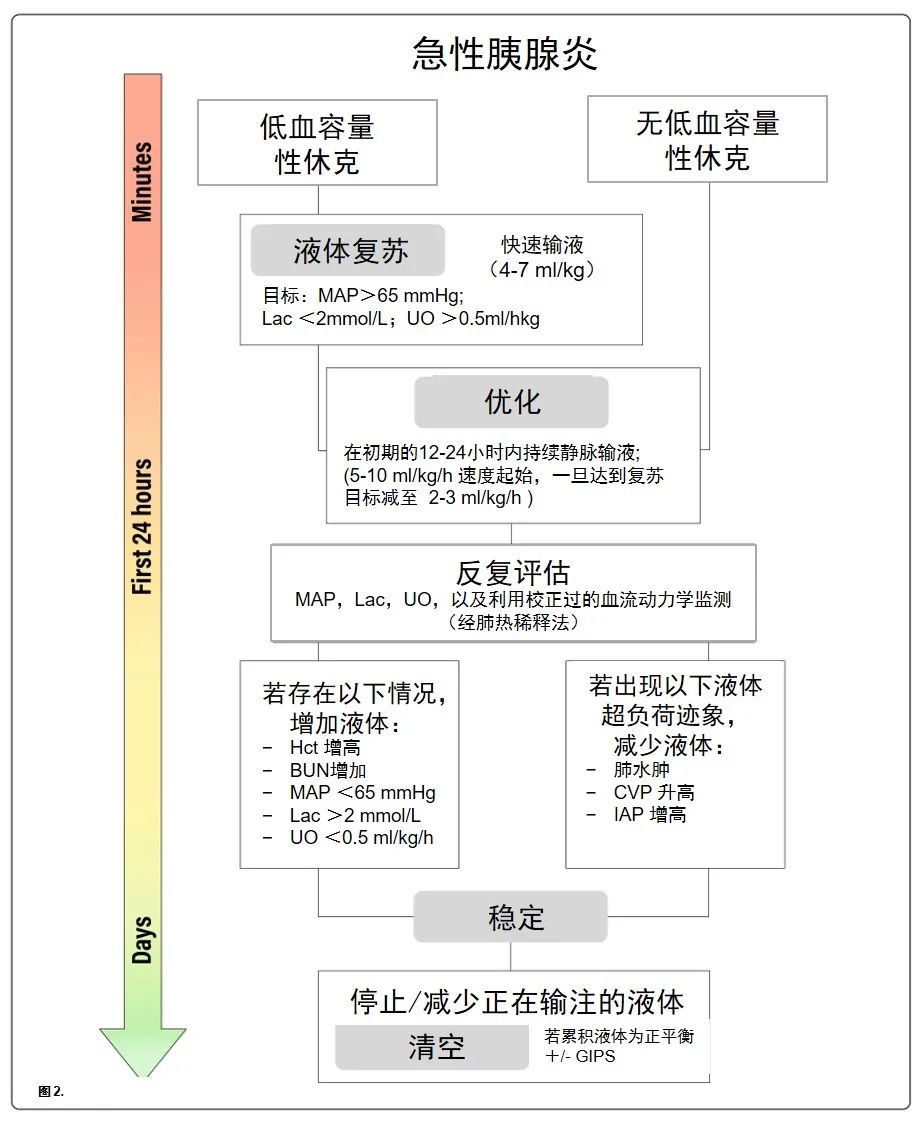 图2.急性重症胰腺炎液体复苏的建议流程。低血容量性休克可以通过静脉注射平衡晶体来逆转,直到达到复苏目标。在优化阶段,应提供连续灌注以满足持续的液体损失。需要在先进的血液动力学监测系统的指导下进行持续的再评估,以评估对液体的进一步需求,目的是为了确定真正的液体需求,同时评估任何液体超负荷的迹象。稳定阶段在接下来的几天里逐渐发展。在这种情况下,只需补充正在流失的液体,当急性损伤消退时,清空液体阶段从(机体)自发性清空或(使用利尿剂)诱导性清空开始。MAP,平均动脉压;UO,尿量;Hct血细胞压积;BUN,血尿素氮;IAP,腹内压;CVP中心静脉压;GIPS,全身通透性增加综合征。
图2.急性重症胰腺炎液体复苏的建议流程。低血容量性休克可以通过静脉注射平衡晶体来逆转,直到达到复苏目标。在优化阶段,应提供连续灌注以满足持续的液体损失。需要在先进的血液动力学监测系统的指导下进行持续的再评估,以评估对液体的进一步需求,目的是为了确定真正的液体需求,同时评估任何液体超负荷的迹象。稳定阶段在接下来的几天里逐渐发展。在这种情况下,只需补充正在流失的液体,当急性损伤消退时,清空液体阶段从(机体)自发性清空或(使用利尿剂)诱导性清空开始。MAP,平均动脉压;UO,尿量;Hct血细胞压积;BUN,血尿素氮;IAP,腹内压;CVP中心静脉压;GIPS,全身通透性增加综合征。


