CD(IF=38)| 中国科学院周斌团队揭开成人胰腺中外分泌细胞命运转换的奥秘
时间:2023-01-08 15:00:50 热度:37.1℃ 作者:网络
阐明组织内稳态和修复过程中细胞命运的可塑性可以为干细胞生物学和再生医学提供可操作的见解。在胰腺中,外分泌细胞之间的谱系转分化是否在病理生理条件下发生仍有争议。
2023年1月3日,中国科学院分子细胞科学卓越创新中心周斌研究组在Cell Discovery 杂志在线发表题为“Use of a dual genetic system to decipher exocrine cell fate conversions in the adult pancreas”的研究论文,该研究使用了双重组酶介导的遗传系统,使用两个不同的遗传报告器同时追踪胰腺腺泡和导管细胞,避免了Cre-loxP重组系统的“异位”标记。
研究发现腺泡到导管的转分化发生在胰管结扎或青色素诱导的胰腺炎期间,而不是在稳态期间或部分胰腺切除术后。另一方面,胰腺导管细胞在腺泡细胞显著减少后,有助于形成新的腺泡细胞。通过细胞增殖的基因追踪,我们还量化了细胞增殖动态,并推导出在稳态期间胰腺外分泌谱系的周转率。总之,这些结果表明,谱系转分化发生在特定条件下的胰腺外分泌腺腺泡细胞和导管细胞之间。

胰腺的绝大部分是外分泌胰腺,主要由腺泡细胞和导管细胞组成。胰腺腺泡细胞可以产生和释放大量的消化酶,包括淀粉酶、脂肪酶和蛋白酶,而导管细胞可以将这些酶输送到十二指肠。先前的研究表明,成人胰腺腺泡细胞可能是β细胞新生的重要来源,这一结果在该领域引起了极大的热情和关注。
中心腺细胞被定义为特化的末端导管上皮细胞,并被认为是内分泌和外分泌胰腺再生的祖细胞。所有的胰腺上皮谱系都被认为起源于胚胎发育时期共同的多能胰腺祖细胞。然而,在成年哺乳动物胰腺的病理生理条件下,外分泌谱系转换是否存在仍然存在争议。
基于Cre-loxP重组系统的多项开创性遗传学研究显示,导管细胞对出生后腺泡细胞命运的贡献有不同的结果。一项使用CAII- CreER的研究表明,成年碳酸酐酶II (carbonic anhydrase II, CAII)阳性的胰腺导管细胞作为祖细胞产生新的腺泡细胞。另一项研究发现,在生理条件下,Sox9阳性的胰腺导管上皮是腺泡细胞的祖细胞。然而,一些使用谱系追踪策略的研究发现,外分泌腺泡细胞主要通过自我复制再生。此外,两项导管细胞谱系追踪研究表明,成人导管细胞对腺泡细胞没有贡献。
相比之下,腺泡细胞是否能促成导管细胞的命运也仍然存在争议。在成年小鼠的严重慢性胰腺炎(chronic pancreatitis, CP)病变和体外培养的人胰腺腺泡细胞中观察到腺泡细胞向导管细胞的转分化(腺泡-导管化生),其中一些腺泡细胞失去了丰富的酶原颗粒,转化为导管样细胞。成人胰腺导管结扎(pancreatic ductal ligation, PDL)后,少量Ptf1a阳性腺泡细胞可被重编程生成导管细胞。然而,另外一项研究使用Elastase-CreER小鼠在稳态期间未观察到任何腺泡到导管的转分化,也未观察到一些损伤。还有研究发现了一个胰腺腺泡细胞亚群,该亚群在正常情况下和损伤后不会形成其他谱系。除了这些在成人胰腺的谱系追踪争议,胰腺外分泌细胞谱系的增殖动态仍然未被描述。
传统的Cre-loxP遗传谱系追踪系统有其局限性,这可能导致先前多项研究的差异。该策略的可靠性主要基于启动子特异性。启动子基因的弱表达可能导致Cre表达超出Cre- loxP重组的阈值,但低于免疫染色的一般检测水平,从而可能导致对细胞命运可塑性的错误解读。周斌实验室开发了一种双重组酶介导的遗传系统,该系统结合了Dre-rox重组系统,以更高的分辨率追踪细胞命运。
在这项工作中,研究人员将胰腺腺泡细胞和导管细胞同时被两个不同的遗传标记标记,能够基于双重组酶介导的遗传系统对其细胞命运进行不可磨灭的追踪。通过这种方法,研究证明了在炎症相关损伤期间,而在稳态期间或部分胰腺切除术后,胰腺腺泡细胞转化为导管样细胞,反之亦然。白喉毒素(Diphtheria toxin, DT)介导的腺泡细胞丢失后,导管细胞可形成新的腺泡细胞。
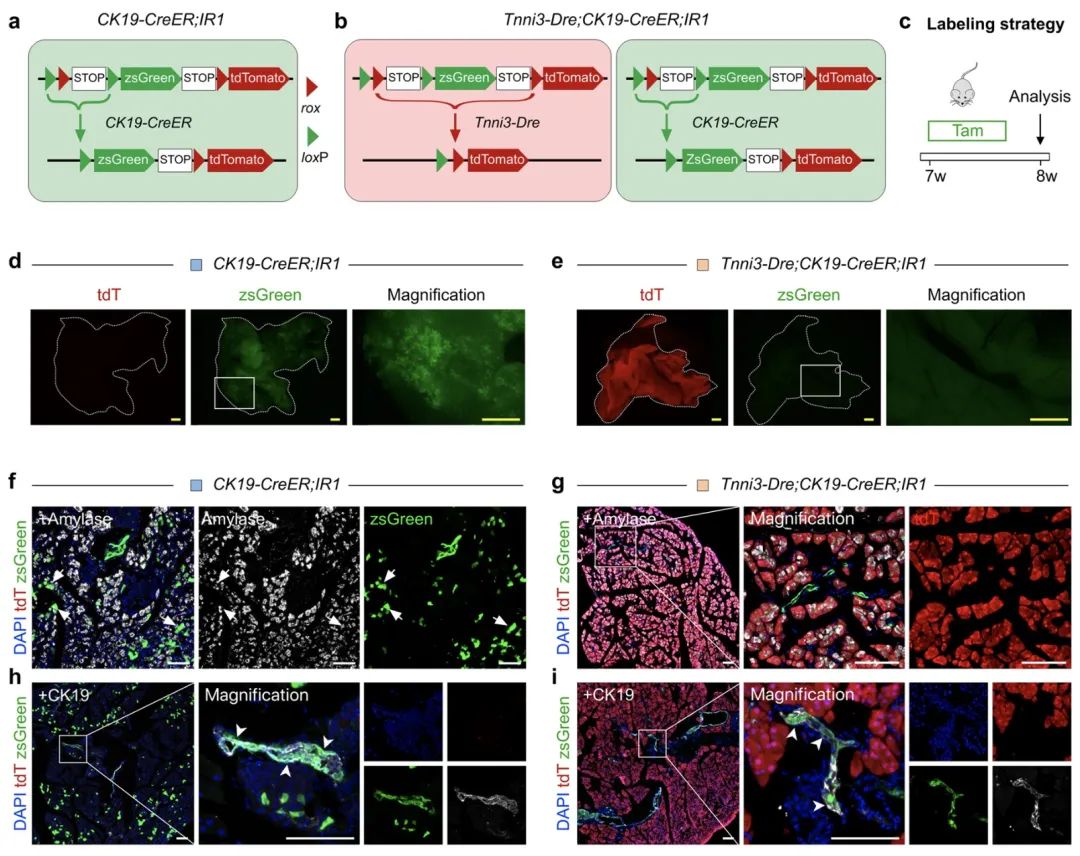
图1. Tnni3-Dre;CK19-CreER;IR1对胰腺外分泌导管和腺泡细胞的遗传标记(图源自Cell Discovery )
此外,通过使用ProTracer系统来计算生理过程中胰腺外分泌谱系的周转率。在PDL和青色素诱导的损伤后,研究发现在炎症环境中发生了腺泡到导管的转分化。另一方面,腺泡细胞经基因消融后,胰导管细胞可转分化为新的腺泡细胞。这些结果表明,胰腺外分泌腺中的腺泡细胞和导管细胞在一定的病理条件下发生谱系转换。
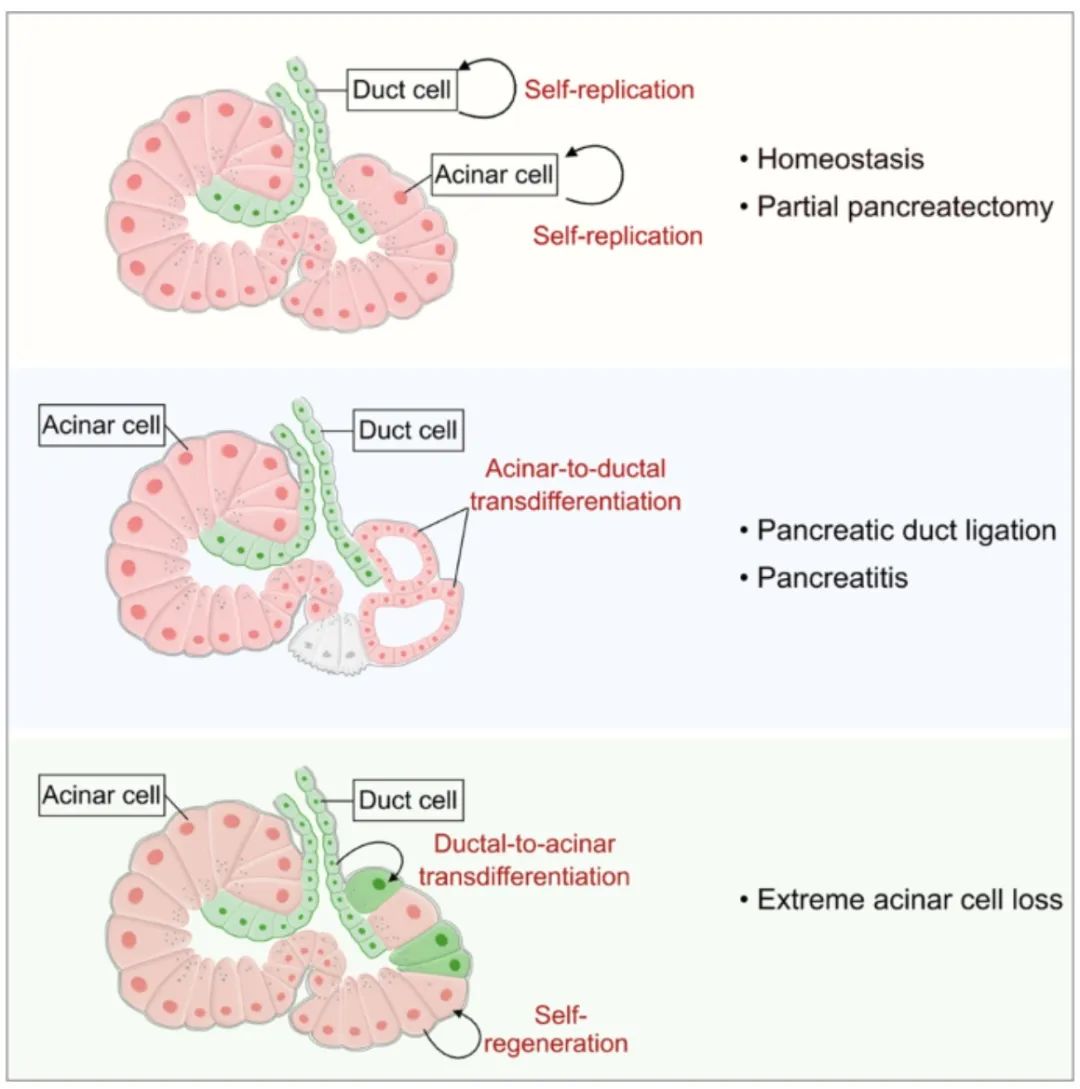
图2. 成人胰腺腺泡细胞与导管细胞间的细胞命运转分化(图源自Cell Discovery )
总的来说,这项工作提供了胰腺外分泌细胞在组织稳态和损伤后的详细命运图,有可能解决长期以来关于这些细胞命运可塑性的争议。研究中提供的系统和信息可能提供临床相关信息,从而设计新的治疗方案来治疗胰腺相关病理,同时也允许进一步研究不同病理条件下(包括癌症)胰腺外分泌细胞可塑性的细胞和分子机制。
原文链接:
https://www.nature.com/articles/s41421-022-00485-0


