Lancet:Bimekizumab在银屑病关节炎患者中的应用
时间:2023-03-26 20:59:09 热度:37.1℃ 作者:网络
银屑病关节炎是一种复杂的、免疫介导的炎症性疾病,表现在周围和轴突、关节、皮肤和指甲上。大多数银屑病关节炎患者开始使用传统的合成抗风湿药物(DMARDS)来治疗肌肉骨骼症状。国际指南建议,对常规合成DMARD反应不足的患者可以改用或增加生物DMARDS,总体目标是在所有疾病领域尽可能减少疾病活动。

白介素17家族的细胞因子参与了银屑病关节炎的发病机制,由几种功能重叠和不同的二聚体组成。尤其是IL-17A和IL-17F具有50%的同源性和重叠的促炎活性,可以形成同源二聚体和异源二聚体。在银屑病关节炎患者的滑膜组织、关节和皮肤中发现IL-17A和IL-17F的表达增加。
在银屑病患者中,Suckinumab和Ixekizumab抑制IL-17A是有效的,且耐受性良好。Bimekizumab是一种人源化的单抗IgG1,通过与IL-17A和IL-17F分子上的相似位置结合,选择性地抑制IL-17A和IL-17F,抑制同二聚体和异二聚体。在中到重度斑块型银屑病患者中,Bimekizumab在3b期放射研究中显示出显著优于Suckinumab的皮肤反应(通过完全皮肤清除进行评估),随着其在银屑病患者中的临床疗效和耐受性也在第3阶段得到肯定和生动的研究。在中到重度银屑病关节炎患者中进行的2b期BE积极研究也显示了比麦珠单抗的临床疗效和耐受性,开放标签扩展显示改善持续了长达3年。
Bimekizumab的有效性和安全性在两个在重叠的国家和地点平行运行的3期临床试验中进行了评估。这些试验包括活动性银屑病关节炎患者,他们要么对生物DMARDS天真(BE OPTIME),要么以前对肿瘤坏死因子-α(肿瘤坏死因子-α)抑制剂反应不足或不耐受(BE OPTIME)。在这篇文章中,我们报告BE OPTIME的24周、预先计划的初步分析结果。这项研究包括16周的双盲、安慰剂控制期和36周的治疗盲期。
方法:在14个国家和地区的135个地点(医院、诊所、医生办公室和研究中心)进行为期52周、第三阶段、多中心、随机、双盲、安慰剂对照、积极参考(Adalimumab)的试验。符合条件的患者为18岁或以上,在筛查前至少6个月内符合银屑病关节炎分类标准的成人起病银屑病关节炎的有记录的诊断。参与者根据预定的随机时间表(3:2:1,按区域和基线的骨侵蚀数量分层)被随机分配到每4周一次的Bimekizumab 160 mg,每两周一次的安慰剂,或参照组(每两周一次的阿达利单抗40 mg),全部皮下注射。在第16周,随机分配给安慰剂的患者每4周改用比卡珠单抗160毫克。主要终点是在第16周美国风湿病学会标准(ACR50)中达到50%或更大改善的患者比例(无应答者归责)。疗效分析包括随机分配的所有患者(意向治疗人群);安全性分析集包括接受一剂或多剂治疗的患者。数据将提交到第24周(预先计划的分析)。在2019年4月3日至2021年10月25日期间,1163名患者接受了筛查,852名患者被随机分配到bimekizumab(n=431)、安慰剂(n=281)和参照组(adalimumab;n=140)。在第16周,接受Bimekizumab的患者(189例[44%])与安慰剂组(281例中28例[10%];优势比7·1[95%可信区间4·6~10.9],p<0.0001;阿达利单抗64例[140%])相比显著更多的患者达到ACR50反应(281例[10%];所有次要分层端点均已满足。
结果:在接受Bimekizumab治疗的431名患者中,有258名(60%)报告了截至第16周的紧急治疗不良事件,在接受安慰剂治疗的281名患者中,有139名[49%]发生了治疗紧急不良事件,在140名接受adalimumab治疗的患者中,有83名[59%]发生了治疗紧急不良事件。

图1:24周最优的试验曲线曲线。*停止研究药物治疗但在16周前的所有预定就诊中返回的患者被视为完成了第16周,而不是在分配的治疗中。停止研究药物治疗,但在24周前的所有预定就诊中返回的†患者被认为完成了24周,而不是在分配的治疗中。
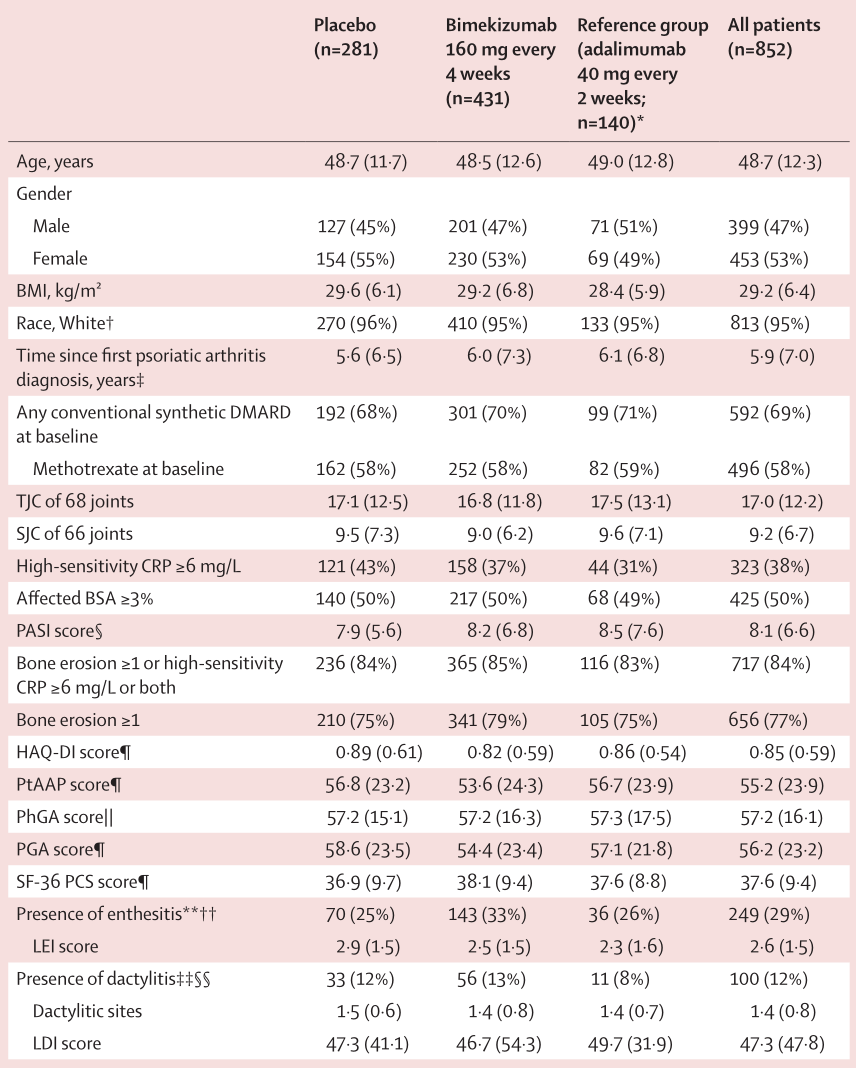
表1:基线患者人口统计和疾病特征
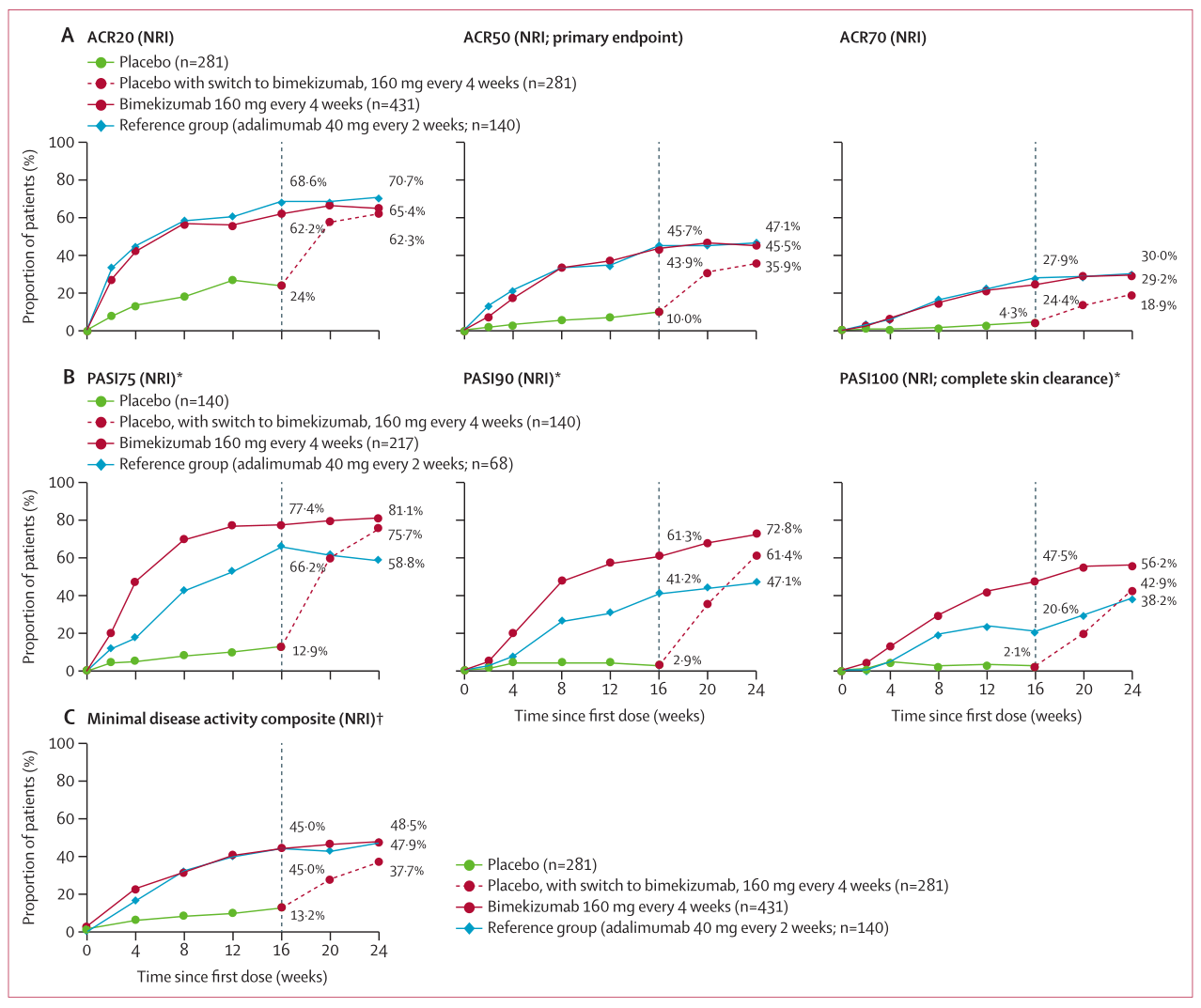
图2:ACR (A), PASI (B)和最小疾病活动性(C)数据从第0周到第24周ACR=美国风湿病学会。体表面积。健康评估问卷-残疾指数。新名词=人非难。牛皮癣面积和严重程度指数。*基线时BSA含量在3%或以上的银屑病患者。†如果患者达到以下5项或以上标准:关节压痛数为1或以下,关节肿胀数为1或以下,PASI≤1,或BSA≤3%,患者疼痛视觉模拟评分15或以下,银屑病关节炎患者整体评估为20或以下,HAQ-DI为0·5或以下,密封压痛分为1或以下。


