肺癌组织和外周血中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白水平检测及其临床价值探讨
时间:2023-08-11 15:32:21 热度:37.1℃ 作者:网络
[摘要]
背景与目的:肺癌发病机制具有多样性,但一经确认,往往已错过最佳治疗时机,本文通过探讨肺癌组织和外周血中抑癌基因(p53)、蛋白基因产物(PGP9.5)、转录因子(SOX2)、肿瘤相关基因编码蛋白(GAGE7)、解旋酶(GBU4-5)和黑色素瘤抗原(MAGE A1)蛋白水平的相关性,同时分析其在肺癌诊疗中的应用价值。
方法:回顾并分析2018年5月—2020年5月在复旦大学附属肿瘤医院确诊的100例肺癌患者的病历资料,临床TNM分期Ⅰ期25例,Ⅱ期 45例,Ⅲa期30例;非小细胞肺癌80例,小细胞肺癌20例;取手术切除的肿瘤组织和癌旁组织,采用免疫组织化学染色法检测上述6种蛋白的水平,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)法检测其基因表达,采用酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测外周血中6种蛋白的抗体阳性情况。
结果:肿瘤组织中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性率和基因表达水平均明显高于癌旁组织(P<0.05);将其与肿瘤的临床病理学特征进行相关分析发现,肿瘤组织和外周血中的p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性率和基因表达水平与肿瘤TNM分期和分化级别有关(P <0.05),而与患者性别、年龄、肿瘤直径、病理学类型无关(P>0.05)。肿瘤组织中6种蛋白的表达水平与外周血清表达具有较好的一致性(P>0.05)。
结论:肺癌肿瘤组织和外周血中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白表达阳性与肿瘤TNM分期及分化级别密切相关。
[关键词] 肺癌;抑癌基因p53;蛋白基因产物(PGP9.5);转录因子(SOX2);肿瘤相关基因编码蛋白(GAGE7);解旋酶(GBU4-5);黑色素瘤抗原(MAGE A1)
肺癌是严重威胁全世界人类健康的恶性肿瘤之一,其发病率和死亡率高居第1位[1]。早期诊断对提高肺癌手术切除成功率、改善远期生存结局具有十分重要的意义。而通过筛选敏感性、差异性表达的基因或蛋白,改进影像学诊断技术等有助于早期发现及诊治肺癌。肿瘤的发生离不开环境的变化和基因的突变,进而影响参与组织和细胞正常生长和代谢的蛋白表达。因此,寻找特异性的肿瘤基因或蛋白,并可在外周血液中稳定、高效检测,无疑将为提高肿瘤早期诊断准确度和临床干预提供重要依据。抑癌基因(p53)[2]、蛋白基因产物(PGP9.5)[3]、转录因子(SOX2)[4]、肿瘤相关基因编码蛋白(GAGE7)[5]、解旋酶(GBU4-5)[6]和黑色素瘤抗原(MAGE A1)[7]蛋白被证实与肺癌的发生、发展具有密切关系,前期研究[8]发现其在肺癌外周血清中的抗体免疫染色阳性率显著高于健康体检者;本研究拟进一步探讨肺癌肿瘤组织和外周血清中上述6种蛋白表达水平的相关性。
1 材料和方法
1.1 临床资料
选择2018年5月—2020年5月在复旦大学附属肿瘤医院确诊的肺癌患者共100例。纳入标准:① 年龄18~75岁;② 经胸部CT、引导穿刺及手术后病理学检查确诊为肺癌,均为单发病变;③ 可手术切除完整肿瘤组织和癌旁3 cm外正常肺组织;④ 取得患者的知情同意,临床资料完善。排除标准:① 肺部转移瘤,合并其他部位原发恶性肿瘤,已明确肺癌有远处转移,不适合手术切除;② 既往未行放化疗。
100例患者中男性60例,女性40例,年龄52~75岁,平均(60.5±9.4)岁;肿瘤位于左侧55例,右侧45例;肿瘤临床TNM分期Ⅰ期25例,Ⅱ期45例,Ⅲa期30例;病理学类型为非小细胞肺癌(non-small cell lung cancer,NSCLC) 80例,小细胞肺癌(small cell lung cancer,SCLC)20例;分化级别为低分化40例,中分化35例,高分化25例,肿瘤最大直径为1.5~5.0 cm,平均(3.5±1.3)cm。
1.2 研究方法
手术切除完整肿瘤组织和癌旁组织(癌组织3 cm外的肺组织),采用免疫组织化学染色法检测上述6种蛋白的阳性表达情况,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)法检测其基因表达水平,采用酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA)检测外周血中血清蛋白的阳性情况。
1.2.1 免疫组织化学染色法
常规制作石蜡组织切片,厚度5 μm,参照抗体二步法滴加顺序进行组织染色,以大鼠抗人p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白一抗(美国Sigma公司,1∶2 000)置于湿盒内4℃温育过夜,正常大鼠免疫球蛋白G(immunoglobulin G,IgG)为阴性对照;滴加驴抗大鼠二抗(福州迈新生物技术开发有限公司,1∶500)置于湿盒中27℃温育20 min;滴加辣根过氧化物酶标记链霉卵白素工作液(福州迈新生物技术开发有限公司)置于湿盒中27℃温育20 min;DAB显色,在光学显微镜下观察。以细胞染成黄色为强度指标,阳性细胞比例为数量指标,分别赋值0~3分和0~4分,两项乘积<4分为阴性,≥4分为阳性。
1.2.2 RTFQ-PCR检测
采用德国Qiagen公司全量RNA提取试剂盒完成提取工作,冰上溶解、剪碎组织,加TRIzol萃取液,氯仿分层,乙醇溶解,RNeasy分离柱纯化,缓冲液层析,反复多次,最后用紫外分光光度计测定RNA纯度和浓度。按德国Qiagen公司反转录试剂盒说明书要求完成cDNA合成工作,1.0 μg样品RNA+4 μL缓冲液+2 μL混合物+2 μL正反引物,加水至反应总体积20 μL。采用日本Takara公司试剂盒测定目标引物表达量,反应体系为6.8 μL SYBER+0.4 μL DYE+0.4 μL正反引物2.0 μL cDNA,置于美国Baker公司PCR反应仪上扩增,反应条件为95℃ 30 s(95℃ 5 s、60℃ 35 s),共进行40个循环,以U6为内参,计算相对表达量。p53、PGP9.5 SOX2、GAGE7、GBU4-5和MAGE A1目标基因的引物序列由生工生物工程(上海)股份有限公司合成。
1.2.3 ELISA测定
主要仪器为BIO-Tek全自动酶标仪,p53、 PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1对应抗体试剂盒由杭州凯保罗生物科技有限公司提供。
缓冲盐溶液(phosphate-buffered saline,PBS),按照固相板加样示意图,加入50 μL质控品、校准品、上样控制品、稀释好的待测样本在相应微孔中,确保所有微孔底部被溶液覆封,贴封板膜,室温振荡温育60 min。每孔加工作液200 μL,重复上述步骤3次。每孔加入稀释好的酶结合物工作液50 μL,贴封板膜室温振荡温育30 min。重复洗板步骤,每孔加入混合好的显色剂100 μL,室温避光振荡温育15 min。与加入显色剂相同的顺序,每孔加入终止液50 μL,反应结束30 min内用酶标仪读取450 nm处的吸光度(D)值。结果判定标准见表1。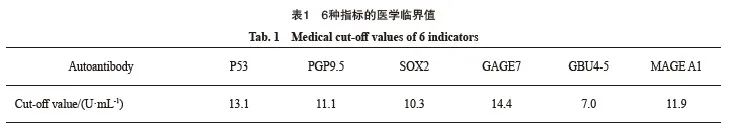
1.3 观察指标
比较每例患者肿瘤组织与癌旁组织中p53、 PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性率和基因表达水平的差异;将上述6种蛋白的阳性率和基因表达水平分别与肿瘤的临床病理学特征进行相关分析,其中临床特征包括患者性别、年龄、肿瘤直径、病理学类型、TNM分期和分化级别。最后,将肿瘤组织中上述6种蛋白的表达与外周血清表达进行相关分析。
1.4 统计学处理
采用SPSS 20.0软件对计量资料进行t或F检验,计数资料进行χ2检验,采用Pearson相关性分析肿瘤组织中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白表达与对应血清表达水平的相关关系,P<0.05为差异有统计学意义。
2 结 果
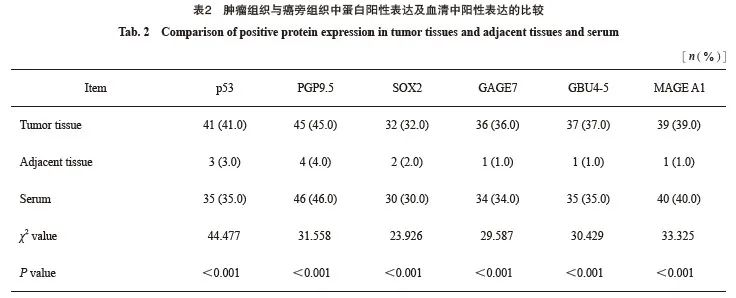
2.1 肿瘤组织与癌旁组织中蛋白阳性表达及血清中阳性表达的比较
肿瘤组织、血清中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性表达率明显高于癌旁组织(P<0.05,表2)。
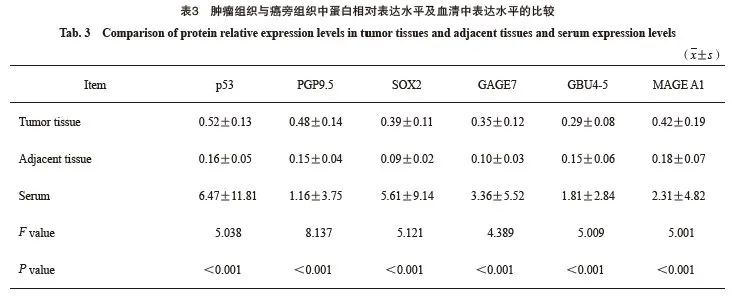
2.2 肿瘤组织与癌旁组织中蛋白的相对表达水平及血清中表达水平的比较
肿瘤组织、血清中p53、PGP9.5、SOX2、 GAGE7、GBU4-5和MAGE A1蛋白的相对表达水平均明显高于癌旁组织(P<0.05,表3)。
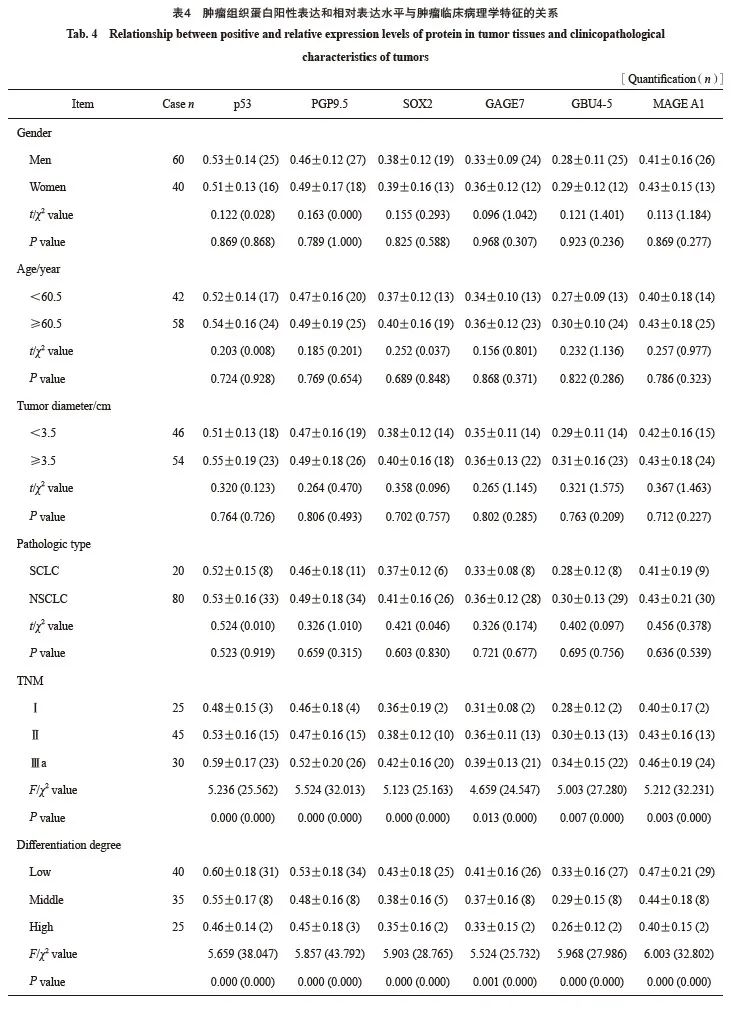
2.3 肿瘤组织中蛋白阳性表达和相对表达水平与肿瘤临床病理学特征的关系
肿瘤组织中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性表达率和相对表达水平与肿瘤TNM分期和分化级别有关(P<0.05),与患者性别、年龄、肿瘤直径、病理学类型无关(P>0.05,表4)。
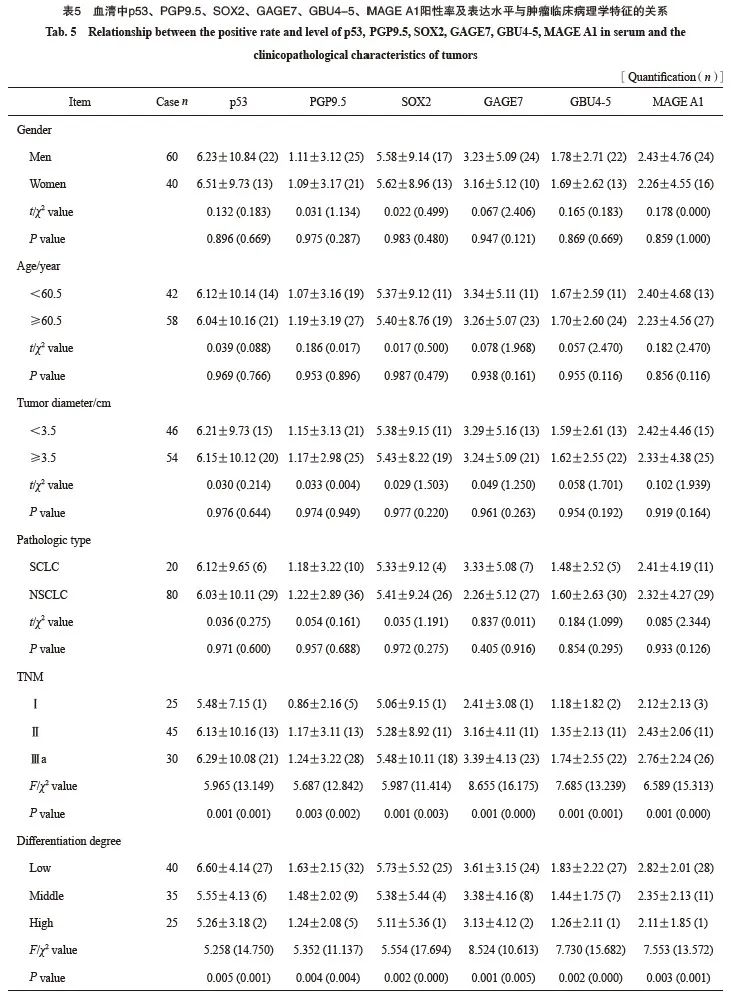
2.4 血清中p53、PGP9.5、SOX2、GAGE7、GBU4-5、MAGE A1阳性率及表达水平与肿瘤临床病理学特征的关系
患者血清中p53、PGP9.5 、SOX2、GAGE7、GBU4-5和MAGE A1阳性率及表达水平与肿瘤TNM分期和分化级别有关(P <0.05),与患者性别、年龄、肿瘤直径、病理学类型无关(P>0.05,表5)。
2.5 肿瘤组织中蛋白表达与外周血清表达水平的关系
肿瘤组织中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白表达与对应血清表达水平具有较好的一致性(P>0.05,图 1)。
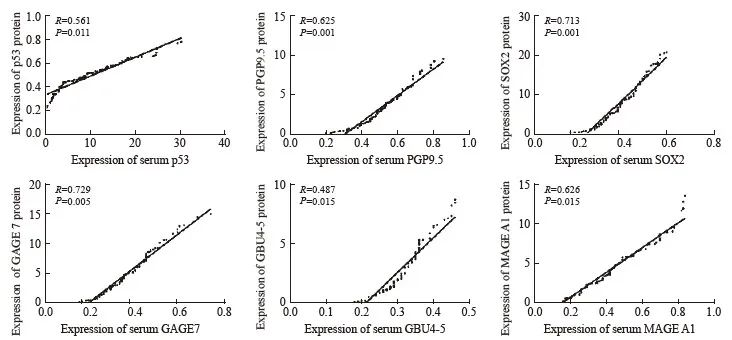
图1 肿瘤组织中蛋白表达与外周血清表达水平的相关性分析
Fig. 1 Correlation analysis of tumor tissue protein expression and peripheral blood serum expression
3 讨 论
血清肿瘤相关抗原自身抗体直接参与肿瘤进展,恶性肿瘤细胞分泌的一些抗体可对肿瘤细胞增殖、迁移发挥促进作用,这一观点已经得到大多数研究学者的证实[8]。随着恶性肿瘤细胞改变细胞表面抗原,肿瘤细胞表面抗原出现,诱导免疫系统产生自身抗体,国外一项研究[9]探讨血清自身抗体在食管癌早期诊断中的应用价值,对130例食管癌患者和110例对照者进行ELISA检测,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,总灵敏度为83.08%,总特异度为72.73%,基于肯定判断标准建立诺模图,在校准曲线验证后,计算ROC曲线的曲线下面积为0.880,说明血清自身抗体群联合检测对食管癌的早期诊断具有一定的临床应用价值。有研究[10-11]发现,肿瘤发生早期人体免疫系统可识别肿瘤特异性抗原,细胞坏死后释放至循环血液中。肿瘤相关抗原的改变,如过表达、突变、错误折叠、异常退化等,导致肿瘤患者反应性免疫应答,进而产生对应自身抗体。
获得免疫原性的主要途径有:① 蛋白过度表达、突变、折叠错误;② 异常表达,正常情况下肿瘤/睾丸抗原仅在人体生殖细胞中表达,但多种肿瘤中约有40个抗原异常表达(如MAGE A1、 CAGE);③ 蛋白转译后的修饰,如磷酸化、糖基化、剪切、氧化后出现新的表位;④ 蛋白异位表达,如肿瘤胞内蛋白分泌到细胞外或重新定位到细胞表面。
在癌症的早期阶段,机体的免疫系统可以识别出肿瘤细胞通过体液免疫表达的少量异常蛋白质即肿瘤特异性抗原,并产生针对这些抗原的抗体。不同种类肺癌的患者可以检测血清中的肿瘤特异性抗原。这些抗体不仅可以在诊断出肺癌时检测到,而且在某些情况下甚至可以在临床症状出现前5年检测到[12]。Chapman等[13]研究发现,欧洲人特有的7种自身抗体p53、c-myc、HER2、NY-ESO-1、CAGE、MUC1和GBU4-5的灵敏度为76%,特异度为92%。Zhang等[10]研究发现,腺癌组GBU4-5、PGP9.5水平高于鳞状细胞癌组,表明GBU4-5和PGP9.5有可能用于区分腺癌和鳞状细胞癌。然而腺癌组进一步分为原位腺癌组和浸润性肺腺癌组,这两组自身抗体的表达差异无统计学意义,不能用于区分特定的腺癌类型,表明虽然自身抗体可用于早期肺癌筛查,但不能用作准确诊断的手段。
Infante等[14]首次发现p53与肿瘤进展相关,灵敏度为27%,特异度为90%。原因是p53不仅在肺癌中表达,而且在许多其他恶性肿瘤(如结直肠癌、乳腺癌等)中也表达。Parrales等[15]研究发现,p53在50%以上的癌症中表达,这与肿瘤细胞的活性密切相关,是潜在的癌症治疗靶点。Qin等[16]研究发现,GBU4-5的灵敏度为7%,特异度为98%,曲线下面积为0.91,CAGE的灵敏度为14%,特异度为98%,曲线下面积为0.90,SOX2的灵敏度为14%,特异度为99%,曲线下面积为0.93。这些自身抗体灵敏度高,但特异度低,联合检测特异度高,但灵敏度较低。Du等[11]研究报道,联合检测7种自身抗体(p53、PGP9.5、SOX2、GAGE7、GBU4-5、CAGE和MAGEA1)比单抗体检测更有利。
本研究显示,肺癌组织中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性率和基因表达水平均明显高于癌旁组织(P<0.05)。p53是最早发现的抑癌基因之一,也是目前研究最广泛的肿瘤抗原,在所有恶性肿瘤中,50%以上会出现p53基因的突变[17]。p53蛋白调节细胞周期,p53基因突变导致p53蛋白失活是肿瘤发生的一个重要步骤[18]。PGP9.5是神经元胞质基因产物,属于泛素水解酶,是神经内分泌系统特异性蛋白[19]。其表达不依赖神经分化而独立存在,与肿瘤的病理学分期密切相关,在原发性肺癌中大量表达,但在正常肺部组织中几乎不表达[20]。SOX2具有HMG DNA结合域的转录因子,在胚胎干细胞和生殖细胞中表达。SOX2通过与靶基因HMG结构域特异性结合,调控胚胎和组织发育,维持干细胞多能性、增殖性和决定细胞寿命等[21]。SOX2诱导肿瘤癌信号表皮生长因子受体(epidermal growth factor receptor,EGFR)和BCL2L1,促进肺癌细胞增殖;同时SOX2是肺腺癌预后不佳的独立预测因子,与复发风险相关[22]。GAGE7属于肿瘤/睾丸抗原,在正常组织中不表达,只在恶性肿瘤及睾丸组织中表达,具有抗细胞凋亡活性[23]。GBU4-5属于腺苷三磷酸(adenosine triphosphate,ATP)结合RNA解旋酶,在癌变过程中发挥重要作用,具有肿瘤特异性和免疫原性[24]。MAGE A1在正常组织中不表达,只在恶性肿瘤和睾丸组织中表达,在非小细胞肺癌中表达与较差的预后相关,与基因转录和肿瘤进展有关[25]。
进一步研究发现,肿瘤组织中p53、 PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性率及基因表达水平与肿瘤TNM分期和分化级别有关(P<0.05),与患者性别、年龄、肿瘤直径、病理学类型无关(P>0.05),提示p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1表达上调与肿瘤的恶性程度有关。肿瘤组织中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白的阳性表达与外周血清上述蛋白的阳性表达具有较好的一致性(P>0.05)。证实通过外周血检测对应抗体与肿瘤组织中蛋白阳性表达具有直接对应关系。
综上所述,肺癌肿瘤组织和外周血清中p53、PGP9.5、SOX2、GAGE7、GBU4-5和MAGE A1蛋白表达阳性与肿瘤TNM分期和分化级别密切相关。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] BADE B C, DELA CRUZ C S. Lung cancer 2020: epidemiology, etiology, and prevention[J]. Clin Chest Med, 2020, 41(1): 1-24.
[2] ZHOU Y Y, HÖTI N, AO M H, et al. Expression of p16 and p53 in non-small cell lung cancer: clinicopathological correlation and potential prognostic impact[J]. Biomark Med, 2019, 13(9): 761-771.
[3] BRAIT M, MALDONADO L, NOORDHUIS M G, et al. Association of promoter methylation of VGF and PGP9.5 with ovarian cancer progression[J]. PLoS One, 2013, 8(9): e70878.
[4] WANG K X, JI W X, YU Y F, et al. FGFR1-ERK1/2-SOX2 axis promotes cell proliferation, epithelial-mesenchymal transition, and metastasis in FGFR1-amplified lung cancer[J]. Oncogene, 2018, 37(39): 5340-5354.
[5] WANG J, SHIVAKUMAR S, BARKER K, et al. Comparative study of autoantibody responses between lung adenocarcinoma and benign pulmonary nodules[J]. J Thorac Oncol, 2016, 11(3): 334-345.
[6] ORLOVETSKIE N, SERRUYA R, ABBOUD-JARROUS G, et al. Targeted inhibition of WRN helicase, replication stress and cancer[J]. Biochim Biophys Acta Rev Cancer, 2017, 1867(1): 42-48.
[7] YI E, CHANG J E, LEEM C, et al. Association of MAGE A1-6 expression with lung cancer progression[J]. J Cancer, 2017, 8(8): 1324-1329.
[8] ZHANG X Z, LIU M, ZHANG X, et al. Autoantibodies to tumor-associated antigens in lung cancer diagnosis[J]. Adv Clin Chem, 2021, 103: 1-45.
[9] XIAO K J, MA X L, WANG Y C, et al. Diagnostic value of serum tumor-associated autoantibodies in esophageal cancer[J]. Biomark Med, 2021, 15(15): 1333-1343.
[10] ZHANG R, MA L, LI W Y, et al. Diagnostic value of multiple tumor-associated autoantibodies in lung cancer[J]. Onco Targets Ther, 2019, 12: 457-469.
[11] DU Q, YU R F, WANG H, et al. Significance of tumorassociated autoantibodies in the early diagnosis of lung cancer[J]. Clin Respir J, 2018, 12(6): 2020-2028.
[12] CHAPMAN C J, HEALEY G F, MURRAY A, et al. EarlyCDT®- Lung test: improved clinical utility through additional autoantibody assays[J]. Tumour Biol, 2012, 33(5): 1319-1326.
[13] CHAPMAN C J, MURRAY A, MCELVEEN J E, et al. Autoantibodies in lung cancer: possibilities for early detection and subsequent cure[J]. Thorax, 2008, 63(3): 228-233.
[14] INFANTE M, CAVUTO S, LUTMAN F R, et al. A randomized study of lung cancer screening with spiral computed tomography: three-year results from the DANTE trial[J]. Am J Respir Crit Care Med, 2009, 180(5): 445-453.
[15] PARRALES A, IWAKUMA T. Targeting oncogenic mutant p53 for cancer therapy[J]. Front Oncol, 2015, 5: 288.
[16] QIN J Y, ZENG N, YANG T, et al. Diagnostic value of autoantibodies in lung cancer: a systematic review and metaanalysis[J]. Cell Physiol Biochem, 2018, 51(6): 2631-2646.
[17] NING Y C, HUI N, QING B, et al. ZCCHC10 suppresses lung cancer progression and cisplatin resistance by attenuating MDM2-mediated p53 ubiquitination and degradation[J]. Cell Death Dis, 2019, 10(6): 414.
[18] SHAO L P, ZUO X L, YANG Y, et al. The inherited variations of a p53-responsive enhancer in 13q12.12 confer lung cancer risk by attenuating TNFRSF19 expression[J]. Genome Biol, 2019, 20(1): 103.
[19] REN S X, ZHANG S C, JIANG T, et al. Early detection of lung cancer by using an autoantibody panel in Chinese population[J]. Oncoimmunology, 2018, 7(2): e1384108.
[20] WEN W, LIU G, JIN K, et al. TGF-β1 induces PGP9.5 expression in CAFs to promote the growth of colorectal cancer cells[J]. Oncol Rep, 2017, 37(1): 115-122.
[21] LIN S C, CHOU Y T, JIANG S S, et al. Epigenetic switch between SOX2 and SOX9 regulates cancer cell plasticity[J]. Cancer Res, 2016, 76(23): 7036-7048.
[22] KAMEL L M, ATEF D M, MACKAWY A M H, et al. Circulating long non-coding RNA GAS5 and SOX2OT as potential biomarkers for diagnosis and prognosis of non-small cell lung cancer[J]. Biotechnol Appl Biochem, 2019, 66(4): 634-642.
[23] TANG Z M, LING Z G, WANG C M, et al. Serum tumorassociated autoantibodies as diagnostic biomarkers for lung cancer: a systematic review and meta-analysis[J]. PLoS One, 2017, 12(7): e0182117.
[24] MU Y Y, XIE F Y, WANG F B, et al. Performance evaluation of an enzyme-linked immunosorbent assay for seven autoantibodies in lung cancer[J]. Clin Lab, 2019, 65(4).
[25] FANIPAKDEL A, SEILANIAN TOUSSI M, REZAZADEH F, et al. Overexpression of cancer-testis antigen melanomaassociated antigen A1 in lung cancer: a novel biomarker for prognosis, and a possible target for immunotherapy[J]. J Cell Physiol, 2019, 234(7): 12080-12086.


