【JAMA综述】慢性淋巴细胞白血病的诊断和治疗
时间:2023-03-28 10:12:01 热度:37.1℃ 作者:网络
顶级期刊《JAMA》近日发表了一篇综述,作者为Fred Hutchinson 癌症中心Mazyar Shadman教授,他在PubMed检索2014年1月(伊布替尼上市后)至2023年1月期间发表的关于CLL诊断和治疗的文章并筛选其中高质量的89篇,包括28项随机试验、9项单臂和14项纵向研究。作者总结了相关文章,并整理了目前关于 CLL 诊断和治疗的证据。现将全文翻译如下,供各位老师参考


CLL 的特征是免疫功能失调的成熟 B 淋巴细胞聚集,其具有典型的免疫表型,包括表达CD5、CD23和 CD19,以及表面免疫球蛋白、CD20、CD22和 CD79b弱表达。BCL2等蛋白过度表达导致的细胞凋亡(程序性细胞死亡)受损,和通过抗原非依赖性和BCR通路活化导致的淋巴细胞增殖增加是 CLL 病理生物学的重要组成部分。这些生物学通路导致了靶向 BCL2 和 BCR 通路中下游酶的药物的开发。CLL 病理生理学的一个重要因素是免疫球蛋白重链可变区基因 (IGHV) 的突变状态。大约一半的 CLL 患者 IGHV 状态未突变(与生殖系序列的偏差<2%),这些患者通常在诊断和疾病进展之间的时间间隔较短,不良临床结局较多;而IGHV状态突变(偏差2%)的 CLL 患者临床过程更惰性。CLL 患者对感染或疫苗接种有异常的体液和细胞免疫反应。

大约70%的 CLL 患者是因为偶然发现的不明原因的淋巴细胞增多诊断的,诊断时没有症状(BOX 1)。在有症状的患者中,约50%表现为淋巴结肿大症状,约20%~50%表现为肝脾肿大症状,约5%~10%表现为6个月内体重意外减轻≥10%、发热、盗汗或极度疲劳(B症状)。患者还可能出现血细胞减少,可能是由于 CLL 细胞累及骨髓或免疫介导的并发症,如自身免疫性溶血性贫血 (< 10%) 或免疫性血小板减少 (< 2%) 所致。外周血流式细胞检测是必要的,通常足以做出 CLL 诊断。对于无症状患者无需进行额外的影像学和骨髓活检,可延迟进一步评估直至治疗。CLL定义为单克隆 B 细胞数量≥5×109/L;单克隆 B 细胞计数<5×109/L、CLL免疫表型有淋巴结肿大或结外受累证据的患者诊断为小淋巴细胞淋巴瘤(SLL)。单克隆 B 淋巴细胞增多症 (MBL) 是指单克隆 B 细胞<5×109/L且无淋巴结肿大或结外受累,不符合 CLL 的诊断标准,每年向 CLL 的转化率为1%-2%。CLL和SLL的生物学和疗法相同,本综述中均使用CLL一词代指。
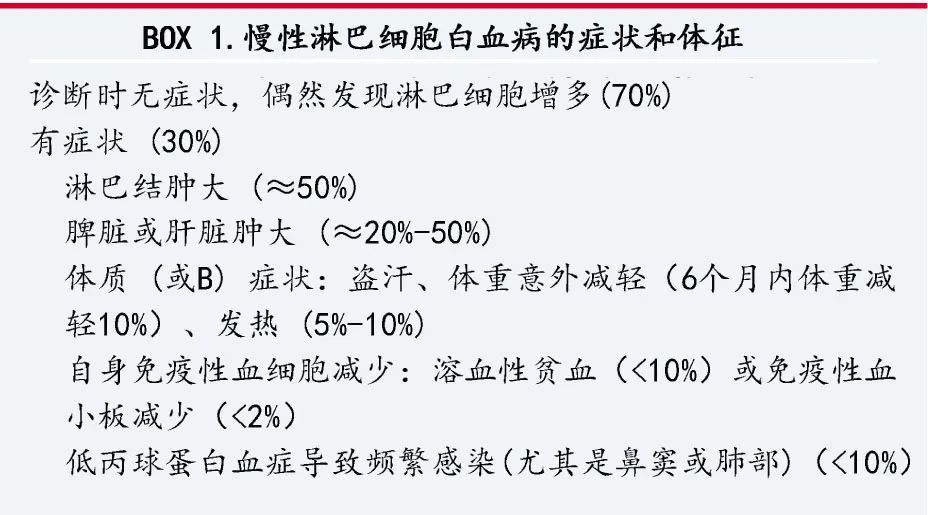

使用 Rai 和 Binet 系统进行 CLL 分期,纳入的临床变量包括血细胞减少及其程度,以及淋巴结肿大、脾肿大或肝肿大(表1)。
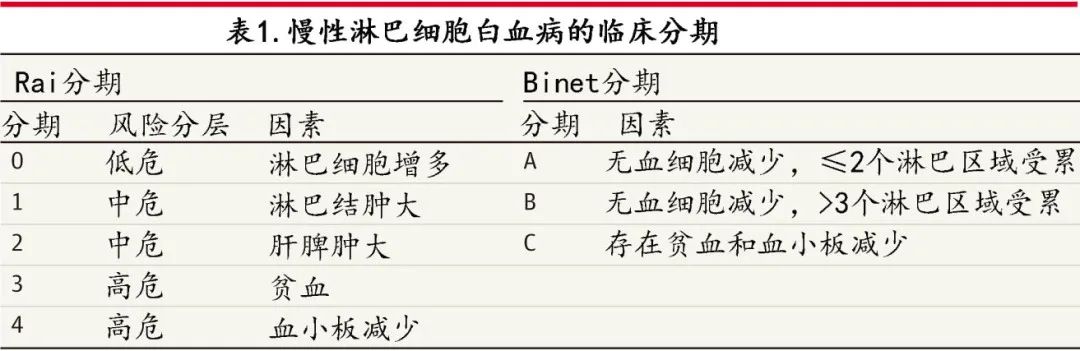
分子信息也越来越多地用于预后,CLL 中最常定义的细胞遗传学异常为del(13q14)、12号染色体三体、del(17p12) 和del(11q22)。位于17号染色体短臂的抑癌基因TP53(肿瘤蛋白p53)存在(缺失或序列变异)是CLL中最重要的不良预后标志物。此外染色体异常可随治疗而改变,例如虽然未治疗患者中只有不到10%检测到del(17),但在疾病复发患者中发生率高达23%-50%,从而突出了在每一线治疗前重复检测的重要性。对于新诊断的无症状患者,预估至首次治疗时间的有用临床工具是无症状早期CLL国际预后评分(IPS-E)(范围0-3;评分越高越差)(表2)。该模型纳入因素包括免疫球蛋白重链可变区(IGHV)基因未突变、淋巴细胞绝对值>15x109/L以及可触及的淋巴结肿大。使用该模型,低危(0分)患者需要治疗的5年发生率为8.4%,中危(1分)患者为28.4%,高危(2-3分)患者为61.2%。


关于 CLL 方法的常见问题见BOX 2;CLL患者预防护理相关信息见BOX 3。

根据 IPS-E 评分,大约30%-50%的新诊断和无症状 CLL 患者为低危,这些患者中只有大约8%的患者在诊断后的前5年内需要治疗。因此考虑到 CLL 诊断的中位年龄(70岁),许多患者(约30%)从不需要治疗。应告知 CLL 患者,由于细胞和体液免疫功能受损,他们发生感染风险的增加。虽然应避免接种活疫苗,如减毒活流感疫苗(鼻流感疫苗),但所有 CLL 患者应每年接受重组带状疱疹疫苗、新冠肺炎疫苗和流感灭活疫苗肌内接种。建议所有 CLL 患者接种肺炎球菌疫苗。20价肺炎球菌结合疫苗 (PCV20) 推荐用于既往未接种疫苗的患者或接种过23价肺炎球菌多糖疫苗 (PPSV23) 的患者(应在接种 PPSV23 后至少1年);对于既往未接种过 PPSV23 疫苗的患者,一些专家指南建议在 PCV20 后至少8周接种PPSV23。患者对疫苗接种的免疫应答低于一般人群,如果发生病毒大流行这样的高危条件,应继续采取口罩、避免接触等保护措施。低丙种球蛋白血症(IgG <500 mg/dL)且频繁鼻窦或肺部感染的患者,如果丙种球蛋白保持较低水平,每6至8周静脉注射免疫球蛋白可获益。此外CLL 患者的皮肤基底细胞癌(风险比14;未提供绝对发生率)和鳞状细胞癌(风险比7;未提供绝对发生率)发生风险高于非 CLL 患者。

对于无贫血、中性粒细胞减少或血小板减少的无症状患者,无治疗的观察等待是标准策略;大多数患者在诊断时不需要治疗,也没有证据表明治疗无症状 CLL 患者可以改善生存率。例如一项在201例无症状 CLL 患者中进行的临床试验显示,氟达拉滨、环磷酰胺和利妥昔单抗治疗与未治疗的观察相比,5年时没有获益(82.9% vs 79.9%;P=0.86)。另一项临床试验中363例无症状患者随机接受伊布替尼或安慰剂治疗;随访31个月时,与安慰剂相比,伊布替尼改善了无事件生存率(定义为进展、开始新的 CLL 治疗或死亡的事件)(3年无事件生存率87.3% vs 60.4%;P<0.001)。但除非总生存期随着随访时间的延长而改善,否则该研究无法提供支持治疗无症状患者的证据。如果患者出现 CLL 相关并发症,包括严重贫血或血细胞减少(血红蛋白水<10g/dL或血小板计数<10万/μL)、大量进展性或症状性淋巴结肿大或肝脾肿大(淋巴结≥10 cm,脾左肋缘下≥6 cm)、复发性感染,或 CLL 相关难治性自身免疫性血小板减少/贫血,则需要给予治疗。

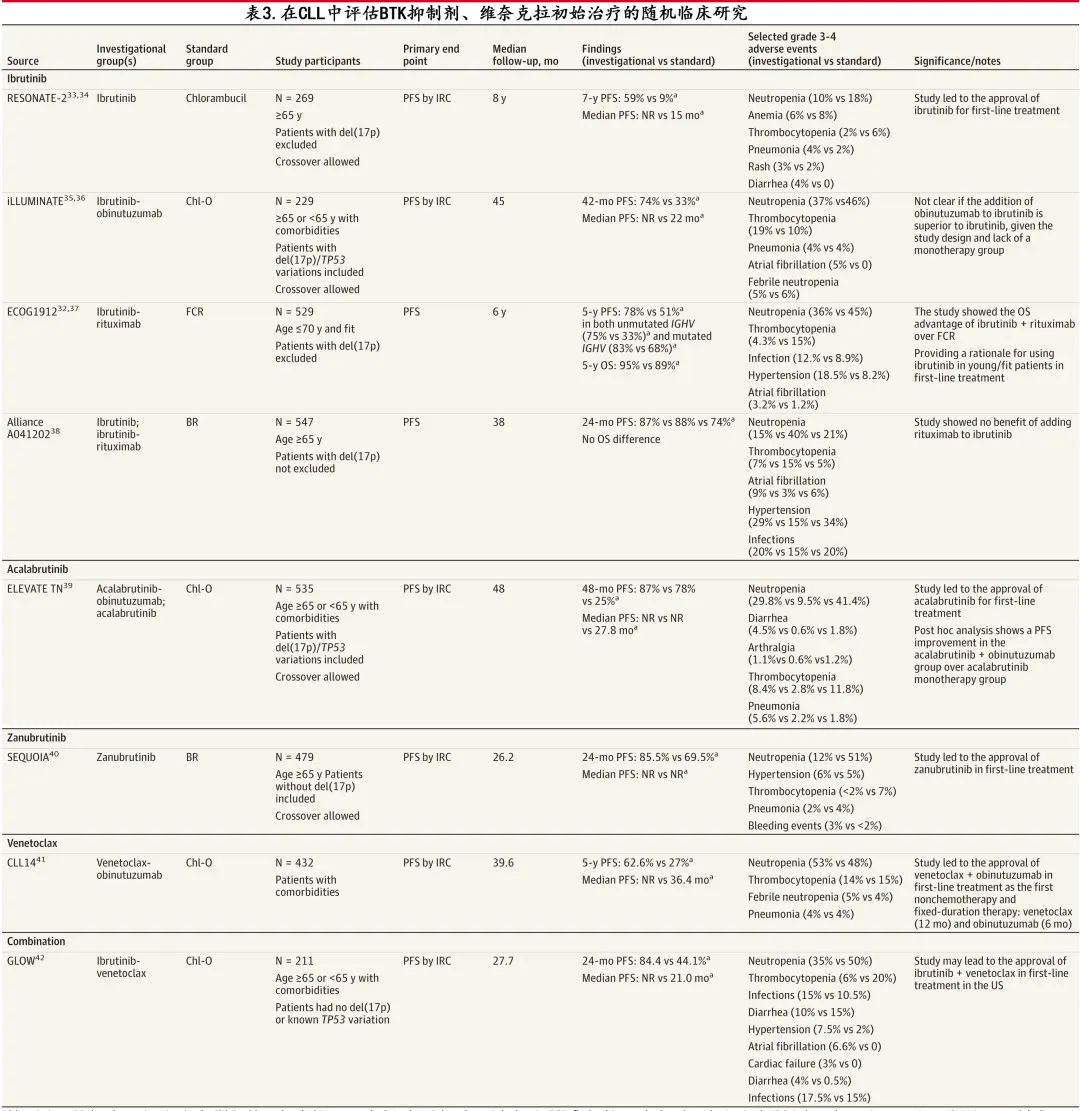
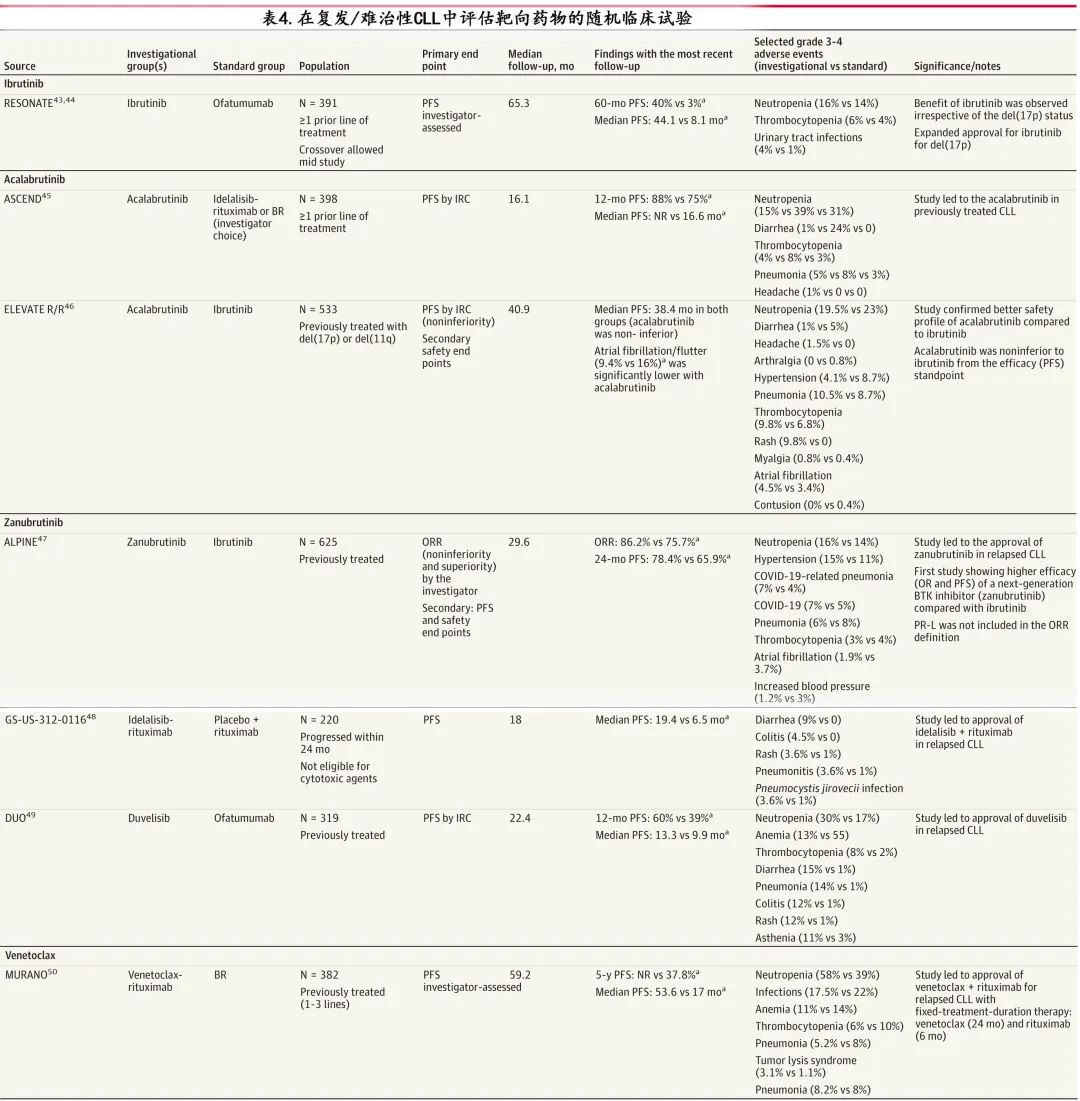
缓解是指治疗后 CLL 减少或消失,治愈是指疾病永久消退。CLL 可获得持久缓解,1项研究 (N=529) 报告约80%的患者在5年时缓解。但除异基因造血细胞移植外,CLL是无法治愈的,因此重复治疗往往是必要的。CLL 的标准治疗选择包括以下5类(见表3和表4;BOX 4)。

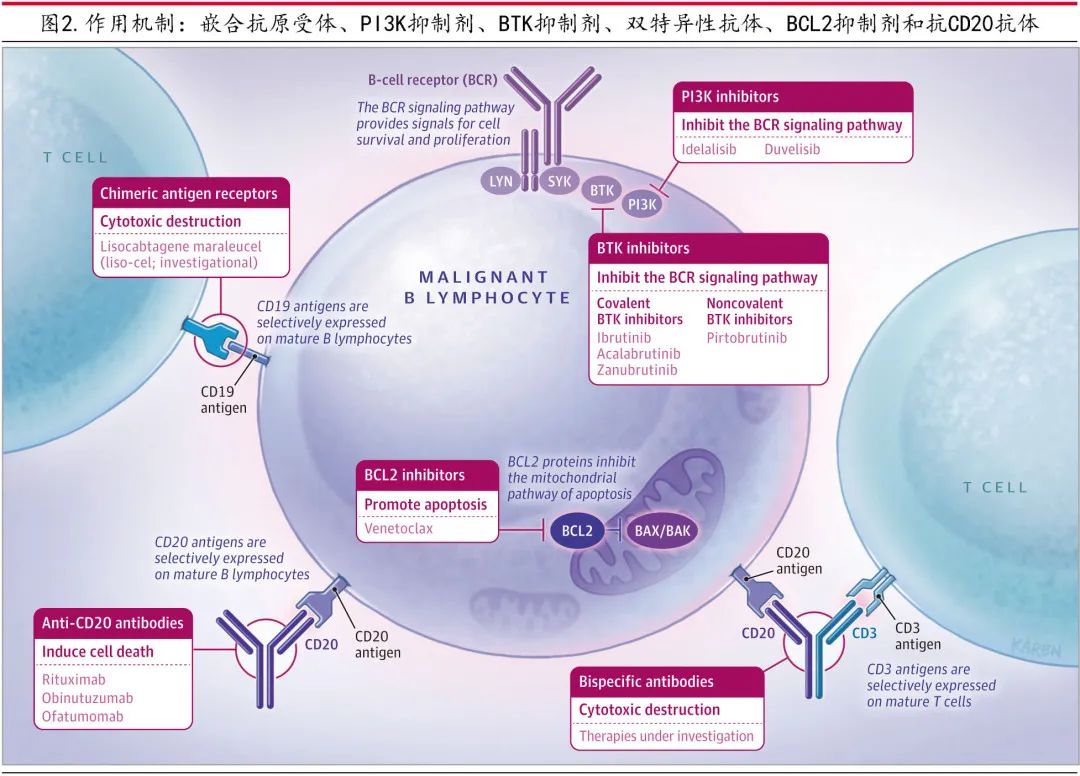
BCR通路抑制剂
BCR 信号通路参与 CLL 的发病机制,抑制 BCR 通路相关酶的药物,特别是BTK和PI3K是治疗 CLL 的标准治疗。BTK抑制剂如伊布替尼、阿可替尼和泽布替尼均可作为单药治疗无限期使用,因为持续抑制靶酶对其抗增殖作用至关重要。共价 BTK 抑制剂如伊布替尼、阿可替尼和泽布替尼不可逆地抑制 BTK 酶,超过90%的患者对这些治疗有反应。在接受伊布替尼治疗的疾病进展患者中,约66%-80%的患者存在 BTK 结合位点 (C481S) 序列变异或下游基因磷脂酶Cγ2(PLCG2) 功能获得性变异。非共价 BTK 抑制剂pirtobrutinib可逆性灭活BTK,BTK 和PLCG2.54的非 C481S 激酶结构域的序列变异可对pirtobrutinib产生耐药性。伊布替尼是首个 BTK 抑制剂,用作一线治疗时7年 PFS 为60%,用于复发患者时5年 PFS 为40%(表2和表3),但常见不良事件如关节痛 (42%)、房颤 (25%) 和皮疹 (16.7%),可能导致停药;这也是约23%患者的限制因素,并导致停药。二代 BTK 抑制剂如阿可替尼或泽布替尼选择性靶向 BTK 酶,在直接比较它们与伊布替尼的临床试验中,阿可替尼(68.8% vs 74.9%) 和泽布替尼 (67.3% vs 70.4%) ≥3级不良事件的发生率更低。
所有 BTK 抑制剂均与房颤发生率增加相关。随机临床试验表明,伊布替尼组的发生率高于 阿可替尼组(15.6% vs 41个月随访时的9%)或泽布替尼组(3.7% vs 29个月随访时的1.9%)。BTK抑制剂也曾报告室性心律失常,因此临床医生应考虑对有提示可能心律失常的体征或症状患者进行心脏病学评估。接受 BTK 抑制剂治疗且需要进行外科手术的患者不应在手术前后3-7天内用药,因它们与血小板功能障碍相关,从而增加出血风险。
PI3K 抑制剂可抑制 PI3K 的δ亚型,这也是惰性 B 细胞淋巴瘤患者的有效治疗策略。Idelalisib(δ亚型抑制剂)和duvelisib(δ和γ亚型抑制剂)已获批用于治疗CLL。PI3K 抑制剂与所有感染和几种免疫介导的不良事件的高发生率相关。服用 idelalisib 的患者应每月监测肝酶水平升高 (39%)、肺炎(咳嗽、呼吸困难和低氧血症)(5.5%)、腹泻 (29%) 和结肠炎 (4.5%)。对于使用 PI3K 抑制剂的患者,建议使用血液聚合酶链反应试验常规监测巨细胞病毒激活 (0.9%),并预防性使用抗生素,如磺胺甲恶唑/甲氧苄啶治疗肺孢子菌肺炎 (3.6%)。
BCL2抑制剂
BCL2 蛋白可抑制细胞凋亡的线粒体途径,BCL2 家族蛋白的过表达是 CLL 病理生理学的重要组成部分。BCL2 抑制剂维奈克拉短期治疗可诱导约70%的 CLL 患者达到完全缓解且血液或骨髓MRD阴性,停药后超过60%的患者缓解持续存在。由于可能发生肿瘤溶解综合征,开始维奈克拉治疗需要在5周内每周增加剂量。接受治疗期间应监测患者的血细胞减少情况,因为可能需要支持性治疗(如粒细胞集落刺激因子)。维奈克拉是 CYP3A4 和 P-糖蛋白的底物,在开始使用任何新的药物(例如中效和强效 CYP3A4 诱导剂和抑制剂,如苯妥英、卡马西平、伏立康唑、泊沙康唑)前咨询临床药剂师以避免不良药物相互作用。
CD20单抗包括嵌合(利妥昔单抗)和人源化(奥妥珠单抗和奥法木单抗),可与 CD20 抗原的细胞外部分结合,并通过直接作用、补体依赖性细胞毒性或抗体依赖性细胞毒性导致细胞死亡。单抗可与新型药物如维奈克拉联合使用。高达67%的患者会发生输注反应(即发热、寒战、潮红、血压或心率变化),尤其是在初始剂量时。考虑到病毒性肝炎再激活的风险,应在开始治疗前检测 B 表面抗原和核心抗体;如果患者是乙型肝炎慢性携带者,应在咨询肝病专家后开始同时进行抗病毒治疗。
在引入新型药物之前,免疫化疗是主要的治疗方法。嘌呤类似物(氟达拉滨、喷司他丁)和烷化剂(环磷酰胺、苯达莫司汀和苯丁酸氮芥)可CD20单抗联合使用。应注意的是, 58个月的中位随访,氟达拉滨-环磷酰胺-利妥昔单抗(FCR) 方案的继发性骨髓恶性肿瘤风险约为7%。目前免疫化疗在 CLL 治疗中的作用有限,因为在不同的临床环境中其均劣于 BTK 抑制剂和维奈托克方案(表2和表3)。

图1为 CLL 的治疗方案;图2为 CLL 治疗的作用机制。

一线治疗
FCR、苯达莫司汀-利妥昔单抗 (BR) 和苯丁酸氮芥-奥妥珠单抗(Chl-O)等免疫化疗曾是 CLL 的一线治疗。FCR适合年轻(< 65岁)和fit(CIRS评分<6)患者,而年龄>65岁或 CIRS 评分大于6的患者适合BR 或 Chl-O。
US E1912研究纳入529例未经治疗的 CLL 患者(无论IGHV状态如何),FCR在45个月随访时的 PFS 结局方面不如伊布替尼(无限期)联合利妥昔单抗(6个月)(伊布替尼-利妥昔单抗组的5年 PFS 为78%,FCR组为51%;P<0.001),且伊布替尼-利妥昔单抗方案的3年OS率也优于FCR(98.8% vs 91.5%;P<0.001)。A041202研究中364例患者随机接受伊布替尼、伊布替尼-利妥昔单抗或 BR,与 BR 相比,伊布替尼无限期使用(2年PFS,87% vs 74%;P<0.001)和伊布替尼-利妥昔单抗(2年PFS,88% vs 74%;P<0.001)的PFS结局更优,且在伊布替尼基础上加用利妥昔单抗未改善PFS(P=0.49)。SEQUOIA 研究纳入590例受试者,与 BR 相比,泽布替尼(无限期)单药治疗的 PFS 更佳(2年PFS,85.5% vs 69.5%;P<0.001)。
Chl-O 曾在多项入组 CIRS 评分较高 (> 6) 或年龄较大(> 65岁)患者的临床试验中用作标准治疗组。例如iLLUMINATE随机研究纳入229例患者,与 Chl-O 相比,伊布替尼-奥妥珠单抗与 PFS 改善相关(42个月PFS,74% vs 33%;P < .001);3臂随机 ELEVATE TN研究 (n = 535) 中,阿可替尼-奥妥珠单抗或阿可替尼的 PFS 均优于Chl-O(4年PFS,87% vs 78% vs 25%;P<0.001)。
CLL-14 研究将423例患者随机分配至维奈克拉-奥妥珠单抗组或 Chl-O 组治疗12个月,显示前者3年 PFS 显著改善(81.9% vs 49.5%;P<0.001);且在216例接受维奈克拉-奥妥珠单抗治疗的患者中,使用等位基因特异性寡核苷酸聚合酶链反应在75.5%的血液样本中未检测到 CLL 细胞。此外在完成治疗后随访4年以上,63%接受维奈克拉-奥妥珠单抗治疗的患者仍处于缓解状态。CLL-14 研究确定了一种时间限制性且无化疗的方案(维奈克拉治疗12个月,奥妥珠单抗治疗6个月)作为一线治疗
由于两类药物的作用机制和毒性不同,在生物学上联合抗增殖药物(如BTK抑制剂)和促凋亡药物(如维奈克拉)是合理的。在 GLOW 随机研究中,211例患者(年龄>65岁或根据 CIRS 评分确定的器官功能受损)随机接受伊布替尼-维奈克拉(12个周期)或Chl-O(6个周期);伊布替尼-维奈克拉组的2年 PFS 率优于 Chl-O 组(84.4% vs 44.1%;P<0.001)。此外在接受伊布替尼-维奈克拉治疗的患者中,54.7%治疗结束时通过二代测序未检测到疾病。
TP53异常患者
表5总结了纳入 TP53 异常(缺失或改变)患者的研究详情;表6报告了已上市 BTK 抑制剂与维奈克拉相比的共同特征。
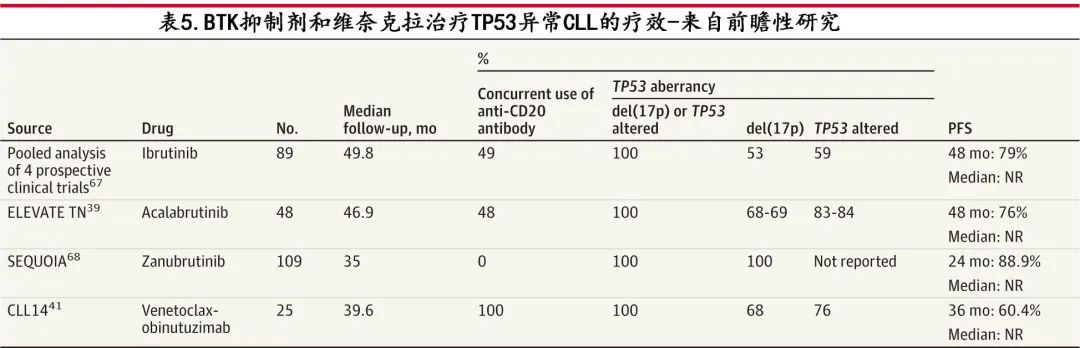

TP53是位于17号染色体短臂的促凋亡基因。通过缺失 del(17p) 或基因序列变异(存在于10%未经治疗CLL 患者中)形式的畸变,可导致化疗后短期缓解,氟达拉滨、环磷酰胺和利妥昔单抗治疗后的中位 PFS 仅为11个月,而氟达拉滨和环磷酰胺为9.1个月(p=0.03)。在使用伊布替尼治疗89例 TP53 异常患者的随机和非随机临床试验的汇总分析中,4年 PFS 率为79%。SEQUOIA研究纳入109例既往未经治疗的 del(17p) 患者,泽布替尼治疗后的2年 PFS 率为89%。ELEVATETN研究纳入48例异常 TP53 患者接受阿可替尼(联合或不联合奥妥珠单抗)治疗,4年PFS率为76%。CLL-14 研究中有49例患者 TP53 异常,接受维奈克拉-奥妥珠单抗治疗12个月,3年 PFS 为60.4%。基于这些研究,在缺乏比较 BTK 抑制剂与维奈克拉的头对头对比研究的情况下,TP53异常患者首选 BTK 抑制剂,但如果 BTK 抑制剂因为可能的不良事件无法使用(例如主要心脏疾病或出血性疾病),维奈克拉-奥妥珠单抗仍是可选方案。如果在 TP53 异常的患者中使用维奈克拉,可考虑无限期治疗。
总的来说,对于一线治疗,BTK抑制剂(阿可替尼、泽布替尼和伊布替尼)或维奈克拉-奥妥珠单抗联合治疗均是可接受的选择。BTK 抑制剂需要无限期治疗直至疾病进展或对不耐受,而维奈克拉-奥妥珠单抗可提供固定治疗持续时间(1年)的机会。有多种合并症的患者仍可使用这些药物治疗,但医学合并症可能影响治疗选择。例如在出血风险增加或心律失常控制不佳的患者中,BTK抑制剂可能与不良结局相关。如果可获得 BTK 抑制剂或维奈克拉,应避免免疫化疗方案(由于疗效较差)(表3)。
经治患者
缓解至少6个月后疾病进展的患者为复发性CLL,治疗无效或末次治疗后6个月内复发的患者为难治性CLL。对于复发和难治性患者,根据其既往接受的治疗,首选维奈克拉-利妥昔单抗(如果其既往接受过免疫化疗或 BTK 抑制剂)或 BTK 抑制剂(如果其既往接受过免疫化疗或维奈克拉)治疗。在 ASCEND研究中,398例复发或难治性 CLL 患者随机接受 阿可替尼或研究者选择的药物(BR或 idelalisib 和利妥昔单抗),结果阿可替尼的1年 PFS 更优(88% vs 75%;P<0.001)。在 MURANO研究中,389例复发性 CLL 患者随机接受维奈克拉(24个月)联合利妥昔单抗(6个月)固定持续时间治疗或 BR结果前者的PFS(中位53.6 vs 17个月;P<0.001)和总生存率(5年时为82.1% vs 62.2%)更优。在 BTK 抑制剂治疗后进展的患者中应立即开始治疗,患者可能需要住院快速增加维奈克拉剂量,并继续 BTK 抑制剂治疗直至(甚至之后)达到维奈克拉的治疗目标剂量。
对于接受维奈克拉一线治疗后疾病进展的患者,选择后续治疗时考虑进展时间很重要。使用维奈克拉期间疾病进展表明需要转换为 BTK 抑制剂作为替代治疗,而在完成计划的治疗持续时间后复发的患者或可从重新使用维奈克拉中获益。在复发患者中,PI3K抑制剂delalisib(联合利妥昔单抗)和 duvelisib 已获批用于CLL,建议使用时密切监测免疫介导的事件和感染。此外这些药物不应作为一线治疗,因为与既往接受过治疗的患者 (13%) 相比,接受一线治疗的患者 (54%) idelalisib 诱导的≥3级肝酶升高的发生率更高。BTK 的非共价(可逆)抑制剂,如pirtobrutinib,也是一类有效的 CLL 药物。已在既往接受过共价 TKB 抑制剂 (100%) 和维奈克拉(41%) 治疗的复发性 CLL 患者中证实了 Pirtobrutinib 的疗效,且在不考虑既往治疗史的情况下证实了疗效,包括携带突变型 C481S 基因的患者中有50%-70%达到总体缓解。

泽布替尼和阿可替尼对 BTK 的选择性高于伊布替尼(对非 BTK 酶的影响较小),最初预期具有更好的安全性,两项临床试验通过在复发患者中比较阿可替尼与伊布替尼(ELEVATE R/R研究)和泽布替尼与伊布替尼(ALPINE研究)检验了这一假设。在 ELEVATE R/R 研究中,533例经治高危CLL(del(17p) 或del(11q))患者随机接受阿可替尼或伊布替尼治疗;结果阿可替尼在 PFS 方面非劣于伊布替尼(两组中位数均为38.4个月),但房颤/房扑(9.4% vs 16%;p=0.02)和高血压 (9.4% vs 23.2%)的发生率较低,而头痛的发生率 (34.6% vs 20%) 高于伊布替尼治疗。阿可替尼组因不良事件导致的停药率为14.7%,伊布替尼组为21.3%。在 ALPINE 研究中,652例经治 CLL 患者随机接受泽布替尼或伊布替尼治疗,结果泽布替尼的ORR(86.2% vs 75.7%;P<0.001)和PFS(24个月PFS,78.4% vs 65.9%;P=0.002)更优,TP53 异常患者的疗效也有所改善(24个月PFS,72.6% vs 54.6%;P=0.01)。泽布替尼组房颤/房扑的累积发生率较低 (5.2% vs 13.3%),但中性粒细胞减少的发生率升高 (29.3% vs 24.4%),而感染率未升高 (71.3% vs 73.1%);此外与伊布替尼组相比,泽布替尼组导致治疗停止的事件不太常见 (14.5% vs 22.2%)。
共价 BTK 抑制剂的耐药机制相似,应避免在疾病进展后转换此类药物(阿可替尼、泽布替尼或伊布替尼)。如果是因不良反应导致的不耐受而停用 BTK 抑制剂,应在开始额外治疗前评估治疗适应症,尤其是对于使用 BTK 抑制剂≥2年的患者。E1912 研究的数据表明,从因不良反应停用伊布替尼到开始新治疗的中位时间为25个月。如果有治疗指征,临床试验表明,阿可替尼或泽布替尼可有效用于伊布替尼不耐受患者,且泽布替尼可用于伊布替尼或 阿可替尼不耐受患者。根据这些研究的结果,与伊布替尼相比,泽布替尼和阿可替尼是首选药物,因为其安全性特征更佳,并且泽布替尼的疗效优于伊布替尼。

异基因造血干细胞移植
异基因造血细胞移植是唯一可能治愈 CLL 的手段,5年 PFS 率约为40%,但约30%-50%的患者会发生并发症,如移植物抗宿主病,其与约10%-20%患者的死亡率相关。对于BTK 抑制剂和/或维奈克拉治疗后CLL获得完全缓解或部分缓解的患者,应讨论异基因移植(图1)。
CAR-T
CAR-T是多种 B 细胞淋巴恶性肿瘤的标准治疗,但CLL领域仍在研究。在 TRANSCEND 研究的1期部分,23例接受 BTK 抑制剂 (91%)、维奈克拉(65%) 或两者 (48%) 后进展的高危 CLL 患者均接受了lisocabtagenemaraleucel伴或不伴伊布替尼。根据 CLL 标准国际研讨会,缓解率为82%,24个月随访时大多数患者的外周血 (75%) 或骨髓 (64%) 通过流式细胞术未检测到疾病。
CAR-T 治疗存在细胞因子释放综合征,细胞因子释放综合征是一种以发热和多器官功能障碍为特征的急性全身炎症综合征。在 TRANSCED 研究中,74%的患者发生细胞因子释放综合征(9%为3级)。神经系统事件也与 CAR-T 治疗相关,本研究中39%的患者出现暂时性神经系统事件(21%为3级或4级)。这些不良反应可能会限制 CAR-T 治疗在某些患者中的临床应用,但如果获批,其对于 BTK 抑制剂或维奈克拉治疗后出现疾病进展的患者将是一种重要选择。
Richter转化
Richter 转化,即 CLL 转化为高级别淋巴瘤(大 B 细胞淋巴瘤 [90%] 和霍奇金淋巴瘤 [10%]),在 CLL 患者中的发生率高达10%,发生率约为每年0.5%~1%。CLL 和 Richter 转化患者的中位总生存期约为3-4个月,因此患者应参加临床试验。不到15%的患者可在初始化疗方案如标准治疗R-CHOP后达到完全缓解,应考虑对这些患者进行异基因或自体干细胞移植巩固治疗。Richter 转化为霍奇金淋巴瘤的患者接受标准化疗方案后2年总生存率约为72%,对于未处于首次缓解的复发患者,保留移植作为巩固治疗。
参考文献
Mazyar Shadman.Diagnosis and Treatment of Chronic Lymphocytic Leukemia: A Review.JAMA . 2023 Mar 21;329(11):918-932. doi: 10.1001/jama.2023.1946.


