Lancet Oncol.| 泽尼达妥单抗治疗HER2-扩增、不可切除、局部晚期或转移性胆道癌患者(HERIZON-BTC-01)
时间:2023-08-18 19:37:12 热度:37.1℃ 作者:网络
HER2在胆道癌亚群中过表达或扩增。泽尼达妥单抗(Zanidatamab)是一种靶向两个不同HER2表位的双特异性抗体,在表达HER2或HER2(也称为ERBB2)扩增治疗难治性胆道癌症中表现出耐受性和初步抗肿瘤活性。

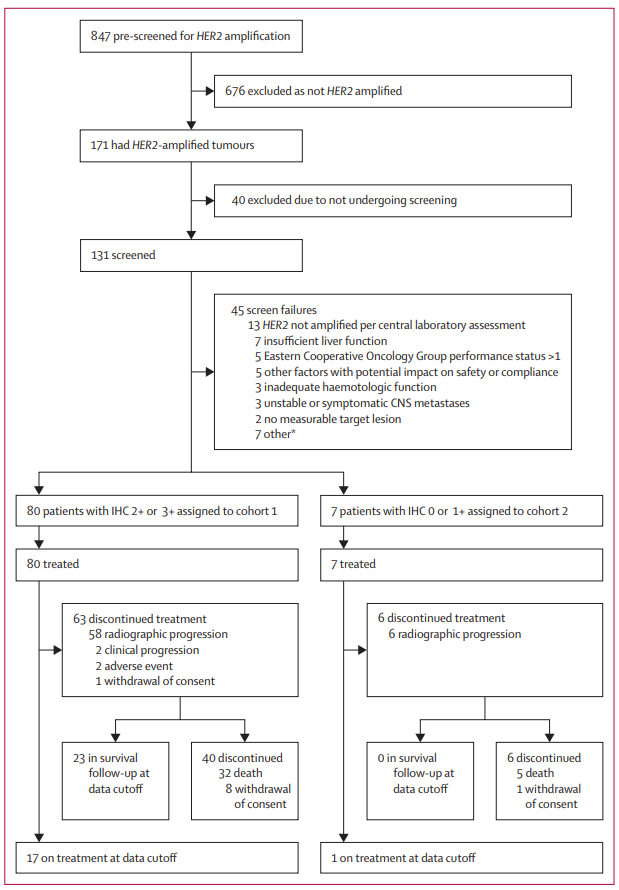
方法:HERIZON-BTC-01是在北美、南美、亚洲和欧洲九个国家的32个临床试验点招募的一项全球、多中心、单臂、2b期试验,该试验针对先前吉西他滨治疗后出现疾病进展的HER2扩增、不可切除、局部晚期或转移性胆道癌症患者。符合条件的患者年龄为18岁或18岁以上,患有HER2-扩增的胆道癌症,根据实体瘤疗效评价标准(1.1版)评估至少有一个可测量的靶病变,且东部肿瘤协作组的状态为0或1。根据HER2免疫组织化学(IHC)评分将患者分为队列:队列1(IHC 2+或3+;HER2阳性)和队列2(IHC 0或1+)。患者每2周静脉注射一次泽尼达妥单抗20mg/kg。主要终点是通过独立中央审查评估的队列1中的客观反应率。对所有接受任何剂量泽尼达妥单抗的参与者的抗肿瘤活性和安全性进行了评估。
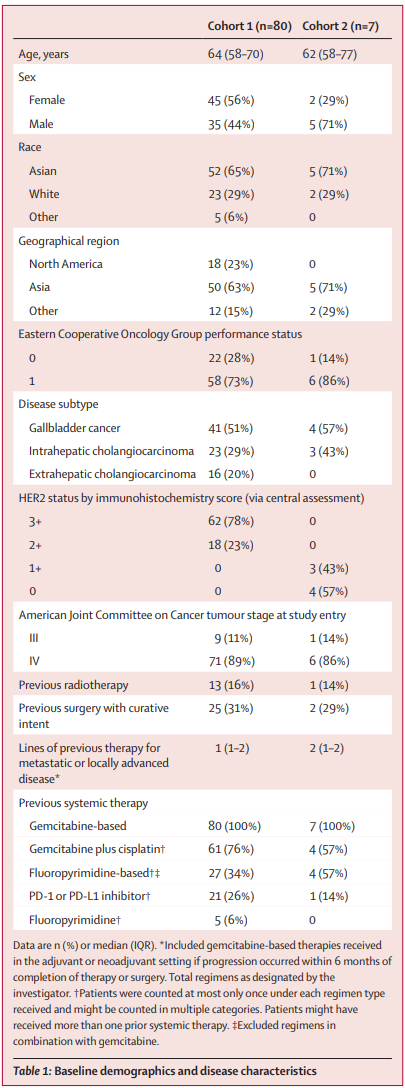
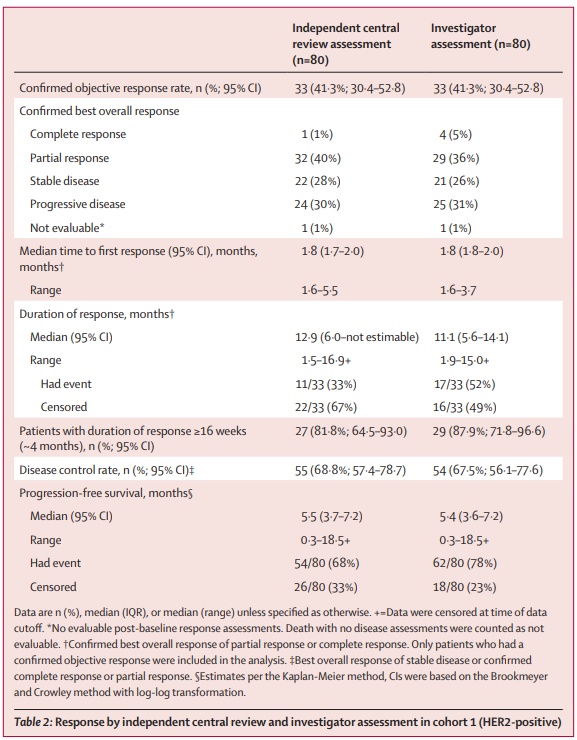
研究结果:在2020年9月15日至2022年3月16日期间,有87名患者入选HERIZON-BTC-01:队列1中有80名患者(45[56%]为女性,35[44%]为男性;52[65%]为亚洲人;中位年龄为64岁[IQR 58-70]),队列2中有7名患者(5[71%]为男性,2[29%]为女性;5[71%]为亚洲人;中位数年龄为62岁[IQR 58/77])。在数据截止时(2022年10月10日),18名(21%)患者(队列1中17名,队列2中1名)继续接受泽尼达妥单抗治疗;69名(79%)患者停止治疗(64名[74%]患者的放射学进展)。中位随访时间为12.4个月(IQR 9.4-17.2)。在队列1中的33名患者中观察到独立中央审查确认的客观反应(41.3%[95%CI 30.4-52.8])。
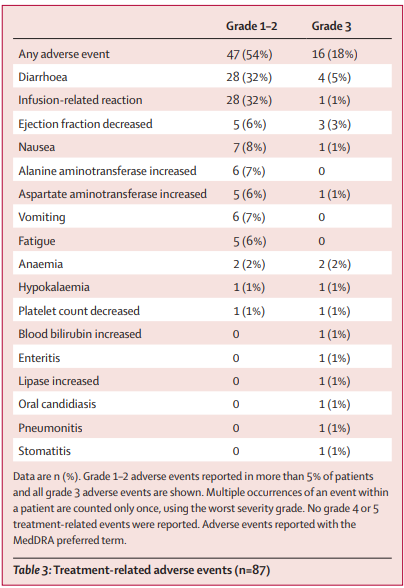
安全性分析:16名(18%)患者出现3级治疗相关不良事件;最常见的是腹泻(4名[5]患者)和射血分数降低(3名[3]患者)。无4级治疗相关不良事件,无治疗相关死亡。
结论:泽尼达妥单抗在治疗难治性、HER2-阳性胆道癌症患者中表现出有意义的临床益处,具有可控的安全性。这些结果支持了泽尼达妥单抗作为HER2-阳性胆道癌症未来的治疗选择。
原始出处:
Harding JJ, et al. 2023. Zanidatamab for HER2-amplified, unresectable, locally advanced or metastatic biliary tract cancer (HERIZON-BTC-01): a multicentre, single-arm, phase 2b study. The Lancet Oncology 24:772-782. DOI: 10.1016/s1470-2045(23)00242-5.


