【论著】| WTAP通过调节BMI1 mRNA的m6A修饰促进胶质瘤细胞增殖和有氧糖酵解
时间:2023-08-19 22:48:46 热度:37.1℃ 作者:网络
[摘要] 背景与目的:甲基转移酶Wilms瘤1-相关蛋白(Wilms’ tumor 1-associating protein,WTAP)被证实在肿瘤中发挥重要作用,本研究旨在从N6-甲基腺苷(N6-methyladenosine,m6A)修饰的角度探讨WTAP在胶质瘤发生、发展过程中的作用及其机制。方法:通过芯片筛选胶质瘤中差异表达的m6A调节因子,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)和蛋白质印迹法(Western blot)评估WTAP/B细胞特异性莫洛尼氏鼠白血病病毒整合位点1(B cell-specific Moloney murine leukemia virus integration site 1,BMI1)在胶质瘤组织和细胞系中的表达。借助四甲基偶氮唑盐(methyl thiazoyl terazolium,MTT)探究WTAP/BMI1对胶质瘤细胞增殖的作用。采用细胞外酸化率(extracellular acidification rate,ECAR)试剂盒、葡萄糖消耗及乳酸生成检测试剂盒评估胶质瘤细胞有氧糖酵解情况。结果:相对于正常组织,WTAP、BMI1在胶质瘤组织中表达上调。此外,相对于HEB细胞中的WTAP(1.01±0.13)和BMI1(1.02±0.11)表达,U251细胞中的WTAP(2.38±0.17)、BMI1(2.25±0.14)表达增强(P均<0.05)。敲减WTAP在体外能抑制细胞增殖和糖酵解能力,而过表达WTAP则显示相反效果。过表达WTAP对胶质瘤细胞增殖、糖酵解的作用能被敲减BMI1部分挽救(P均<0.05)。在机制上,WTAP促进BMI1的m6A甲基化修饰,使BMI1 mRNA的稳定性增强(P均<0.05)。结论:WTAP能以m6A甲基化依赖方式促进BMI1表达,从而促进胶质瘤细胞增殖和有氧糖酵解,靶向WTAP的分子治疗手段可能为改善胶质瘤治疗效果提供新方向。
胶质瘤是中枢神经系统中较为常见的原发性恶性肿瘤,易复发且死亡率极高[1-3]。了解胶质瘤发病的分子机制有助于寻找治疗胶质瘤的新策略。N6-甲基腺苷(N6-methyladenosine,m6A)修饰是常见的一种RNA修饰手段[4-5]。m6A甲基转移酶、去甲基化酶及识别蛋白构成了m6A家族的主要部分,Wilms瘤1-相关蛋白(Wilms’ tumor 1-associating protein,WTAP)是其中一类m6A甲基转移酶[6]。有研究[7]表明,WTAP在恶性胶质瘤中显著上调,但其具体作用及机制不明。本研究将进行详细探讨。B细胞特异性莫洛尼氏鼠白血病病毒整合位点1(B cell-specific Moloney murine leukemia virus integration site 1,BMI1)以往被发现在胶质瘤组织和细胞中表达明显升高[8],高水平的BMI1在低氧条件下显著增加胶质瘤干细胞增殖并抑制其凋亡[9]。本研究旨在探讨m6A甲基转移酶WTAP是否能通过甲基化修饰促进BMI1的稳定性,分析其对胶质瘤细胞恶性表型和异常代谢的影响及机制,为进一步了解驱动胶质瘤进展的因素和采取更好的干预措施提供参考。
1 材料和方法
1.1 材料和试剂
经短串联重复序列(short tandem repeat,STR)鉴定正确的人正常脑神经胶质细胞HEB和人胶质瘤细胞系U251均购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),相关抗体和细胞外酸化率(extracellular acidification rate,ECAR)试剂盒均购自英国Abcam公司,TRIzol试剂盒购自美国Invitrogen公司,LipofectamineTM3000转染试剂、实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒和酶标仪均购自美国Thermo Fisher公司,反转录试剂盒购自宝生物工程(大连)有限公司,过表达质粒及其siRNA干扰质粒均由上海吉玛制药技术有限公司设计并合成,Seahorse XF 96细胞外通量分析仪购自美国Agilent公司,四甲基偶氮唑盐(methyl thiazoyl terazolium,MTT)检测试剂盒、细胞葡萄糖含量检测试剂盒和乳酸生成试剂盒均购自北京索莱宝生物科技有限公司,Magna甲基化RNA免疫沉淀(Methylated RNA immunoprecipitation,MeRIP)™ m6A试剂盒和放线菌素D试剂均购自美国Millipore公司。
1.2 生物信息学分析
通过DisGeNET数据库(https://www.disgenet. org/)获取胶质瘤的疾病风险基因,筛选以基因-疾病关联(gene-disease association,GDA)评分排名的前50个基因。通过StarBase数据库(http://starbase.sysu.edu.cn/)预测RNA结合蛋白(RNA-binding protein,RBP)-mRNA关系并筛选潜在的mRNA。通过UniProt数据库(https://www. uniprot.org/)查找相关蛋白序列,通过RPIseq数据库(http://pridb.gdcb.iastate.edu/RPISeq/)对RBP与mRNA的结合分数进行评价,采用Venn工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)获取交集结果。为寻找目的基因的m6A修饰位点,借助RMbase数据库(http://rna.sysu. edu.cn/rmbase/)和SRAMP网站(http://www. cuilab.cn/sramp/)预测分析。GTEx网站(https://gtexportal.org/home/)用于预测BMI1与WTAP的相关性。
1.3 临床组织标本收集
收集2019年12月—2020年12月在南阳医学高等专科学校第一附属医院就诊并经病理学检查证实为胶质瘤的47例患者作为Glioma组,其中男性25例,女性22例,年龄29~74岁,平均年龄(49.83±10.48)岁。纳入标准:① 术中经两名或两名以上病理科医师确认为胶质瘤;② 初次被确诊为胶质瘤且入院前未经历过放疗、化疗、免疫治疗等任何形式的抗肿瘤治疗;③ 既往无脑卒中等脑科疾病史。排除标准:① 曾有脑组织损伤史;② 合并其他恶性肿瘤;③ 合并其他免疫系统疾病;④ 合并有重要脏器功能障碍。同时排除在南阳医学高等专科学校第一附属医院因脑损伤行脑组织碎片清除术的恶性肿瘤患者30例,收集其正常脑组织作为对照组(Normal组),其中男性17例,女性13例,年龄33~63岁,平均年龄(47.17±7.98)岁。脑组织自采集离体后立即置于-80℃条件下保存。本研究受试患者临床资料完整,试验开始前已获得患者及家属的知情同意,术中及术后所有程序均经南阳医学高等专科学校第一附属医院伦理委员会核查批准后进行。
1.4 细胞培养与转染
HEB细胞复苏后将其置于含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基中常规培养,U251细胞置于含1%青霉素-链霉素和10%FBS的DMEM培养基中常规培养(37 ℃、 CO2体积分数为5%、湿度70%~80%)。待细胞培养至密度为80%~90%时进行1∶3传代。转染前24 h将细胞接种于不含抗生素的培养基中,在融合度达到30%~50%时在37 ℃条件下采用LipofectamineTM3000试剂盒进行转染操作。将oe-WTAP(过表达WTAP序列)、sh-WTAP(敲减WTAP序列)、sh-BMI1(敲减BMI1序列)、oe-WTAP-NC、sh-WTAP-NC及sh-BMI1-NC转染至细胞后6 h,更换新鲜的培养液,继续培养至48 h。
1.5 RTFQ-PCR检测mRNA表达
采用TRIzol试剂进行总RNA提取,向裂解产物中加入氯仿溶液混匀,10 min后以12 000 r/min离心15 min,加入异丙醇后混匀,静置10 min后再次以12 000 r/min离心10 min,弃去上清液,借助紫外分光光度计测定RNA浓度和纯度。以RNA为模板,参照反转录试剂盒说明书进行反转录合成单链cDNA,随后采用SYBR Premix EX Taq试剂盒,根据PCR引物(表1)进行扩增,采用RTFQ-PCR系统分析每个反应的Ct值,GAPDH作为内参基因,用2-△△Ct计算目的基因的相对表达水平。

1.6 Western blot检测蛋白水平
将对数生长期的细胞用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)清洗后以体积比1∶4加入RIPA裂解液,并在冰上进行研磨裂解。随后以12 000 r/min的转速离心30 min,收集上清液,采用二辛可宁酸(bicinchoninic acid,BCA)法测定蛋白质浓度。完成十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)后转膜,室温下用5%的脱脂牛奶封闭,加入一抗anti-WTAP(1∶1 000)和anti-BMI1 (1∶10 000)温育过夜。第2天添加辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗山羊抗兔免疫球蛋白G(immuroglobulin G,IgG)(1∶1 000),室温下在摇床上温育1 h。用含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween,TBST)洗膜后添加化学发光试剂显色显影,并置于全自动凝胶成像分析仪下曝光拍照,采用Image J软件对蛋白条带灰度进行定量分析,蛋白的相对含量 = 目标条带灰度值/GAPDH条带灰度值。
1.7 MTT检测细胞增殖活力
将对数生长期细胞进行消化、重悬并且调整细胞密度后接种至96孔板中,在培养0、24、48、72 h时,分别向每孔中加入20 μL MTT工作液,温育4 h后吸弃孔内溶液,每孔加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),振荡10 min。借助酶标仪检测490 nm波长处的吸光度(D)值,并根据标准曲线计算各组细胞增殖活力。
1.8 细胞糖酵解能力检测
收集细胞,加入提取液超声破碎1 min,4 ℃下以15 000 r/min的速率离心10 min后加入氯仿溶液振荡混匀,再次于4 ℃下以15 000 r/min的速率离心3 min,取上清液用于检测。采用葡萄糖检测试剂盒测定葡萄糖消耗水平,将样本和试剂混匀后在37 ℃下保温15 min后,读取505 nm波长处的D值并进行相应计算。采用乳酸生成试剂盒检测乳酸生成水平,将波长调至570 nm测定D值并进行相应计算。ECAR根据制造商的说明,使用Seahorse XF 96细胞外通量分析仪测量,并按照ECAR检测试剂盒说明书分别在不同时间点添加葡萄糖、糖酵解抑制剂2-脱氧葡萄糖及寡霉素与不同转染组细胞共培养,以检测ECAR。
1.9 MeRIP-RTFQ-PCR检测
借助Magna MeRIP™m6A试剂盒对细胞进行MeRIP检测。分离出总RNA用m6A抗体或抗小鼠IgG进行免疫沉淀,并与Magna ChIP蛋白/G磁珠共温育。洗脱后的RNA采用RTFQ-PCR分析进行检测。
1.10 放线菌素D试验
为评估RNA的稳定性,借助放线菌素D进行RNA分解实验。将培养的细胞接种至96孔板中添加放线菌素D,终浓度为5 μg/mL,并分别在0、3、6 h收集细胞。分离出总RNA,随后进行RTFQ-PCR以量化BMI1 mRNA的相对表达水平(相对于0 h)。
1.11 统计学处理
采用Prism 8.0统计软件对研究数据进行分析,计数资料以n表示,采用χ2检验或Fisher确切概率法进行检验。计量资料以x±s表示。两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 WTAP表达在胶质瘤中显著上调
利用RTFQ-PCR对WTAP的表达进行检测发现,与正常脑组织比较,WTAP在胶质瘤组织中的表达水平显著上调(P<0.05,图1A)。且相对于人正常神经胶质细胞HEB,WTAP在U251细胞中的表达水平显著上调(P<0.05,图1B)。根据WTAP在胶质瘤组织中表达水平的中位数将其分为高表达组和低表达组,分析WTAP表达与患者临床病理学特征的关系,结果显示,WTAP的表达与胶质瘤患者的世界卫生组织(World Health Organization,WHO)分级有关(P<0.05),与性别、年龄和肿瘤大小均无关(P均>0.05,表2)。综上所述,WTAP在胶质瘤中表达上调,推测其表达失调可能与胶质瘤的发生有关。
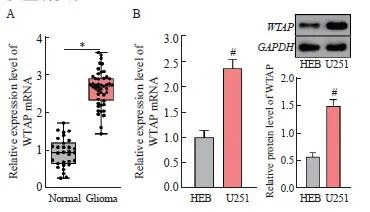
图1 WTAP表达在胶质瘤中显著上调
Fig. 1 WTAP expression was significantly upregulated in glioma
A: Gene expression of WTAP in normal brain tissue and glioma tissue; B: The gene expression and protein level of WTAP in HEB and U251 cells was detected by RTFQ-PCR and Western blot. *: P<0.05, compared with Normal group; #: P<0.05, compared with HEB cells.

2.2 敲减WTAP抑制胶质瘤增殖及有氧葡萄糖的代谢能力
干预胶质瘤细胞中WTAP的表达并检测各组细胞的增殖和糖酵解情况,MTT结果显示,sh-WTAP组细胞活力较sh-WTAP-NC组明显下降(P <0.05,图2A)。sh-WTAP组U251细胞的葡萄糖消耗和乳酸输出均明显减少(P均<0.05,图2B、2C),同时ECAR明显减弱(P<0.05,图2D)。综上所述,敲减WTAP可抑制胶质瘤细胞的增殖及葡萄糖有氧代谢能力。
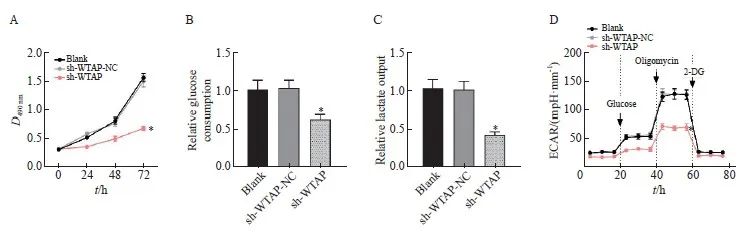
图2 敲减WTAP抑制胶质瘤细胞增殖及有氧糖酵解
Fig. 2 Knockdown of WTAP inhibits glioma cell proliferation and aerobic glycolysis
A: Cell proliferation activity detected by MTT assay; B: Relative level of glucose consumption in each group; C: The relative level of lactic acid production in each group; D: Relative expression levels of ECAR in each group. *: P<0.05, compared with sh-WTAP-NC group.
2.3 WTAP可能通过m6A修饰的方式调控BMI1
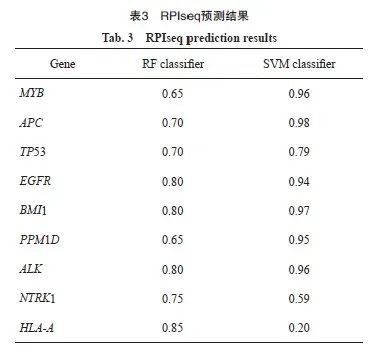
通过StarBase数据库获取WTAP作为结合蛋白可能结合的基因,共3 226个。通过DisGeNET数据库检测胶质瘤相关基因(CUI:C0017638),根据GDA评分选择风险系数最高的前50个基因,Venn筛选结果显示共有9个交集基因,分别为MYB、APC、TP53、EGFR、BMI1、PPM1D、ALK、NTRK1和HLA-A(图3A)。通过RPIseq数据库对WTAP与MYB、APC、TP53、EGFR、BMI1、PPM1D、ALK、NTRK1、HLA-A结合分数进行评价,结果显示,BMI1与WTAP结合能力最强(RF分级为0.8,SVM分级为0.97,表3)。通过RMbase数据库预测到WTAP的作为m6A调节因子的DNA功能域为GAAGAAG(图3B)。通过SRAMP网站发现BMI1存在多个具有非常高可信度的m6A甲基化修饰位点(图3C)。GTEx网站预测结果显示,BMI1与WTAP在脑组织中的表达呈正相关(r=0.78,P<0.05,图3D)。综上预测结果,推测WTAP可能通过m6A修饰的方式调控BMI1。
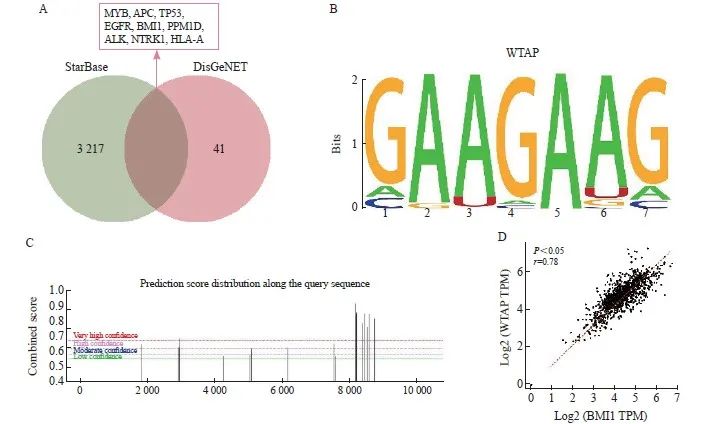
图3 WTAP可能通过m6A修饰的方式调控BMI1的表达
Fig. 3 WTAP may regulate the expression of BMI1 through m6A modification
A: Binding protein of WTAP and glioma risk genes was predicted by StarBase and DisGeNET database respectively; B: DNA functional domain of WTAP predicted by RMbase website; C: m6A methylation modification sites of BMI1 predicted by SRAMP website; D: Correlation analysis of WTAP and BMI1 predicted by GTEx website.
2.4 WTAP以m6a依赖的方式上调BMI1在胶质瘤中的表达
RTFQ-PCR结果显示,与正常脑组织相比,BMI1在胶质瘤组织中的表达水平显著上调(P <0.05,图4A),且与WTAP在胶质瘤组织中的表达水平呈正相关(P<0.05,图4B)。BMI1在U251细胞中的表达水平较HEB细胞显著上调(P<0.05,图4C)。在U251细胞中分别过表达和敲减WTAP并对m6A含量进行检测,结果显示,相对于oe-WTAP-NC组,oe-WTAP组的m6A含量增加(P<0.05),而相对于sh-WTAP-NC组,sh-WTAP组的m6A含量降低(P<0.05,图4D)。MeRIP-RTFQ-PCR检测结果显示,过表达WTAP能够富集更多的BMI1 mRNA,而敲减WTAP则能够减少BMI1的富集(P均<0.05,图4E)。RTFQ-PCR和放线菌素D实验检测结果表明,相对于oe-WTAP-NC组,oe-WTAP组的BMI1 mRNA表达增加,RNA稳定性增强(P<0.05),而相对于sh-WTAP-NC组,sh-WTAP组的BMI1 mRNA表达减少,BMI1稳定性降低(P<0.05,图4F、4G)。
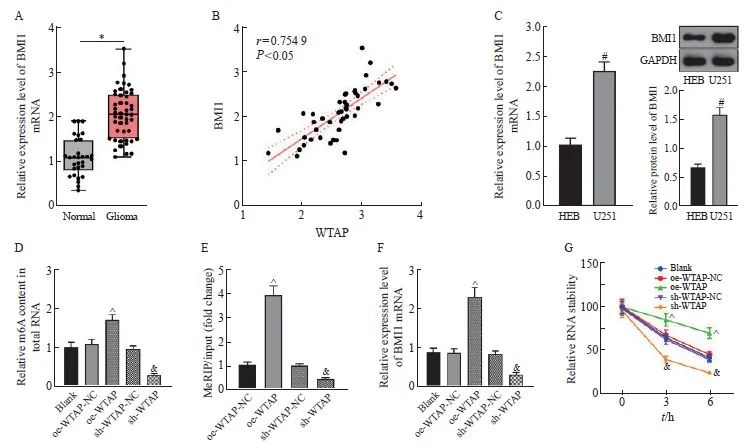
图4 WTAP以m6A依赖的方式上调BMI1在胶质瘤中的表达
Fig. 4 WTAP upregulates BMI1 expression in gliomas in an m6A-dependent manner
A: BMI1 mRNA expression in normal brain tissue and glioma tissue detected by RTFQ-PCR; B: correlation analysis of BMI1 and WTAP mRNA expression in glioma tissue; C: BMI1 mRNA and protein expression in HEB and U251 cells tested by RTFQ-PCR and Western blot; D: Relative m6A content in total RNA in each group of cells; E: MeRIP-RTFQ-PCR testing results; F: Relative expression level of BMI1 mRNA in each group of cells; G: Relative RNA stability in each group of cells. *: P<0.05, compared with Normal group; #: P<0.05, compared with HEB cells; ^: P<0.05, compared with oe-WTAP-NC group; &: P<0.05, compared with sh-WTAP-NC group.
2.5 WTAP通过m6a依赖的方式上调BMI1诱导胶质瘤细胞恶性增殖和糖代谢异常
RTFQ-PCR结果显示,过表达WTAP能够上调BMI1的表达,而oe-WTAP对BMI1表达的促进作用能被sh-BMI1部分挽救(P<0.05,图5A)。MTT结果显示,oe-WTAP组细胞活力较oe-WTAP-NC组显著增强(P<0.05),葡萄糖摄取和乳酸生成均显著增加(P均<0.05),同时ECAR显著上调(P<0.05),而与oe-WTAP+sh-BMI1-NC组相比,oe-WTAP+sh-BMI1组细胞活力减弱,葡萄糖摄取和乳酸生成减少,ECAR显著下降(P均<0.05,图5B~5E)。上述结果表明,WTAP能以m6A依赖的方式上调BMI1,并促进胶质瘤细胞恶性增殖和糖代谢异常。详细机制见图5F。
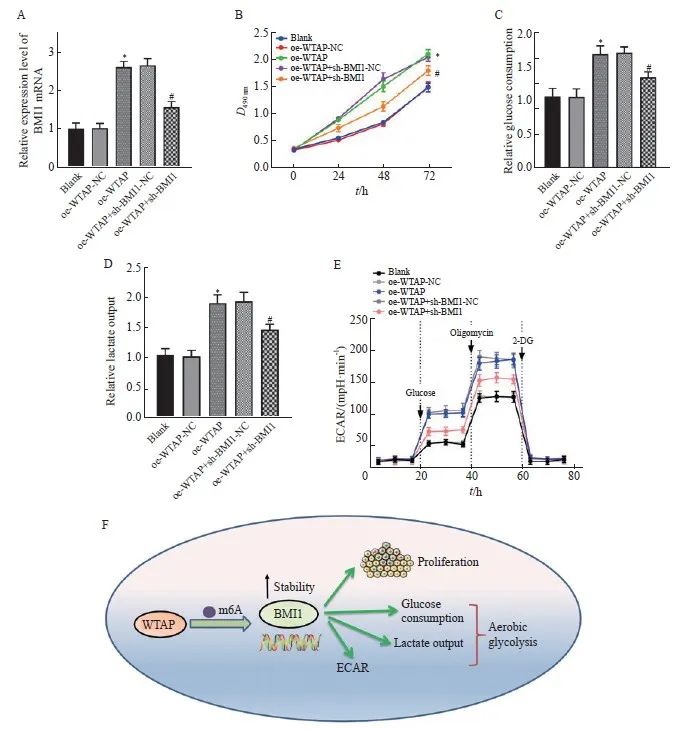
图5 WTAP通过m6A依赖的方式上调BMI1的表达进而诱导胶质瘤细胞增殖和糖代谢异常
Fig. 5 WTAP upregulates BMI1 expression in an m6A-dependent manner and induces glioma cell proliferation and abnormal glucose metabolism
A: BMI1 mRNA expression in each group detected by RTFQ-PCR; B: Cell viability in each group tested by MTT; C: Relative glucose consumption of U251 cells in each group; D: Changes of lactic acid production in U251 cells; E: Changes of ECAR level in U251 cells; F: Mechanism diagram of WTAP promoting glioma cell proliferation and aerobic glycolysis by enhancing BMI1 stability. *: P<0.05, compared with oe-WTAP-NC group; #: P<0.05, compared with oe-WTAP+sh-BMI1-NC group.
3 讨 论
本研究证实m6A甲基转移酶WTAP通过增强胶质瘤细胞的异常增殖和代谢从而发挥致癌作用。WTAP通过m6A甲基化修饰增强了BMI1的转录稳定性,从而提高BMI1的表达水平并促进细胞增殖和糖酵解效应。
WTAP作为甲基转移酶家族的一员,能够协调METTL3-METTL14异源二聚体定位到核斑点,影响m6A沉积并且调控一系列不同的生物学过程,如mRNA转录、剪接、翻译、核出口、定位和稳定性等[10-11]。WTAP作为m6A调节因子被发现其水平升高能促进包括癌症在内的多种疾病的进展,例如,WTAP在多种肿瘤中表达上调,并通过与RNA加工和细胞增殖中的不同蛋白质相互作用从而发挥致癌作用[12],WTAP能调节ATF4的m6A修饰,促进心肌缺血再灌注损伤[13]。WTAP通过结合HK2的m6A修饰位点,增强HK2 mRNA稳定性,从而促进胃癌的有氧糖酵解[14]。C5aR1阳性中性粒细胞可通过WTAP依赖的ENO1 m6A甲基化影响乳腺癌细胞的糖酵解活性及肿瘤生长[15]。本研究发现并证实WTAP在胶质瘤中表达异常增强,且通过m6A修饰的方式上调BMI1的表达水平。BMI1被发现是胶质瘤细胞的原癌基因[16],因此本研究对其具体作用进行了初步探讨。Lu等[17]研究发现,癌细胞表现出独特的代谢表型,依靠有氧糖酵解来支持其增殖和同化生长,被称为沃伯格效应,其能加速肿瘤生长和增殖。有氧糖酵解参与多种癌症的转移,包括胰腺癌、肺癌和乳腺癌等[18]。作为一种高转移性的癌症类型,胶质瘤也被报道与糖酵解有关[19]。在进一步的研究[20]中,m6A被确定为调节沃伯格效应的关键机制,并与不利的预后密切相关。本研究发现,敲减WTAP、BMI1均能显著抑制胶质瘤细胞增殖活力,葡萄糖吸收、乳酸生成减少,ECAR下降,从而减弱糖酵解活性,进而抑制胶质瘤细胞生长,此作用是通过m6A甲基化修饰机制来实现的。
本研究存在一定的缺陷:首先,未进一步通过动物实验对WTAP/BMI1在胶质瘤中的作用进行验证;其次,没有对BMI1下游信号转导通路等进行分析,这也是今后需要深入研究的方向。总之,本研究通过临床标本分析和细胞水平实验证实m6A甲基转移酶WTAP可能是胶质瘤发生和代谢过程中的调控表观遗传的关键分子,揭示了WTAP/BMI1轴在胶质瘤中的角色,有助于人们深入了解胶质瘤中糖代谢重编程的分子机制,有望为胶质瘤的防治提供新的线索。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] CHEN X R, ZHANG Y G, WANG Q. miR-9-5p mediates ABCC1 to elevate the sensitivity of glioma cells to temozolomide[J]. Front Oncol, 2021, 11: 661653.
[2] 黄 灵, 邹有瑞, 李琢琦, 等. CHKA基因沉默对胶质瘤细胞生物学行为的影响及其机制[J]. 中国癌症杂志, 2021, 31(11): 1041-1049.
HUANG L, ZOU Y R, LI Z Q, et al. Effect of CHKA gene silencing on biological behavior of glioma cell and its mechanism[J]. China Oncol, 2021, 31(11): 1041-1049.
[3] 刘玉清, 柴睿超, 李阳芳, 等. 肿瘤坏死因子α诱导蛋白6基因在脑胶质瘤中的表达及其临床意义[J]. 中华神经外科杂志, 2021, 37(5)509-515
LIU Y Q, CHAI R C, LI Y F, et al. The expression and clinical significance of TNFAIP6 in gliomas[J]. Chin J Neurosurg, 2021, 37(5)509-515
[4] ZENG J, ZHANG H Y, TAN Y G, et al. Genetic alterations and functional networks of m6A RNA methylation regulators in pancreatic cancer based on data mining[J]. J Transl Med, 2021, 19(1): 323.
[5] 孙善文, 雍红梅, 周学义. m6A与mRNA代谢及其与恶性肿瘤关系的研究进展[J]. 现代肿瘤医学, 2020, 28(10)1781-1786
SUN S W, YONG H M, ZHOU X Y. Effects of N6-methyladenosine on metabolism of mRNA and the relationship with malignant tumors[J]. J Mod Oncol, 2020, 28(10)1781-1786
[6] MA Z, LI Q, LIU P, et al. METTL3 regulates m6A in endometrioid epithelial ovarian cancer independently of METTl14 and WTAP[J]. Cell Biol Int, 2020, 44(12): 2524-2531.
[7] XI Z, XUE Y X, ZHENG J, et al. WTAP expression predicts poor prognosis in malignant glioma patients[J]. J Mol Neurosci, 2016, 60(2): 131-136.
[8] FENG L, LIN T, CHE H J, et al. Long noncoding RNA DANCR knockdown inhibits proliferation, migration and invasion of glioma by regulating miR-135a-5p/BMI1[J]. Cancer Cell Int, 2020, 20: 53.
[9] BAXTER P A, LIN Q, MAO H, et al. Silencing BMI1 eliminates tumor formation of pediatric glioma CD133+ cells not by affecting known targets but by down-regulating a novel set of core genes[J]. Acta Neuropathol Commun, 2014, 2: 160.
[10] MA H Y, SHEN L Y, YANG H, et al. m6A methyltransferase Wilms’ tumor 1-associated protein facilitates cell proliferation and cisplatin resistance in NK/T cell lymphoma by regulating dual-specificity phosphatases 6 expression via m6A RNA methylation[J]. IUBMB Life, 2021, 73(1): 108-117.
[11] ZHU B Q, GONG Y Y, SHEN L, et al. Total Panax notoginseng saponin inhibits vascular smooth muscle cell proliferation and migration and intimal hyperplasia by regulating WTAP/ p16 signals via m6A modulation[J]. Biomedecine Pharmacother, 2020, 124: 109935.
[12] SORCI M, IANNIELLO Z, CRUCIANI S, et al. METTL3 regulates WTAP protein homeostasis[J]. Cell Death Dis, 2018, 9(8): 796.
[13] WANG J Y, ZHANG J H, MA Y, et al. WTAP promotes myocardial ischemia/reperfusion injury by increasing endoplasmic reticulum stress via regulating m6A modification of ATF4 mRNA[J]. Aging (Albany NY), 2021, 13(8): 11135-11149.
[14] YU H, ZHAO K, ZENG H, et al. N6-methyladenosine (m6A) methyltransferase WTAP accelerates the Warburg effect of gastric cancer through regulating HK2 stability[J]. Biomed Pharmacother, 2021, 133: 111075.
[15] OU B C, LIU Y, YANG X W, et al. C5aR1-positive neutrophils promote breast cancer glycolysis through WTAP-dependent m6A methylation of ENO1[J]. Cell Death Dis, 2021, 12(8): 737.
[16] ZHANG X, WEI C Y, LI J, et al. MicroRNA-194 represses glioma cell epithelial‑to‑mesenchymal transition by targeting Bmi1[J]. Oncol Rep, 2017, 37(3): 1593-1600.
[17] LU J J, LIU X B, ZHENG J, et al. Lin28A promotes IRF6- regulated aerobic glycolysis in glioma cells by stabilizing SNHG14[J]. Cell Death Dis, 2020, 11(6): 447.
[18] ZHU X, JIN C, PAN Q, et al . Determining the quantitative relationship between glycolysis and GAPDH in cancer cells exhibiting the Warburg effect[J]. J Biol Chem, 2021, 296: 100369.
[19] LIU X, ZHU Q J, GUO Y, et al. LncRNA LINC00689 promotes the growth, metastasis and glycolysis of glioma cells by targeting miR-338-3p/PKM2 axis[J]. Biomedecine Pharmacother, 2019, 117: 109069.
[20]LIU X S, ZHOU L M, YUAN L L, et al. NPM1 is a prognostic biomarker involved in immune infiltration of lung adenocarcinoma and associated with m6A modification and glycolysis[J]. Front Immunol, 2021, 12: 724741.


