免疫当道 曙光显现 卡瑞利珠单抗为非小细胞肺癌脑转移患者带来福音
时间:2023-08-21 19:47:33 热度:37.1℃ 作者:网络
肺癌脑转移是临床常见而严重的病情,也是肺癌治疗失败的常见原因之一。脑转移的发生不仅限制非小细胞肺癌患者(NSCLC)五年生存率进一步提高,也严重影响患者生活质量。
在此背景下,国际肺癌研究协会(IASLC)官方期刊《胸部肿瘤学》(Journal of Thoracic Oncology)重磅发表一项由中山大学肿瘤防治中心陈丽昆教授牵头的“卡瑞利珠单抗联合培美曲塞/卡铂在既往未接受系统治疗的驱动基因阴性非鳞非小细胞肺癌脑转移患者的有效性和安全性的研究(CAP-BRAIN研究)”的数据结果,引起业界广泛注目与讨论。

研究结果表明,卡瑞利珠单抗联合治疗组患者的颅内客观缓解率(iORR)为52.5%,颅内疾病控制率(iDCR)为87.5%,证实卡瑞利珠单抗联合化疗可显著控制患者肿瘤进展且安全性良好。为此,我们很荣幸邀请中山大学肿瘤防治中心陈丽昆教授就此项研究结果亮点,NSCLC脑转移患者的治疗等话题展开阐述。以下整理访谈精粹,让读者先睹为快。

Q1、肺癌脑转移是临床常见且严重的病情,也是肺癌治疗失败的常见原因。首先请您介绍下目前驱动基因阴性NSCLC脑转移患者的治疗现状?
非小细胞肺癌(NSCLC)患者脑转移发病率较高,据流行病学统计,首诊晚期NSCLC患者中约20%发生脑转移,未发生脑转移患者中约有25-40%的患者会在治疗过程中陆续出现脑转移,这严重影响患者的预后及治疗效果,也正因如此脑转移肺癌患者的治疗愈发受到关注。
从治疗角度看,对于驱动基因阳性的NSCLC脑转移患者,正如BRAIN研究所揭示的,针对EGFR和ALK通路的小分子酪氨酸激酶抑制剂(TKIs)对脑转移的控制相较于传统化疗具有明显的优势。但遗憾的是,晚期NSCLC患者中约半数无法检出驱动基因,靶向治疗收效甚微,脑部放射治疗仅能起到局部作用。因此,如何给予该类患者合理的全身治疗至关重要。目前,由于缺乏高级别循证证据,NSCLC脑转移患者的内科治疗(化疗、抗血管生成治疗)的作用尚存争议。
对于免疫治疗而言,尽管靶向PD-1/PD-L1的免疫检查点抑制剂已广泛用于晚期驱动基因阴性非小细胞肺癌的一线及二线治疗,但由于临床研究入组条件的限制,这些药物对NSCLC脑转移患者颅内肿瘤客观缓解率(iORR)和总体客观缓解率(ORR)的数据多来自于前瞻性研究中小样本量的亚组分析、回顾性研究或真实世界研究。在仅有2项前瞻性研究中,帕博利珠单抗单药用于PD-L1表达阳性的18例患者的iORR为29.7%,PD-L1表达阴性人群iORR为0%。而阿替利珠单抗联合化疗治疗驱动基因阴性非鳞NSCLC脑转移人群的iORR为40%。由于目前前瞻性研究的证据较为有限,究竟免疫治疗能否为此类人群带来获益成为学界十分关心的问题,而本项研究也可以作为一项重要循证证据前瞻性验证免疫治疗在NSCLC脑转移人群的价值。
Q2、本次由您牵头的CAP-BRAIN研究数据重磅发表在Journal of Thoracic Oncology,备受关注,更是为卡瑞利珠单抗用于非鳞NSCLC患者的出色疗效再添重磅数据。请您详细介绍下本项研究。
CAP-BRAIN研究是一项单臂、II期临床研究,全国7家中心共同参与,纳入既往未接受系统治疗,脑部靶病灶未接受放疗的驱动基因阴性非鳞非小细胞肺癌脑转移患者,旨在评估卡瑞利珠单抗联合培美曲塞/卡铂的有效性和安全性。
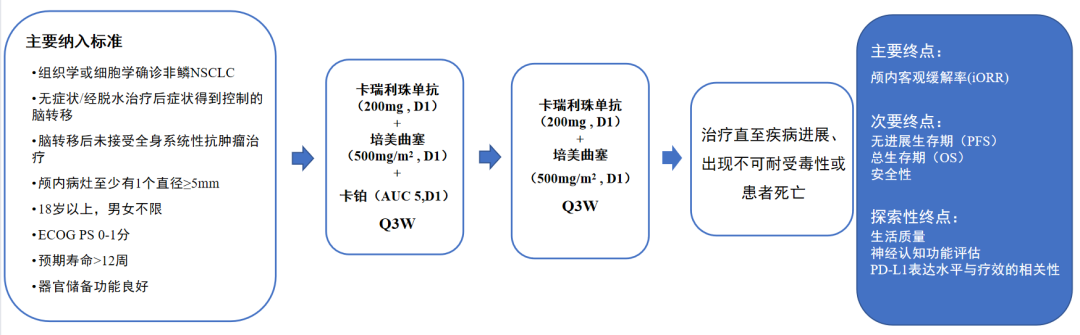
图1 CAP-BRAIN研究设计方案
截至2022年5月,本研究共入组45例患者,中位随访时间为12.5个月,最终分析结果显示iORR为52.5%,iDCR为87.5%,说明超过半数患者的颅内肿瘤得到缩小,这是十分亮眼的数据,较进口PD-1抑制剂相比更具有优势。目前,PFS和OS数据仍不成熟, 但治疗组1年iPFS率为41.9%。1年OS率为71.2%。
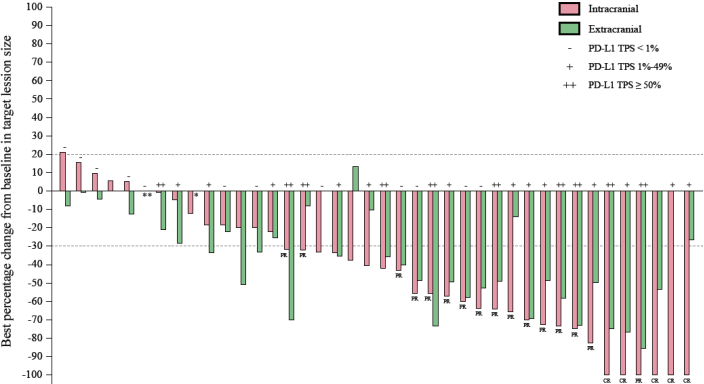
图2 最佳缓解瀑布图

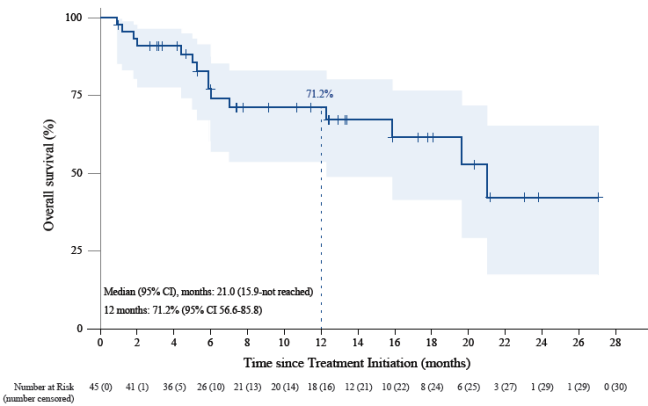
图3 颅内无进展生存期(上图)、总生存期(下图) Kaplan-Meier分析
此外,我们也做了一些亚组分析,发现基线有脑转移症状和无脑转移症状患者iORR相似,分别为50%和53.6%;在PD-L1表达水平与获益相关性的探索中,PD-L1 TPS < 1%, 1-49%, ≥50%患者的iORR分别为33.3%, 61.5%和80.0%。值得一提的是,PD-L1 TPS < 1%患者的iORR为33.3%,说明即使PD-L1表达阴性,也有约1/3的患者获益,这是十分令人鼓舞的数据,充分展现了免疫联合化疗可为NSCLC脑转移患者带来全面获益.
Q3、您认为这个研究为卡瑞利珠单抗在中国NSCLC脑转移患者治疗中的应用带来了哪些启示和获益?
整体来看,本项研究是首个PD-1抑制剂联合化疗一线治疗非鳞NSCLC脑转移患者的前瞻性、多中心研究,出色的成果不仅提示联合方案具有良好的颅内抗肿瘤活性和耐受性,更是确证了免疫联合化疗可作为驱动基因阴性脑转移患者一线治疗方案选择。
对于卡瑞利珠单抗,CameL、CameL-sq两项大型III期研究的成功确立了其在非鳞癌和鳞癌中的标准一线治疗地位,mOS均超越2年,超1/4患者生存突破4年。本项应用于非鳞脑转移NSCLC患者的研究取得成功,进一步扩大了卡瑞利珠单抗的应用范围。对比颅内ORR与颅外ORR(52.5% vs.47.5%)数据可发现,联合方案无论是对肺部的原发灶还是脑部转移灶具有相当的疗效。不仅如此,对于肺癌脑转移患者,评估系统治疗能否带来认知功能改善也是非常重要的,早期的注册研究并未特别对这方面进行评估,而卡瑞利珠单抗联合化疗在一定程度上能改善患者认知功能,这是非常难得的,充分彰显了卡瑞利珠单抗用于脑转移NSCLC患者的重要价值。
在适用人群方面,由于既往免疫单药用于肺癌脑转移的研究显示免疫检查点抑制剂对于PD-L1表达阴性的疗效甚微,然而,本次研究中,卡瑞利珠单抗联合化疗在PD-L1阴性人群同样展示出一定疗效,iORR为33.3%,进一步扩大了免疫治疗的获益人群。
最特别的是,既往注册研究的入组患者要求为无脑转移症状,或症状稳定至少2周以上,而本研究限制更加宽松,纳入28.9%基线有脑转移症状的患者,并允许入组时继续进行脱水治疗。研究结果揭示联合治疗对于这部分患者与无症状患者的颅内缓解率相似(50% vs53.6%),进一步证实了在这类患者推迟脑放疗的可行性,对于未来脑转移的治疗格局也产生重大影响。
Q4、您认为未来在NSCLC脑转移治疗方面还可以有哪些探索或研究方向?
NSCLC脑转移患者的系统治疗已经走过20余年苍茫岁月,取得了长足的进步。具体来说,我认为有以下方面。
首先,系统治疗中,化疗、靶向、抗血管生成以及免疫治疗是四大治疗手段,那么如何更加合理地排兵布阵从而最大化治疗效果,是需要领域内专家学者深入探索的。正如本人团队近期在JAMA Network Open上发布的成果,首次揭示了驱动基因阳性肺癌脑转移患者应用一代TKI联合化疗优于TKI治疗的疗效,改变了该类患者一线治疗方案,另有世界首项抗血管生成药物联合化疗应用于肺癌脑转移患者的大型III期研究也在积极开展中。这充分说明,不同药物间的组合方式仍有广阔空间值得探究,针对不同人群精准化选择合理的治疗方案会为其带来更大的生存获益。
其次,对于数量占据我国肺癌患者半壁江山的驱动基因阳性患者,因其更易发生脑转移,而越发受到密切的关注。因此,依据其突变靶点,如EGFR、ALK、ROS1以及其他少见靶点,进行有针对性的药物开发,从而进一步优化肺癌脑转移患者的治疗也是十分关键的。
再者,相比于其他疾病,多学科诊疗(MDT)在肺癌脑转移领域扮演着重要角色,依据患者自身特点,不断提升、优化全程管理与综合治疗策略,合理选择内科、外科、放疗科的介入时机,比如对于颅内占位效应严重的需要放疗先行,对于无症状或症状可控的脑转移患者,可以内科治疗先行,延迟放疗。
最后,我们应该不断开拓视野,力争基础研究、转化医学、临床实践“三驾马车”齐头并进,为药物研发提供坚实的后盾。只有深入探寻脑转移发病机制,才能从源头上化解这一困局。本人团队分别在Cancer及Oncoimmunology上发表了两项重要研究,揭示了全球最大数量脑转移患者相关基因组学的研究以及脑转移患者免疫微环境的特点,希望通过探索为脑转移的未来治疗提供方向,此外,通过建立脑脊液预测模型来筛选临床上适合脑脊液基因检测的人群,避免了临床的过度检测,此项成果作为2020ASCO口头汇报发表在ESMO的官方杂志ESMO Open上,通过脑脊液的动态研究提示脑转移患者脑脊液ctDNA的动态监测可以更精准地监测颅内疗效及预测预后,此项全球唯一的研究成果刚刚发表在BMCMedcine。
总之,在未来,希望领域内专家学者赓续奋进,引领肺癌脑转移治疗走向更深入、更精准、更广泛的方向。


