山大孙金鹏/徐华强团队合作《自然·通讯》:揭示了人痒觉受体MRGPRX1介导的瘙痒机制
时间:2023-08-24 15:46:14 热度:37.1℃ 作者:网络
瘙痒及其抓挠反应是许多动物的正常生理保护及防御反应。在硬骨鱼和四足动物分化之后,动物才可以用手脚抓挠以清除皮肤上的寄生虫或其他不需要的刺激。背根神经节(DRG)中的初级感觉神经元背根神经(DRG)中的初级感觉神经元在探测、传递和调节感觉信号方面发挥着重要作用,传递和调节从外周(皮肤)到脊髓的包括痒和痛在内的感觉信号方面发挥着重要作用。为了建立有效的检测-抓挠反应周期,四足动物发展出一个由七种跨膜受体组成、其中许多是在脊髓中表达的Mas相关 GPCRs(MRGPRs)。然而,持续存在且无法解决的瘙痒通常是一种令人不快的疾病,严重时可能导致抑郁和各种精神疾病。
因此,我们希望了解MRGPRs 在生理和病理条件下支持痒信号转导的分子机制,将有助于开发治疗瘙痒症的疗法。其中MRGPRX1是Msa相关痒觉受体家族成员之一,主要表达在DRG,能够被 γ2-黑素细胞刺激素(γ2-MSH)、牛肾上腺髓质肽(BAM)8-22以及具有难以忍受的瘙痒副作用抗疟药物氯喹(CQ)等激活,进而激活Gi 和 Gq 信号引起瘙痒。以MRGPRX1为靶点,了解痒觉的结构基础以及外周神经系统的感觉过程,将对开发的治疗痒相关疾病和中枢神经系统疼痛的药物具有重要意义。

2023年8月17日,由山东大学孙金鹏教授和徐华强教授主体设计并启动的痒觉受体工作,山东大学孙金鹏教授、上海药物研究所徐华强教授、山东大学杨帆教授、南方医科大学刘忠民教授及广州中医药大学周玖瑶教授为通讯作者,合作在Nature communications上在线发表了研究论文“Ligand recognition and G protein coupling of the human itch receptor MRGPRX1”。研究团队利用单颗粒冷冻电镜技术解析了2种不同配体作用下MRGPRX1与Gi及Gq蛋白三聚体复合物的结构(图一),发现了痒觉受体独特的结构及配体结合口袋,揭示了痒觉受体MRGPRX1识别配体的结构机制,阐明了短肽配体激活MRGPRX1的通用motif,解析了MRGPRX1与Gi和Gq偶联的结构差异,该研究系统地揭示了MRGPRX1所介导的瘙痒的分子机制,为靶向痒觉受体的药物开发提供理论及结构基础。
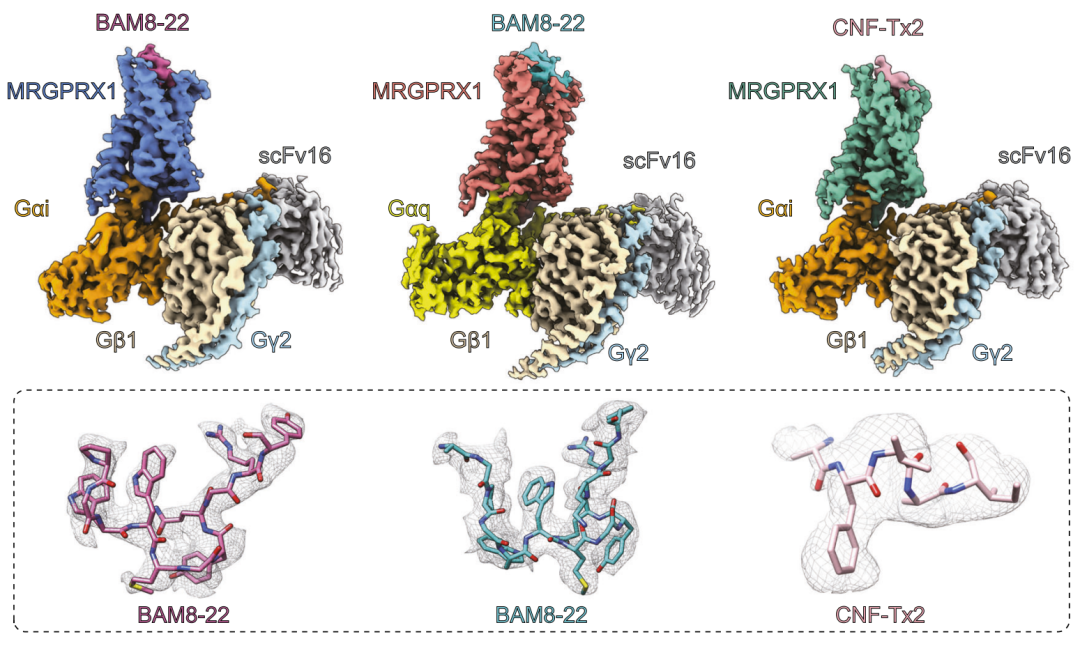
图1 不同配体作用下痒觉受体MRGPRX1与Gi和Gq蛋白三聚体复合物的结构
具体发现包括:
1.痒觉受体MRGPRX1有着较浅的配体结合口袋
从MRGPRX1的结构可以看到,与大多数classA家族的GPCRs不同,MRGPRX1的配体结合口袋较浅,配体与保守的“toggle switch”位点G2296.48的垂直距离在12.8 Å to 17.9 Å之间。这与课题组前期解析的同家族MRGPRX2受体的结合口袋特征相似(Nature. 2021 Dec;600(7887):164-169),表明可塑性显著的浅结合口袋是这一类受体的共同特征。(图二)
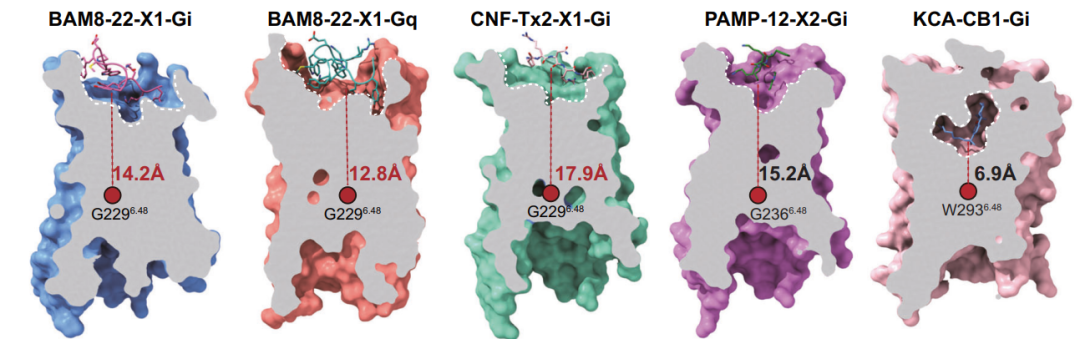
图2 MRGPRX1与MRGPRX2、CB1受体配体结合口袋的比较
2. 揭示了X1和X2的不同配体结合模式
MRGPRX1的复合物结构中短肽激动剂BAM8-22及CNF-Tx2的结合方式,与MRGPRX2复合物中短肽激动剂C14及PAMP-12完全不同。在MRGPRX2复合物结构中,C14和PAMP-12的结合模式从TM4开始,到TM1和TM2结束。相比之下,MRGPRX1中BAM8-22与CNF-Tx2的结合从N端TM5-TM6开始,到达N端TM4(图三)。
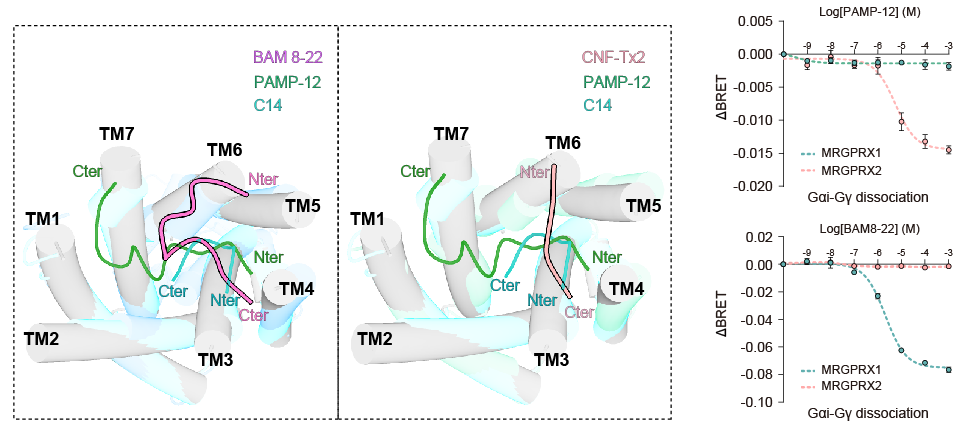
图3 MRGPRX1和MRGPRX2受体识别配体的差异
重要的是,MRGPRX1和MRGPRX2表现出不同的配体识别模式;MRGPRX2的配体PAMP-12不能激活MRGPRX1, MRGPRX1的配体BAM8-22不能被MRGPRX2识别。这些肽激动剂的不同结合模式表明了不同痒觉受体成员识别不同配体motif。进一步研究发现MRGPRX1和 MRGPRX2所识别的短肽配体motif有所不同。MRGPRX2受体能够识别的短肽类配体都具有φp9(X0-1) R/Kp10(X2) φp13(X2-3) φp16(X3) R/Kp20的通用motif,而对于MRGPRX1而言,其能够识别C端φB17(X1-2) R B20 φB21motif的短肽(图四)。
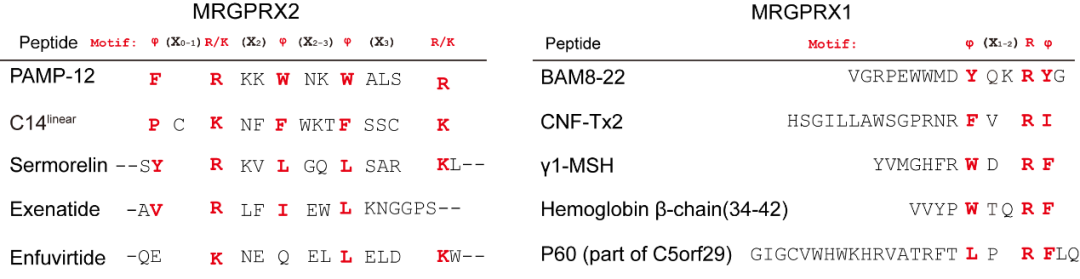
图4 MRGPRX1和MRGPRX2受体识别配体的通用motif
3. 揭示了MRGPRX1与不同G蛋白的结合模式
如前所述,MRGPRX1可以通过偶联Gi和Gq引起瘙痒。在本研究中,研究者通过比较MRGPRX1偶联Gi和Gq的结构发现,相较于Gi,Gq的α5-helix 更多地向 MRGPRX1 的 TM6 和 ICL3 倾斜。在α5-螺旋的 N 端,Gαq 的 Y358G.H5.23与MRGPRX1的Y642.42、F612.39和Y130ICL2形成疏水堆积。Gαq的E357G.H5.22不仅与MRGPRX1的 R131ICL2 形成了盐桥,还与Gαq的 Y358G.H5.23 和 MRGPRX1 的 Y130ICL2 一起构成极性网络(图五)。
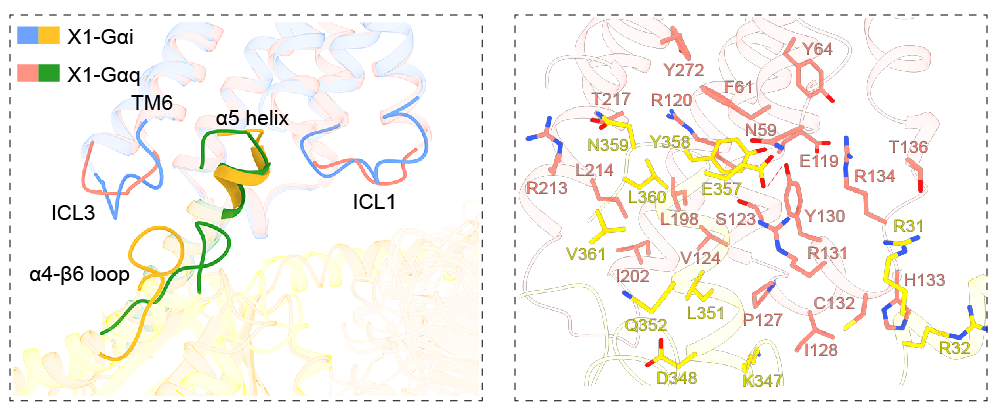
图5 MRGPRX1与不同G蛋白的结合模式
该研究深入阐述了痒觉受体识别不同配体的通用机制,揭示了痒觉受体MRGPR家族相似的可塑性显著的浅结合口袋,为后续靶向痒觉受体的药物开发提供了理论依据;同时这也是孙金鹏教授课题组与徐华强教授课题组在痒觉相关受体研究方向的系列工作(Nature. 2021 Dec;600(7887):164-169, Cell Res. 2023 Feb;33(2):184-187.)。
山东大学郭璐璐研究员,中科院上海药物所博士生章雨牧,北京大学医学部铁璐副教授,山东大学博士生方国兴、庄钰铭,南方科技大学博士生薛晨阳及山东大学刘琪博士,为本文的共同第一作者;孙金鹏教授、徐华强研究员、杨帆教授、刘忠明教授和周玖瑶教授为本论文共同通讯作者。
孙金鹏教授课题组长期聚焦于微环境药理学,系统性的研究了膜受体感知微环境并调控生理功能的机制,以通讯作者在 Nature(x6),Science(封面),Cell(封面),Cell Metab,Nat Chem Biol(x3),Cell Research(x2),PNAS(x6),Nat Commu(x7)等知名杂志发表90余篇,在膜受体对微环境感知和配体识别方面处于国际研究前沿。徐华强教授课题组长期在GPCR功能和信号转导的结构基础方面做前沿性的研究,以通讯作者已在Nature、Science、Cell等杂志发表论文30余篇,并获得专利几十余项。该项研究得到国家重点研发计划基金、国家杰出青年科学基金、自然基金委重点基金和山东省重点研发计划的支持。
原文链接:
https://www.nature.com/articles/s41467-023-40705-z.


