STTT:中药秦艽治疗类风湿性关节炎的关键作用机制被发现
时间:2023-08-26 20:43:13 热度:37.1℃ 作者:网络
类风湿关节炎是“世界五大疑难杂症”之一,病因尚未明了,医治难度很大,至今无法治愈。作为一种慢性疾病,类风湿关节炎会从手、腕、足的小关节开始发病,接着疼痛、肿胀和功能障碍逐渐游走于全身各个关节,不仅使人受尽苦痛和折磨,发展严重者还可能残疾甚至瘫痪。但可惜的是,目前药物治疗不仅起效慢、疗程长,而且患者容易产生耐药性。
与类风湿关节炎的斗争是一场“持久战”。但好消息是,近日,有科学家发现,用天然产物代替药物或许可以“打胜仗”。近日,来自四川大学华西医院的研究人员们在Nature出版集团旗下刊物《Signal Transduction and Targeted Therapy》发表了题为”Metabolic reprogramming of proinflammatory macrophages by target delivered roburic acid effectively ameliorates rheumatoid arthritis symptoms”的研究论文,首次发现了「栎樱酸」在类风湿关节炎治疗中的作用机制,开发了一个靶向递送系统,并揭示了一个有前景的关节炎靶点治疗信号通路ERK/HIF-1α/GLUT1。
类风湿关节炎(rheumatoidarthritis,RA)是一类以滑膜炎症和软骨破坏为特征的自身免疫性疾病。当前,多数患者对现有治疗RA的药物都具有耐药性。因此,研究者选取了天然产物来替代药物,想要寻求新的分子靶点。
龙胆科-秦艽是一种东南亚治疗类风湿性关节炎的草药,具有很强的生物活性。研究者从秦艽提取物中发现了栎樱酸(RBA),用来探究其改善RA的具体作用机制,发现与局部巨噬细胞亚群的改变有关。
巨噬细胞是一种高度多样化的吞噬细胞,具有重要的免疫功能。受到不同刺激后的巨噬细胞(M0)可以极化为经典的促炎性(M1)或免疫抑制性(M2)巨噬细胞。而通过靶向IL-10进行基因治疗,可以将M1巨噬细胞重编程为M2,来预防关节炎症和关节损伤。
事实上,巨噬细胞的极化和功能与其代谢模式密切相关。M1巨噬细胞利用糖酵解途径来满足促炎反应的高能量需求,而M2巨噬细胞主要是依靠脂肪酸氧化(FAO)和氧化磷酸化(OXPHOS)途径。在RA进展过程中,炎症关节中的巨噬细胞随着M1/M2的比率增加而转向高代谢糖酵解状态。
有研究发现,巨噬细胞可以通过改变其代谢模式来重新编程。因此,研究者探究了RBA操纵关节相关巨噬细胞亚群,使其重新平衡后改善RA症状的作用机制。
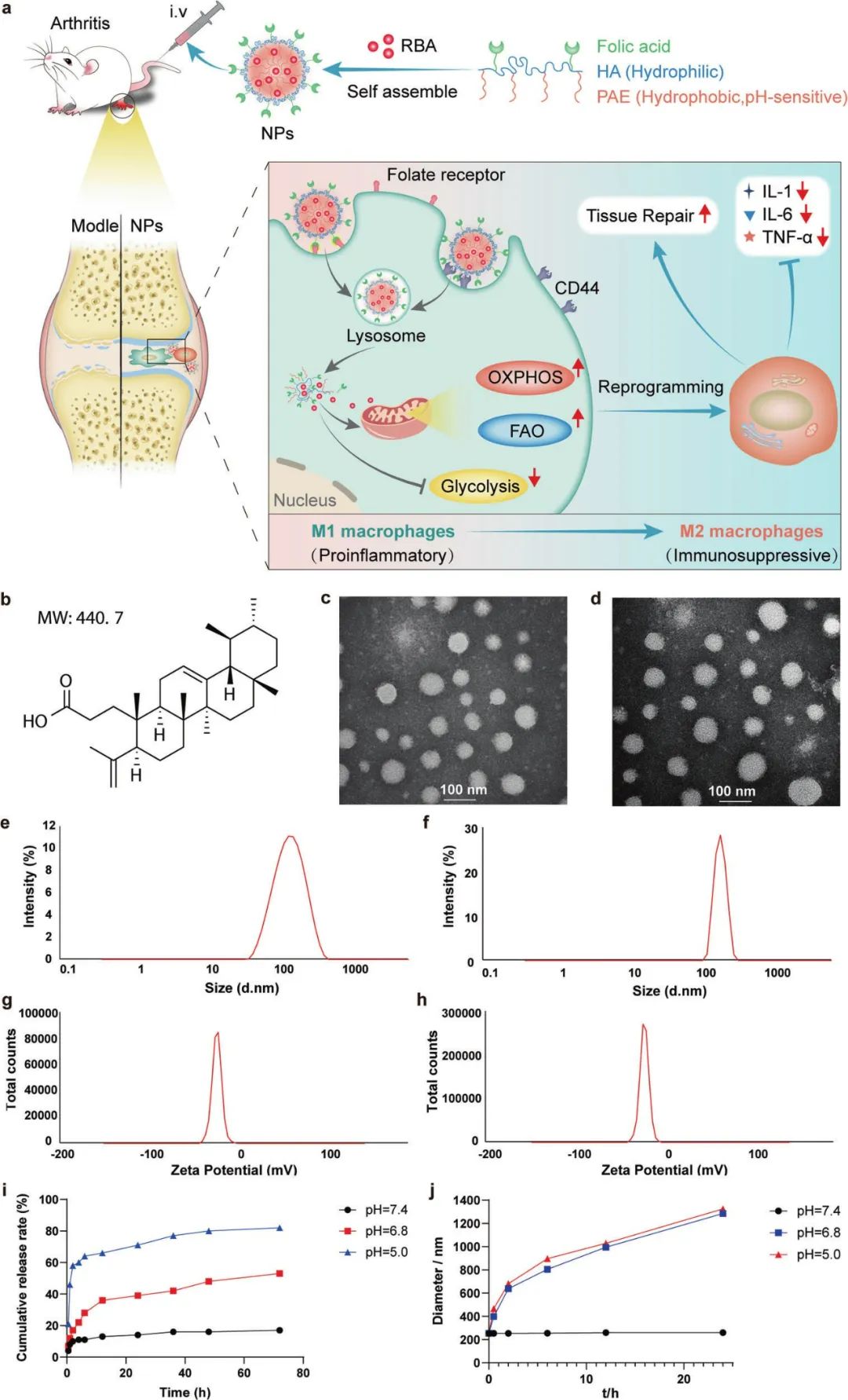
PAE-HA-FA(聚β-氨基酯-透明质酸-叶酸)共聚物主要通过迈克尔加聚反应和酰胺化反应合成。所制备的共聚物可以自组装成纳米胶束,用于靶向递送RBA。
研究者采用超声法制备了负载RBA的FA-HA-PAE纳米颗粒(RBA-NPs)和空白FA-HA-PAE纳米颗粒(NPs)用于透射电子显微镜(TEM)图像观察,并且建立了FA-HA-PAE和RBA体外分析方法,在体外测试了不同pH条件下聚合物胶束中RBA的累积释放速率以及空白胶束的粒径。
最后,成功生成了具有特定pH敏感性,负载RBA的纳米胶束。
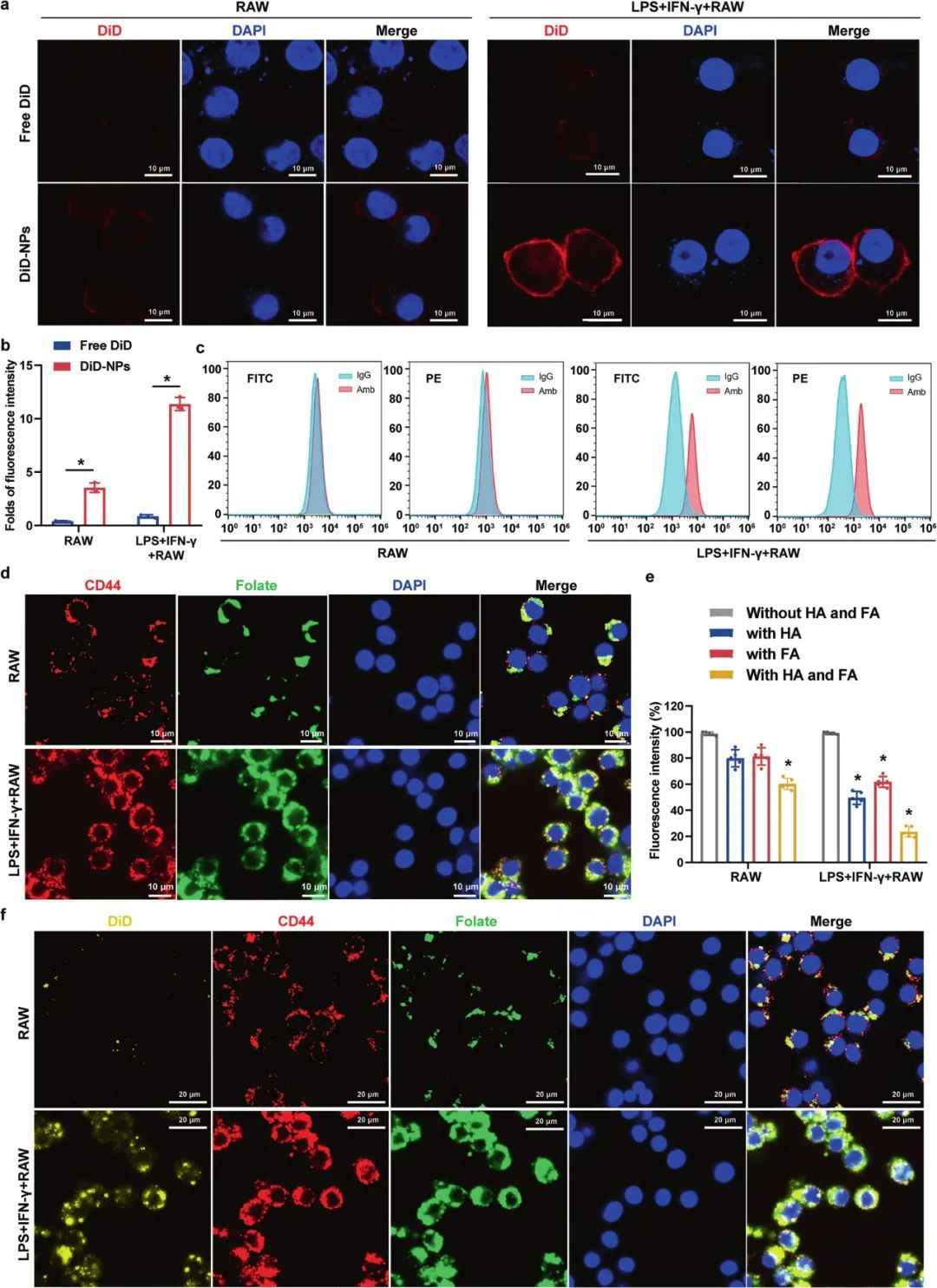
研究者利用1,1-双十八烷基-3,3,3,3-四甲基吲哚菁高氯酸盐(DiD)代替RBA(DiD-NPs)作为标记物,标记了细胞对纳米胶束的摄取和荧光在动物体内的定位。并通过CLSM(激光共聚焦扫描显微镜)和流式细胞术,评估细胞对游离DiD和DiD-NPs的摄取,验证了所制造纳米颗粒的CD44(跨膜糖蛋白)和叶酸受体的靶向依赖性。结果显示:DiD-NPs与CD44受体和叶酸受体共定位,表明DiD-NPs可以靶向促炎巨噬细胞表面的双重受体。
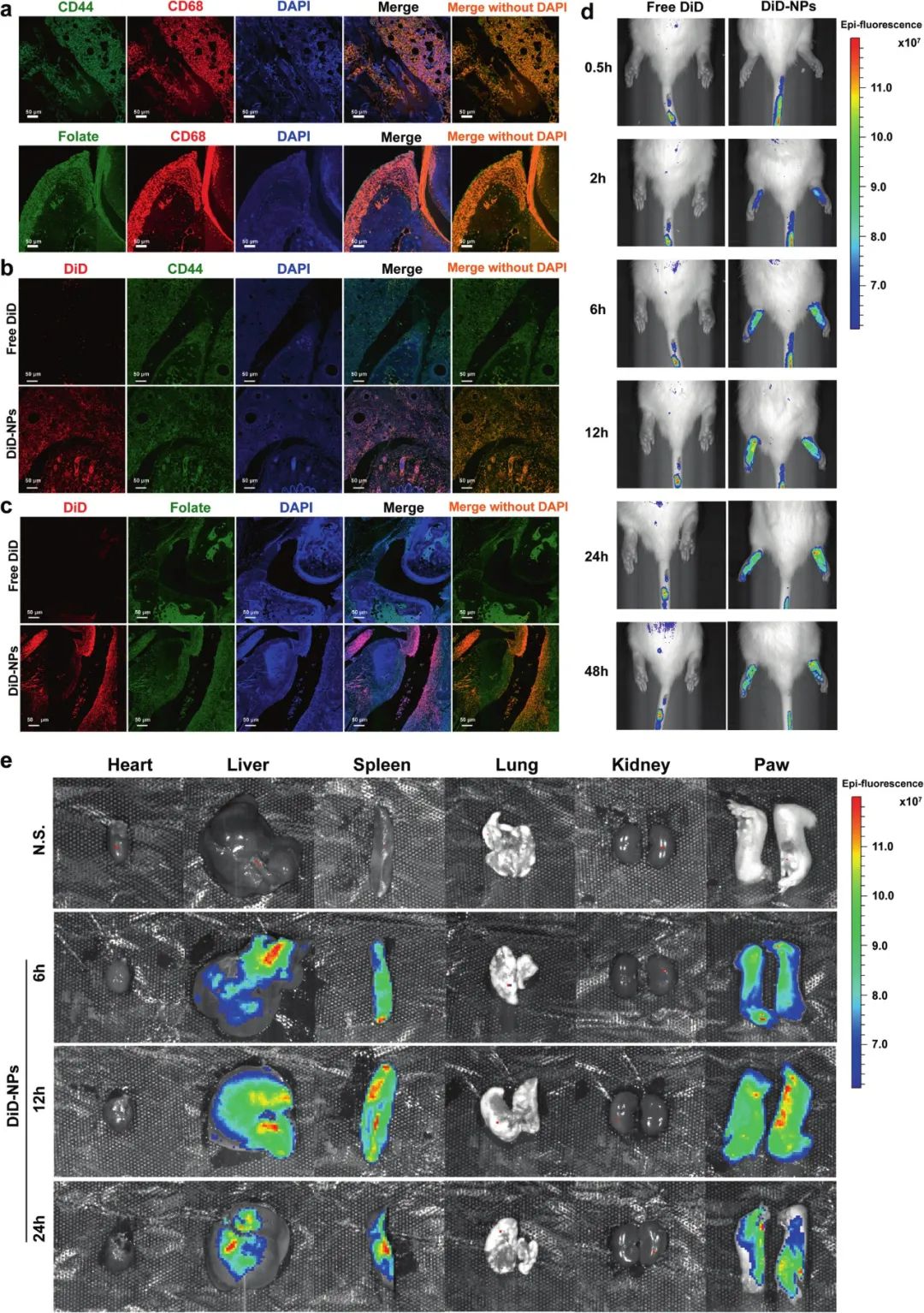
不仅如此,体内研究也与体外数据一致。研究者向大鼠尾底皮下注射CFA建立佐剂性关节炎(AIA)大鼠模型,探究NPs的生物分布。然后,通过尾静脉注射游离DiD或DiD-NP,将关节炎部位关节切片并进行免疫荧光检测。使用体内成像系统测量了给药后0.5、2、6、12、24和48小时的关节中DiD的荧光强度。最终发现,制备的双靶向NPs可以有效和选择性地将负载的物质传递给促炎巨噬细胞,并且能显著增强AIA大鼠关节炎症。
3. RBA-NPs抑制AIA大鼠炎症并促进骨侵蚀修复
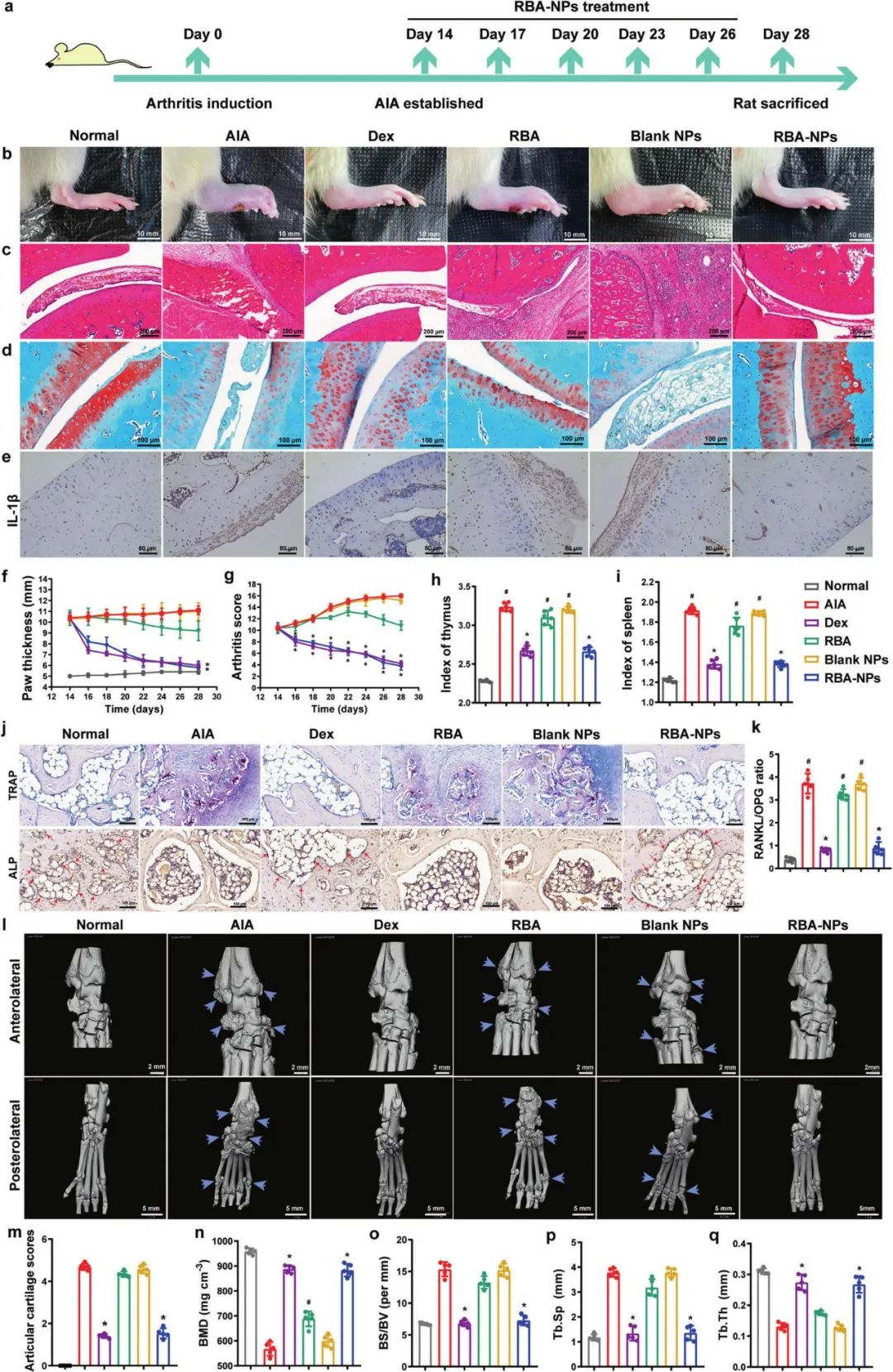
为了评估AIA大鼠中RBA-NPs的治疗效果,研究者选取了糖皮质激素药物地塞米松(Dex)作为阳性药物对照组进行实验。并且为进一步评估关节炎症和软骨破坏水平,研究者通过HE和番红固绿染色法对大鼠踝关节切片进行了组织学分析,计算其脾脏和胸腺指数以及检测了炎症细胞因子如IL-1β、IL-6和TNF-α的分泌情况。为了验证RBA-NPs是否可以恢复骨功能并促进组织修复,研究者通过TRAP(抗酒石酸酸性磷酸酶)和ALP(碱性磷酸酶)染色评估了RBA-NPs对相关标志物表达水平的影响。
结果表明,RBA-NPs和Dex均降低了大鼠关节炎中破骨细胞分化因子(RANKL)的表达水平,并上调了骨保护素(OPG)水平。最后,通过微型CT(微计算机断层扫描技术)分析以更可视化的方式进一步验证发现,RBA-NPs可以有效抑制AIA大鼠软骨损伤并促进骨侵蚀修复。
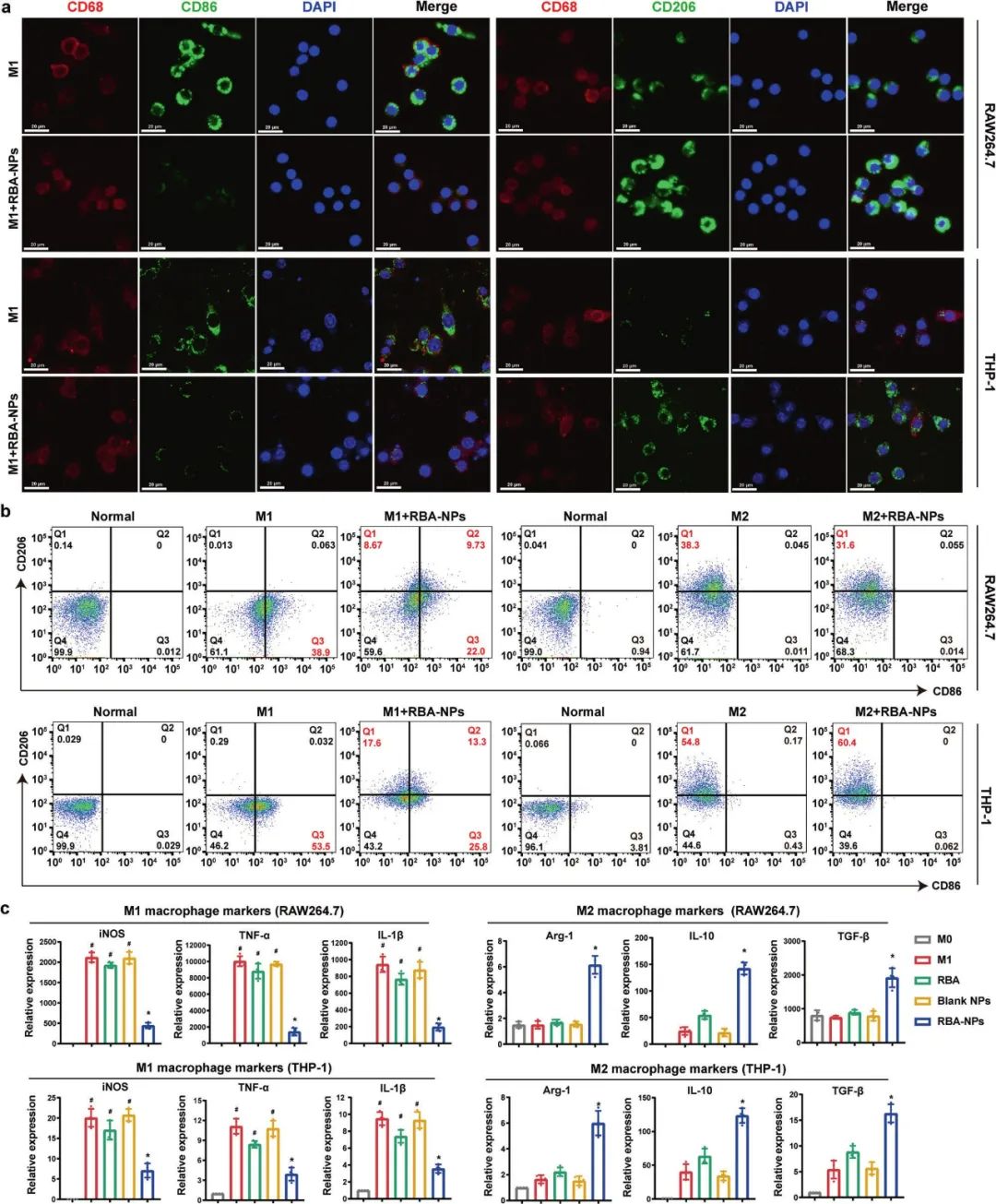
4. RBA-NPs将促炎M1巨噬细胞重编程为抗炎M2巨噬细胞
研究者选用了小鼠和人巨噬细胞系RAW264.7和THP-1细胞,并用LPS+IFN-γ或IL-4+IL-13预处理这些细胞,诱导M1或M2表型极化。然后,对这些细胞进行CD68和F4/80(巨噬细胞标记物)、CD86(M1标记物)和CD206(M2标记物)的免疫荧光染色。通过流式细胞术加以验证,发现RBA-NPs可以导致巨噬细胞从M1向M2表型转变。
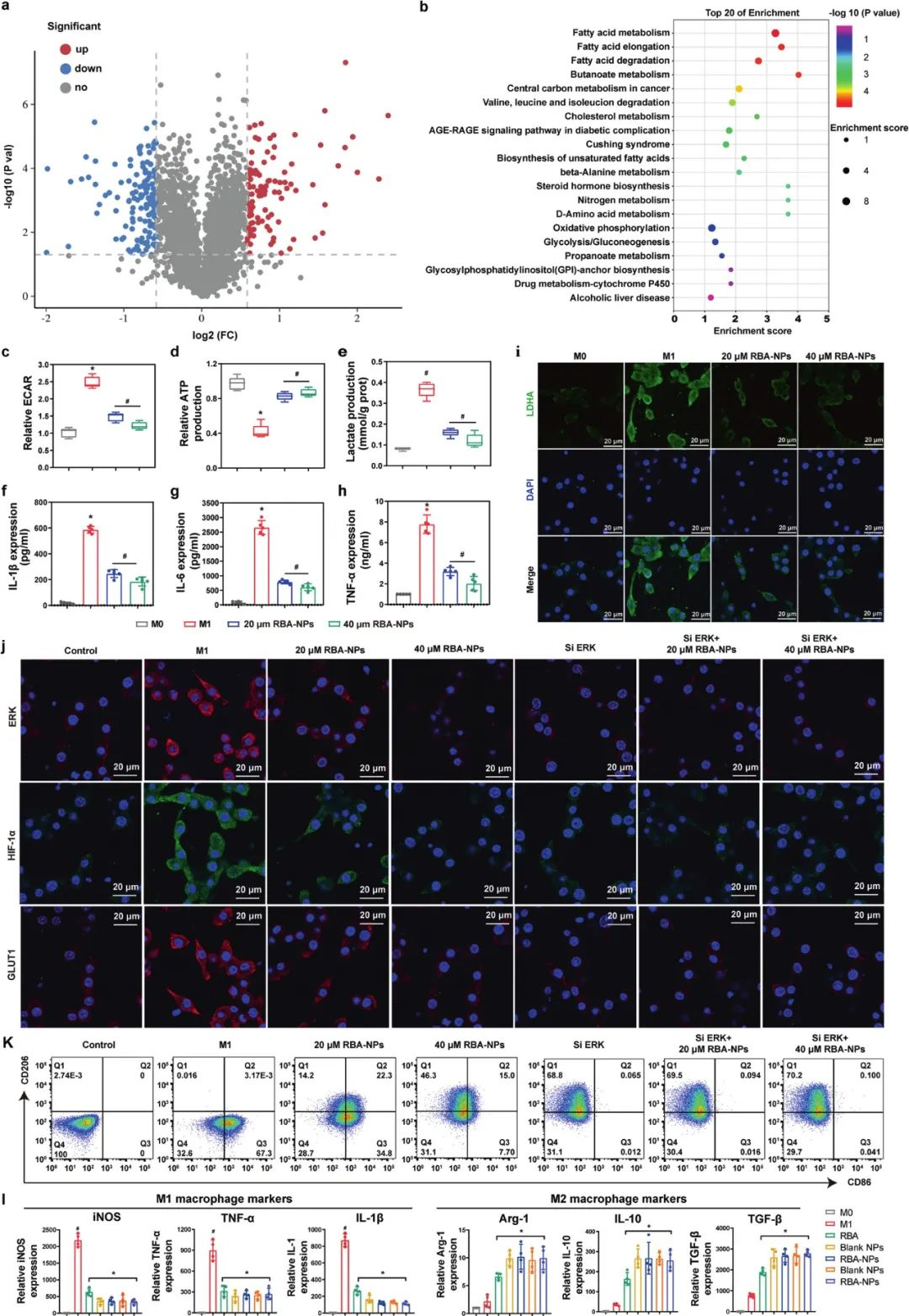
5. RBA-NPs通过下调糖酵解活性水平驱动M1到M2的表型转换
研究者通过蛋白质组学方法,探索了RBA-NPs巨噬细胞重编程的机制,在巨噬细胞中总共鉴定出了4068个蛋白质,其中RBA-NPs处理显著改变了235种蛋白质的表达水平。通过基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析方法,对这些蛋白的功能和相关代谢组学途径进行了分析。研究者使用STRING数据库构建蛋白质-蛋白质相互作用(PPI)网络来分析代谢相关蛋白质的功能关系,发现糖酵解是主要代谢模式。因此,通过糖酵解活性的指标-细胞外酸化率(ECAR)检测了M1巨噬细胞的糖酵解能力,以验证RBA-NP对细胞内能量代谢的调节。结果表明,RBA-NPs下调M1巨噬细胞的糖酵解水平,且剂量越高效果越强。
6. RBA-NPs通过阻断ERK/HIF-1α/GLUT1信号通路以驱动M1到M2的表型转换
研究者收集了RBA-NPs处理过和未处理的小鼠的M1巨噬细胞样本,并进行蛋白质组学分析。基于KEGG富集分析显示,HIF-1信号通路中的四类蛋白发生显著变化:葡萄糖转运蛋白1(GLUT1)、丝裂原激活蛋白激酶(MAPK)、FAD结合蛋白(Cyb)和真核起始因子4E2(EIF4E2)。然后,通过进一步的蛋白质表达水平检测和流式细胞术分析,发现RBA-NPs可能通过阻断ERK/HIF-1α/GLUT1通路来重新编程巨噬细胞极化。
RBA-NPs的生物安全性也在体内外进行了简要评估。体外选用RAW264.7和THP-1细胞在体外评估NPs的细胞毒性;体内对健康大鼠进行不同剂量的RBA-NPs治疗,并在规定时间后对这些大鼠的血液、尿液和重要器官取样,进行生化指标检测和组织切片染色分析。综合结果表明,RBA-NPs具有生物相容性,不会对重要器官造成急性损伤。
本研究构建了一种PH型双靶点药物递送系统(RBA-NPs),同时靶向CD44和叶酸受体,并对其药理机制进行了研究。在大鼠RA模型中,纳米载体有效地将RBA输送到炎症部位;与游离RBA相比,不仅显著提高了其治疗效果,还能显著降低炎症细胞因子水平,促进组织修复。
实验结果表明,关节中的促炎性M1巨噬细胞被RBA重编程为抗炎性M2表型,RBA在维持巨噬细胞平衡、免疫稳态和防止RA过度炎症中发挥了重要作用。此外,研究者发现,RBA-NPs通过阻断ERK/HIF-1α/GLUT1通路下调糖酵解水平,从而驱动M1到M2的表型转换。
因此,研究者们不仅开发了一个靶向递送系统,显著提高了RBA的抗RA效率,而且还发现了一个潜在的分子靶点,通过能量代谢调节对巨噬细胞进行反向重编程。
研究者构建了一种基于两亲性共聚物的RBA自组装纳米胶束(RBA-nps),并探究了其在RA治疗中的作用和机制。PH敏感型胶束可以通过活性双受体来靶向M1巨噬细胞。结果表明,RBA-NPs在RA模型大鼠中表现出良好的治疗效果,且具有良好的生物安全性。此外,RBA还可阻断HIF-1α介导的糖酵解途径,导致巨噬细胞M1到M2的表型重编程,从而减轻炎症,重塑关节组织。
本研究开发了一种基于RBA的有效RA治疗剂,首次发现了RBA在RA治疗中的作用机制,揭示了一个有前景的RA治疗靶点信号通路ERK/HIF-1α/GLUT1。
来源:https://www.nature.com/articles/s41392-023-01499-0