JCC:肠道微生物群产生的苯乙酰谷氨酰胺与克罗恩病有关,可能通过血小板活化加重结肠炎
时间:2023-09-02 13:59:18 热度:37.1℃ 作者:网络
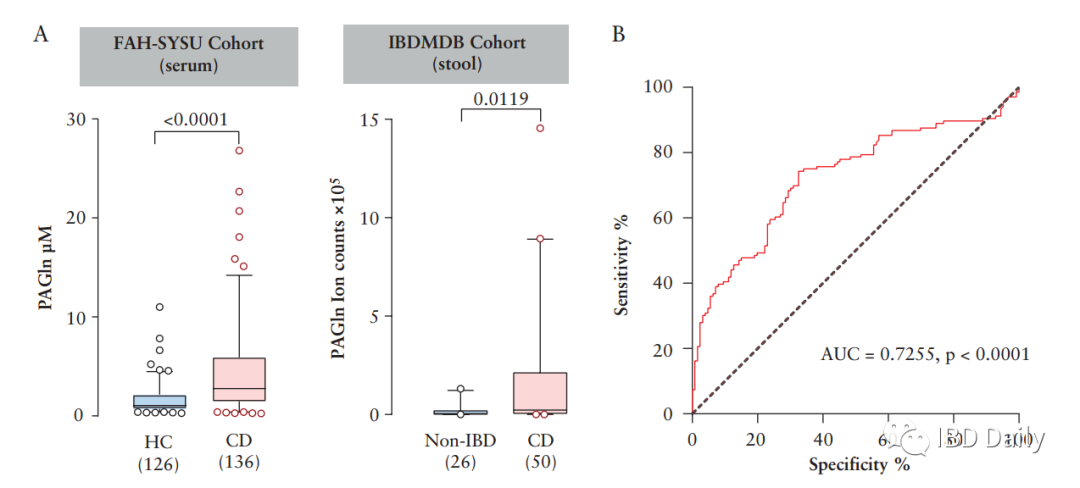
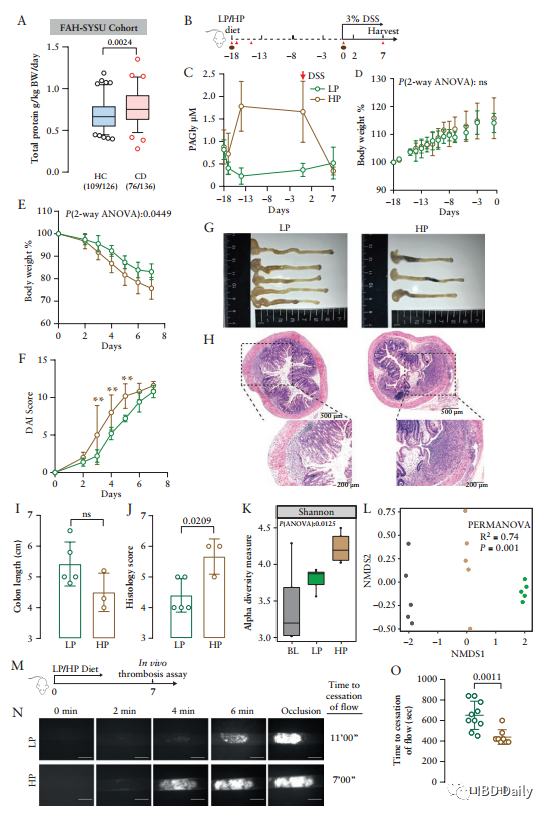
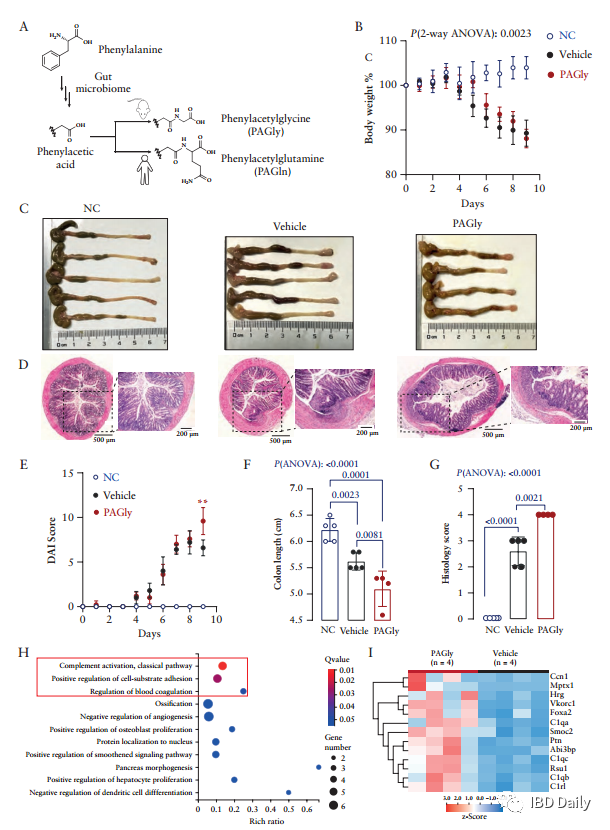
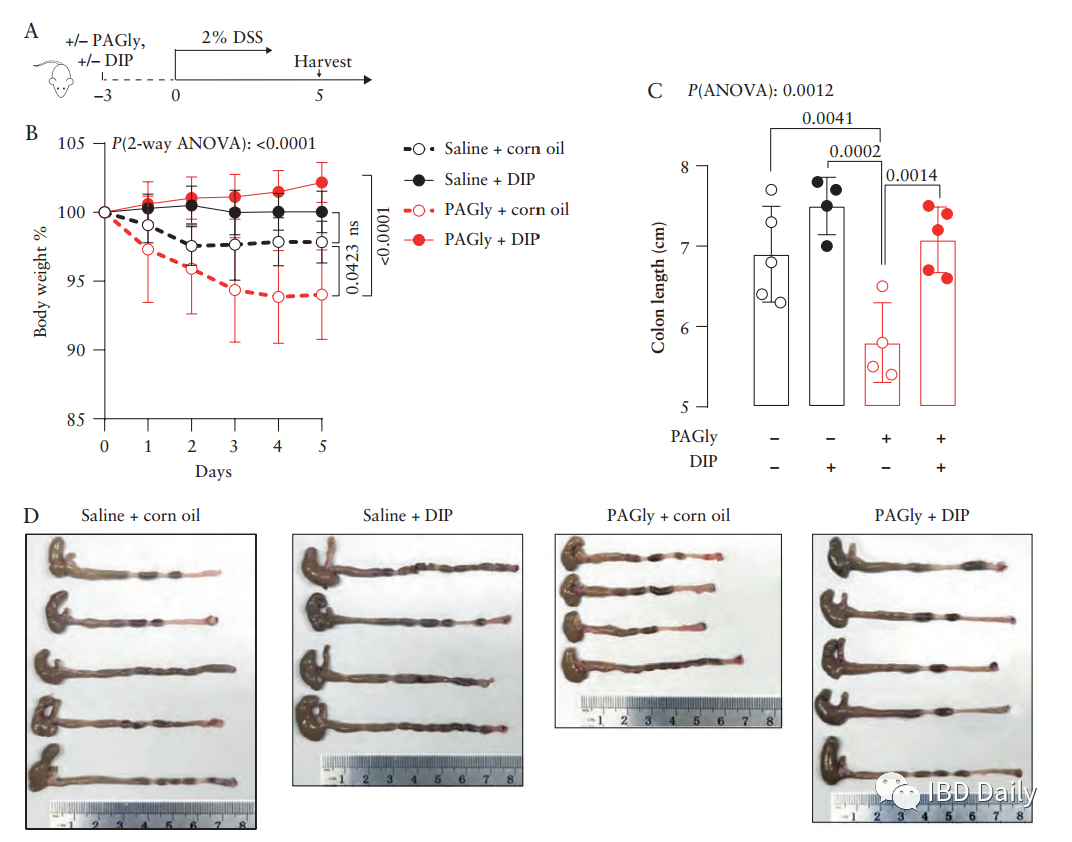
炎症性肠病 (IBD),包括溃疡性结肠炎 (UC) 和克罗恩病 (CD),是一种慢性胃肠道炎症。目前,全球已有超680万IBD患者,迫切需要先进的预防和治疗措施。研究表明,肠道微生物会与宿主的免疫反应相互作用,从而影响IBD的发展。但是现有研究大多针对已确诊的IBD患者,研究结果可能受到病程和疗法的影响,因此,本研究采用新发初诊的CD队列。此外,CD患者往往伴随血小板活化。尽管血小板与CD发病机制之间的关联尚不明确,但越来越多的研究表明,血小板可以充当有效的促炎细胞,抗血小板药物可能为IBD提供新的治疗方法。然而,CD患者中血小板活化的潜在机制仍不清楚。该研究发现,与健康个体相比,新发CD患者血清中的苯乙酰谷氨酰胺 (PAGln) 升高,而PAGln是一种促血栓代谢物,可使血小板活化,增大心血管疾病的风险。因此,研究人员假设PAGln促进了血小板介导的血栓形成和炎症反应,从而影响CD的发病机制。 研究纳入了136例成人 (≥18岁) 初诊CD患者和126例健康对照个体。使用食物频率调查问卷对饮食进行评估。并在治疗开始前收集受试者的血清和粪便样本。使用稳定同位素稀释液相色谱在线串联质谱 (LC-MS/MS) 对PAGln和苯乙酰甘氨酸进行定量测量。 结果 ①CD患者空腹血清中PAGln的水平升高:研究人员使用LC-MS/MS对PAGln进行靶向测量,发现与健康受试者相比,CD患者空腹血清中PAGln的水平较高。受试者工作特征 (ROC) 曲线分析表明,血清中的PAGln可能用于辨别CD患者。 图1:CD患者空腹血清中PAGln的水平升高。(A) CD患者PAGln的水平高于健康对照组和非IBD患者。(B) 对PAGln进行预测的结果显示,曲线下的面积 (AUC) 为0.7255 (p<0.0001)。 图源:参考文献[1] ②高蛋白饮食与CD相关,会导致小鼠模型中血浆苯乙酰甘氨酸 (PAGly) 的水平升高、结肠炎和血栓形成的风险增加:由于PAGln源自膳食中的苯丙氨酸,研究人员尝试研究蛋白质摄入量与血清PAGln水平之间的关联。使用食物频率调查问卷对受试者的饮食进行评估,发现CD患者饮食中蛋白质摄入量明显较高。据此,研究人员假设:膳食中蛋白质摄入量升高会导致血清中PAGln的水平升高。为检验假设,研究人员将小鼠分组,分别接受低蛋白或高蛋白饮食18天。在指定时间点收集血液和粪便。高蛋白饮食小鼠血浆中的PAGly显著增加。与高蛋白饮食不同,直接给予L-苯丙氨酸不会升高血浆中PAGly的水平。为了研究膳食蛋白质水平对急性结肠炎的影响,研究人员让小鼠保持高蛋白饮食并接受3% DSS处理,发现高蛋白饮食显著影响多项疾病指标,造成体重减轻、生存率降低、疾病评分升高、结肠长度缩短和隐窝破坏。此外,研究人员还发现低蛋白饮食和高蛋白饮食的小鼠体内的微生物群组成发生显著变化。研究人员使用颈动脉损伤模型测量了低蛋白饮食和高蛋白饮食小鼠体内血栓形成的风险,结果表明,与低蛋白饮食组相比,高蛋白饮食的小鼠颈动脉血栓形成的速度加快,受伤后血管闭塞时间缩短。 图2:富含蛋白质的饮食与CD相关,并会加剧小鼠结肠炎。(A) 与队列中的健康对照 (n=109) 相比,CD患者 (n=76) 的蛋白质摄入量较高。(B) 实验设计、时间线和采样策略的示意图。红色三角,采血。棕色椭圆形,粪便。在用3% DSS治疗之前,小鼠接受低蛋白或高蛋白饮食18天。(C) 接受高蛋白饮食的小鼠血浆中PAGly升高。红色箭头表示DSS作用的开始。(D,E) 在 (D) DSS治疗之前和 (E) DSS治疗之后跟踪体重。(F) 疾病评分。(G) 不同饮食下小鼠结肠形态。高蛋白组的两只小鼠在实验过程中死亡。(H) 在第7天终止实验时具有代表性的H&E染色结肠切片。(I) 小鼠的结肠长度。(J) 疾病严重程度的组织学评估。(K,L) 饮食引起的粪便微生物群的改变。 图源:参考文献[1] ③PAGly上调凝血相关基因的表达并加重小鼠结肠炎:肠道微生物产生的苯乙酸在人体中主要代谢为PAGln,而在小鼠中主要代谢为PAGly。研究人员将生理盐水或PAGly注射到小鼠体内,测定PAGly是否会加剧结肠炎。跟踪记录小鼠的体重和存活率。研究发现,PAGly加剧了DSS诱导的结肠炎。研究人员使用RNA-seq评估了注射PAGly或生理盐水的小鼠体内结肠基因表达图谱,并在两组样本之间发现了350个差异表达基因 (DEG),进一步研究证实,PAGly组的小鼠体内三个凝血相关的生物学过程的增强。结果表明,小鼠结肠炎的恶化可能是PAGly诱导的凝血增强所致。随后,研究人员评估了抗血小板药物能否减弱PAGly导致的结肠炎。实验发现,与生理盐水相比,PAGly加重了结肠炎;但与接受PAGly的小鼠相比,双嘧达莫治疗的小鼠体重升高,结肠长度增长。 图3:PAGly会加重小鼠模型的结肠炎并上调凝血相关基因表达。(A) PAGly和PAGln产生的示意图。(B) 小鼠用DSS处理9天,并跟踪体重。(C) 不同处理下小鼠结肠形态。(D) 第9天终止实验时代表性的H&E染色结肠切片。(E) 实验期间的疾病活动评分。(F) 小鼠的结肠长度。(G) 疾病严重程度的组织学评估。(H)基因本体论 (GO) 对上调基因的分析表明,三个富集的生物过程与凝血相关。(I) 前三个富集的生物过程中13个差异表达基因的表达值热图。 图源:参考文献[1] 图4:双嘧达莫可减轻PAGly增强的结肠炎。(A)实验设计示意图。(B)给药后追踪体重。(C)小鼠的结肠长度。(D)不同处理下小鼠的结肠形态。 图源:参考文献[1] ④PAGln促进血小板的活化和CD40L的表达:血小板计数 (PLT) 升高和平均血小板体积 (MPV) 降低是IBD的标志。研究人员在实验队列中观察到:与健康受试者相比,CD患者的PLT显著升高,而MPV显著降低。最新研究表明,血小板与免疫反应相关。由于CD62P (P-选择素) 是血小板活化标志物,CD40/CD40L复合体与CD息息相关,而可溶性CD40L主要来源于血小板,因此研究人员对P-选择素和CD40L的表达进行了检测。从健康受试者中分离出富含血小板的血浆 (PRP),并将其与PAGln或载体 (ddH2O) 共同孵育,随后使用激活剂二磷酸腺苷 (ADP) 或凝血酶进行诱导。结果表明:PAGln可使ADP和凝血酶诱导的P-选择素和CD40L的表达增加,推测PAGln可能通过直接调节血小板的功能影响CD。 图5:CD与血小板异常有关,PAGln可增强血小板活化。(A) CD患者和健康对照组的血小板计数(左)和平均血小板体积(右)的比较。(B) ADP和凝血酶诱导的血小板活化的流式细胞仪图谱。(C) ADP和凝血酶诱导的P-选择素表达的变化。ADP,左侧。凝血酶,右侧。(D) 用ELISA法测定CD40L水平。 图源:参考文献[1] ⑤PPDC介导的苯乙酸生成途径是CD患者体内PAGln升高的主要原因:肠道微生物首先代谢苯丙氨酸形成苯乙酸,苯乙酸再形成PAGln。目前揭示了两条产生苯乙酸的途径,并鉴定了两种关键酶,即苯丙酮酸脱羧酶 (PPDC) 和苯丙酮酸:铁氧还蛋白氧化还原酶 (PPFOR)。数据分析发现,PPFOR在HC组更丰富;而PPDC在CD组的丰度显著增加。在公开可用的IBDMDB人类粪便元基因组和代谢组学数据库中,研究人员发现PPDC与较高水平的PAGln相关。综上可知,PPDC介导的苯乙酸产生是CD患者PAGln升高的主要原因。 图6:PPDC介导的苯乙酸生成途径与CD患者体内PAGln升高相关。(A) 确定了分别PPDC和PPFOR介导的人肠道细菌将苯丙氨酸转化为苯乙酸的生物合成途径。(B) CD患者和健康受试者体内PPDC和PPFOR丰度。(C) CD患者粪便样本中的PPDC高于健康受试者。 图源:参考文献[1] ⑥携带PPDC的变形菌门是CD患者体内苯乙酸的主要生产者:研究人员通过调查肠道微生物群功能和结构的联系来扩展研究。发现PPDC同源物主要分布在兼性厌氧菌中,包括变形菌门、放线菌门,厚壁菌门的葡萄球菌,而PPFOR同源物主要分布在拟杆菌门的专性厌氧菌和厚壁菌门。宏基因组测序结果表明,CD与变形菌门和梭杆菌门的增加相关,同时伴有厚壁菌门和疣微菌门的减少。CD患者粪便中变形菌门富集,而变形菌门携带PPDC,表明携带PPDC的变形菌门是CD患者体内苯乙酸的主要生产者。 图7:PPDC在人类变形菌中广泛分布和表达。(A) 人类微生物群中PPDC和PPFOR同源物的系统分布。黄色和绿色分支分别表示携带PPDC和PPFOR同源物的分离株。(B) PPDC主要在IBD MDB队列中的变形菌门。(C) PPDC丰度与粪便细菌分类群的相关性。 图源:参考文献[1] 总之,从新发初治队列中,研究人员发现肠道微生物组的代谢物PAGln与CD高度相关,并可能通过血小板活化加剧小鼠模型的结肠炎。因此,PAGln是CD的潜在早期诊断靶点。结合饮食特征、宏基因组学和细菌培养,研究人员发现高蛋白质饮食和携带PPDC的变形菌门会导致CD患者体内PAGln水平升高。膳食蛋白质、肠道微生物群和结肠炎之间的联系可能利于开发新的治疗策略。 通讯作者: 陈旻湖,教授、主任医师,现就职于中山大学附属第一医院消化内科,消化内科首席专家、学科带头人,国务院特殊津贴专家,从事消化内科临床工作30多年。兼任中华医学会消化病学分会主任委员、中国医师协会消化医师分会副会长、第九届亚洲炎症性肠病协会主席、中华消化杂志副总编辑、中华炎性肠病杂志副总编辑、Journal of Digestive Disease共同主编。对消化系统疾病的诊断与治疗有丰富的临床经验。擅长炎症性肠病的诊断与治疗。主持包括国家自然科学基金重点项目等多项科研课题,发表研究文章500多篇,其中SCI收录文章300多篇。主编出版学术著作10多部。曾获教育部自然科学奖一等奖、教育部科技进步奖二等奖及丁颖科技奖等多项科研成果奖。 朱亦君,副研究员,硕士生导师。现就职于中山大学附属第一医院精准医学研究院,中山大学“百人计划”引进人才。美国克利夫兰诊所博士后,英国华威大学博士。主要研究方向为肠道微生物代谢与炎症性肠病 (IBD) 发生和发展的关系。研究工作发表于Cell Host&Microbe,PNAS,JCC等期刊杂志。 参考文献 Feng R, Tian Z, Mao R, et al. Gut microbiome generated phenylacetylglutamine from dietary protein is associated with Crohn's Disease and exacerbates colitis in mouse model possibly via platelet activation [published online ahead of print, 2023 Jun 23]. J Crohns Colitis. 2023;jjad098. doi:10.1093/ecco-jcc/jjad098