【AJH】克拉屈滨、伊达比星和阿糖胞苷±索拉非尼初始治疗AML的II期研究
时间:2023-09-05 22:05:15 热度:37.1℃ 作者:网络
CLIA方案治疗初治AML
阿糖胞苷和蒽环类药物的强化化疗已成为新诊断的年轻和fit急性髓性白血病(AML)患者缓解诱导的主要方案,7+3方案成为广泛使用的标准方案。为进一步优化治疗和改善结局,多年来进一步对该模式进行改良,包括蒽环类药物的剂量强化、替代蒽环类药物及诱导期间阿糖胞苷的剂量强化。事实上有研究表明,与标准剂量的阿糖胞苷相比,诱导过程中较高剂量的阿糖胞苷可以产生更高的缓解率和生存率,且在新诊断较年轻AML患者中效果最为明显。
在阿糖胞苷和蒽环类药物两药中纳入第三种药物,包括额外的化疗或靶向药物,也已探索以改善结果,包括克拉屈滨、氯法拉滨(clofarabine)和氟达拉滨的加入对新诊断的AML患者均产生了令人鼓舞的结果。在强化化疗的基础上增加小分子靶向药物(索拉非尼)也被研究,证实可显著改善新诊断AML患者的无事件生存期(EFS)、无复发生存期(RFS)和总生存期(OS)。此外一项I/II期研究评估了索拉非尼与伊达比星和大剂量阿糖胞苷联合治疗新诊断AML,CR率为75%和1年OS率为74%;尤其是FLT3-ITD突变患者的CR率为92%。
基于这些结果可以假设,对于新诊断年轻AML患者,与历史经验和7+3方案相比,克拉屈滨、伊达比星和大剂量阿糖胞苷(CLIA)方案将产生更高的持久完全缓解率,并转化为更高的生存率,而在FLT3- ITD突变AML患者中可将索拉非尼作为FLT3抑制剂添加到CLIA基础方案。近日《American Journal of Hematology》报告了一项CLIA联合或不联合索拉非尼作为新诊断、年轻、fit AML患者的诱导和巩固治疗的II期研究结果。

研究方法
该研究为MD安德森癌症中心开展的单臂、开放标签、前瞻性2期研究。纳入年龄≤65岁、ECOG体能状态≤2且器官功能充足的患者,入组三组患者:(A)未经治疗的新诊断AML患者[初治一线AML],(B)经治MDS转化的AML患者[治疗继发性AML (ts-AML)], (C)复发/难治性AML患者[(R/R) AML]。本文包括前两组患者的结果。一线队列包括既往未接受过白血病治疗的AML患者;ts-AML队列包括有骨髓增生异常综合征(MDS)或骨髓增生异常(MPN)病史的患者且接受过MDS或MPN治疗(但未接受AML治疗)。
患者按顺序入组,没有随机分组。治疗包括诱导阶段,然后是最多5个周期巩固 (计划共6个周期)。诱导方案为:第1-5天静脉IV克拉屈滨5mg/m2,持续30分钟,随后(3-6小时后)IV阿糖胞苷1000mg/m2,持续3-4小时(第1-5天);第1-3天IV伊达比星10mg/m2,持续30分钟。达到CR/CRi的患者进入巩固期。巩固包括最多5个周期,克拉屈滨5mg/m2 IV,第1-3天,阿糖胞苷750 mg/m2 IV,第1-2天,伊达比星8mg/m2 IV。4周/周期,最多允许两个周期的诱导。携带FLT3-ITD突变的AML患者在诱导期间接受400mg的索拉非尼口服,每天两次,持续14天,然后在巩固期连续给药。
主要终点为ORR,次要终点为OS、RFS、毒性和诱导死亡率。
研究结果
患者
共入组80例新诊断AML患者,中位年龄为55岁。基线患者特征总结于表1。65例患者(81%)为初治AML, 15例患者(19%)经治髓系肿瘤引起的新诊断AML(ts-AML)。ts-AML患者相对于初治一线AML患者,年龄较大(中位58岁vs. 54岁;P=0.02)、骨髓原始细胞较低(32% vs. 54%;P=0.02)、不良核型更高(80% vs. 22%;p<0.001)。初治新诊断患者中最常见的AML相关基因突变包括FLT3-ITD(35%)、NPM1(28%)、RAS(25%)、DNMT3a(20%)和IDH2(18%)。ts-AML患者中最常见的突变基因为RAS(33%)、TP53(33%)、FLT3-ITD(33%)、RUNX1、TET2、EZH2和WT1(各27%)。
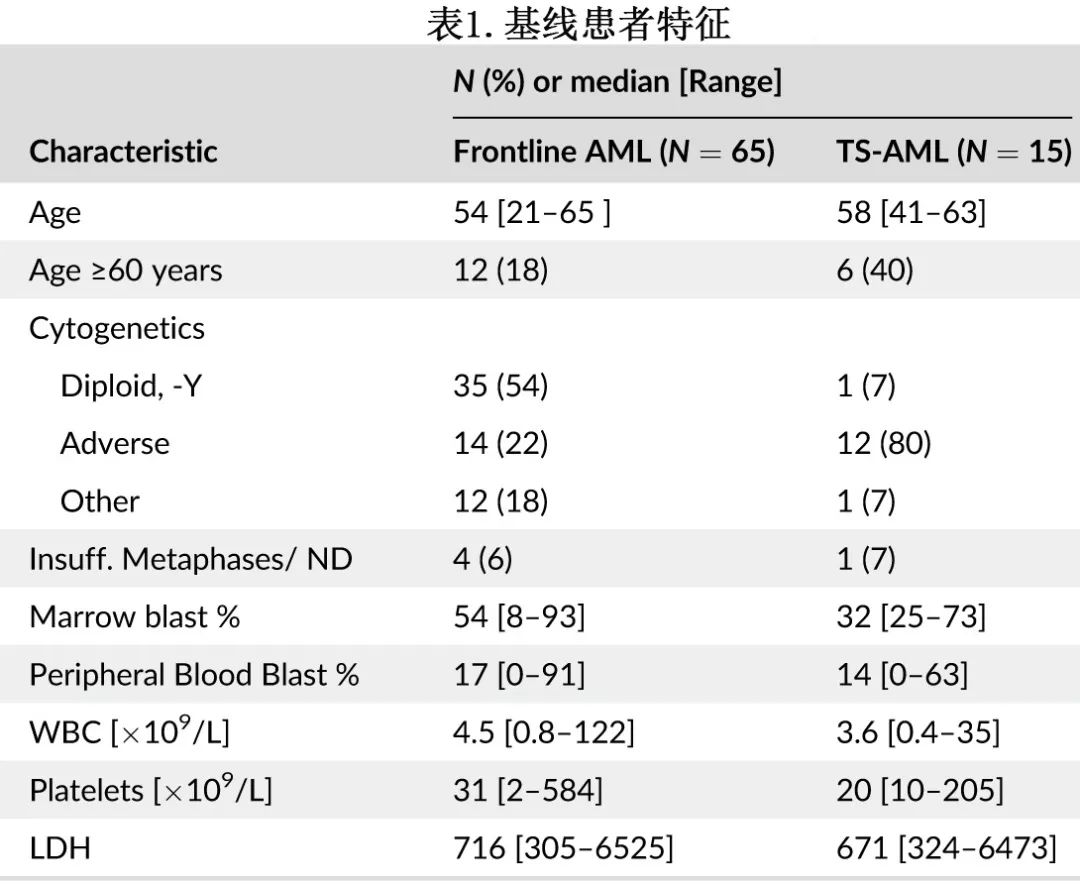
缓解
53例(66%)患者接受CLIA治疗,27例(34%)患者接受CLIA +索拉非尼治疗FLT3突变AML。表2总结了按队列和治疗分组的缓解率和早期死亡率。
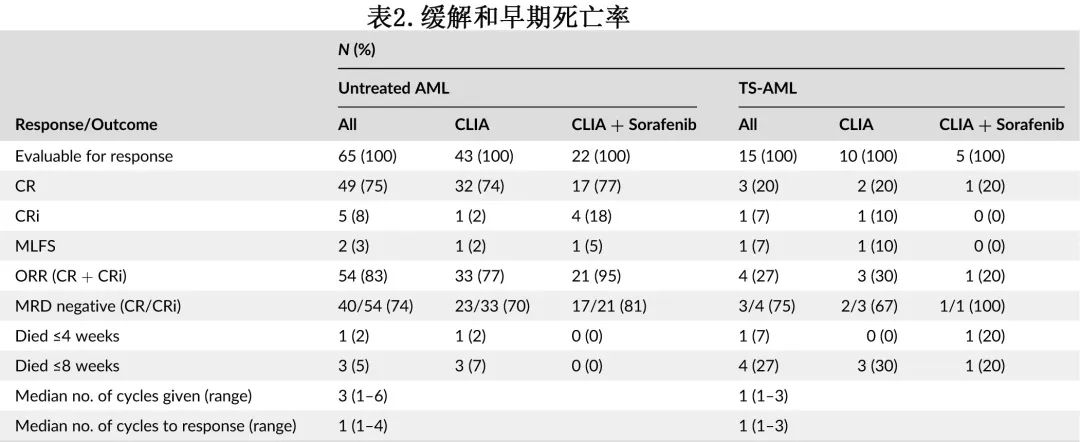
在初治组和ts-AML组,患者的治疗中位数分别为3个周期和1个周期。至缓解周期的中位数为1个。初治新诊断AML患者中49例(75%)达到完全缓解(CR)、5例(8%)达到CRi,CR/CRi率为83%。ts-AML队列患者中3例(20%)达到CR,1例(7%)达到CRi,CR/CRi率为27%。在一线和ts-AML组中,分别有74%和75%的缓解患者的流式细胞术检测到MRD阴性CR/CRi。在达到CR/CRi的患者中,总体上没有达到中位缓解持续时间;一线和ts-AML组的2年持续缓解率分别为77%和75%。
FLT3-ITD突变AML患者除1例外,其余均接受CLIA+索拉非尼治疗(N=27;初治组22例,ts-AML组5例)。在接受CLIA+索拉非尼治疗的22例初治新诊断AML患者中,17例(77%)达到CR,4例(18%)达到CRi,ORR为95%;81%的患者MRD呈阴性缓解。在CLIA+索拉非尼治疗的5例ts-AML患者中,只有1例达到CR(20%)。在对CLIA +索拉非尼有反应的患者中,2年持续CR率为96%。
治疗前基因组数据可用,包括细胞遗传学和二代分子学测序,从而可以在特定亚组中对反应进行探索性分析。由于ts-AML患者先前接受过去甲基化药物(HMA)治疗MDS是影响反应率和结局的独立因素,因此分别对两个基因组的反应进行了检查。初治AML队列伴NMP1突变AML (N=18)、RAS突变AML (N=16)和FLT3-ITD突变 (N=23) AML患者的ORR为100%,相应的CR率分别为94%、81%和78%。AML伴二倍体、高危或中危核型患者的ORR/CR率为89%/83%、71% / 64%和92%/67%。
在61例达到CR、CRi或骨髓无白血病状态(MLFS)的患者中,36例(59%)在首次缓解(CR1)时继续接受异基因SCT,其中包括33例(59%)初治AML患者和3例(60%)ts-AML患者。23例接受CLIA +索拉非尼治疗的患者中有18名(78%)在CR1接受了异基因SCT。
生存和复发
中位随访76个月,所有患者的中位OS为20.1个月,1年、2年和5年OS率分别为63%、49%和43%(图1A)。初治AML患者的中位OS为62.3个月,而ts-AML患者的中位OS为4个月(p=0.002;图1B);初治AML的1年、2年和4年OS率分别为71%、57%和50%,而ts-AML为27%、20%和13%。MRD阴性(流式细胞术)伴CR患者的中位生存期明显优于MRD阳性伴CR患者(中位生存期未达到[NR] vs. 10.3个月,p=0.004;图1C)。在缓解期接受异基因SCT与CR1期未接受异基因SCT的患者相比OS有所改善(中位OS NR vs. 33.4个月,p=0.41)。CLIA +索拉非尼治疗的患者的中位OS为NR, 1、2和5年OS率分别为78%、63%和59%(图1D)。
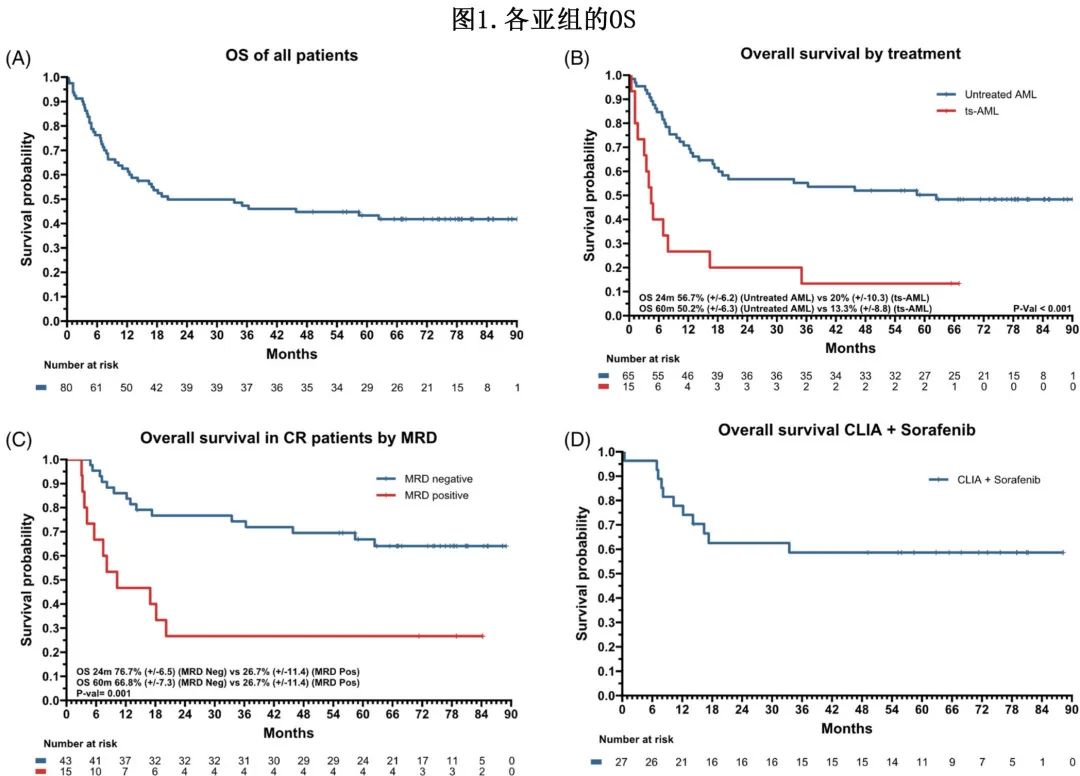
在应答患者中,2年和5年累积复发发生率(CIR)分别为21%和25%,而无复发的累积死亡率(cumulative incidence of death,CID)分别为23%和26%。MRD阳性患者的2年和5年的CIR和CID (CIR分别为40%和40%;CID分别为33%和33%)高于MRD阴性缓解患者(CIR分别为14%和19%;CID分别为19%和24%)。
历史经验
在应用CLIA作为一线方案之前,作者曾评估依达比星+高剂量连续输注阿糖胞苷的联合治疗[IA;N=168]和后来的IA+索拉非尼[N=75]用于治疗较年轻、fit、新诊断AML患者。考虑到在不同研究之间进行比较的潜在偏差和潜在的不平衡人群,因此使用先前的高剂量阿糖胞苷诱导的经验来评估添加克拉屈滨作为CLIA方案的一部分的价值。与IA相比,添加克拉屈滨(CLIA)与OS显著改善相关:中位20.1个月vs 12.3个月(p=0.02);1年和4年OS率分别为63%和45%对比51%和28%。与IA+索拉非尼治疗的患者相比,CLIA+索拉非尼同样与OS的显著改善相关:中位NR vs 23个月(p=0.04), 1年和4年OS分别为78%和59%对比66%和36%。
安全性
在新诊断AML患者中CLIA方案具有良好的耐受性和可接受的毒性。在整个人群中,4周时有2例死亡(2.5%),8周时有7例死亡(9%)。在前4周内,初治AML和ts-AML各有1例患者死亡;在接下来的4周内,ts-AML队列中有3例死亡,初治AML队列中有2例死亡,没有死亡患者在治疗中达到CR/CRi。表2进一步总结了不同队列和治疗方式的早期死亡率。有16例患者在缓解期死亡,其中11例(69%)是由于接受异基因SCT后感染并发症导致的移植相关死亡;其余5例未接受SCT的患者中,4人死于感染并发症,1人死于尿路上皮癌进展。
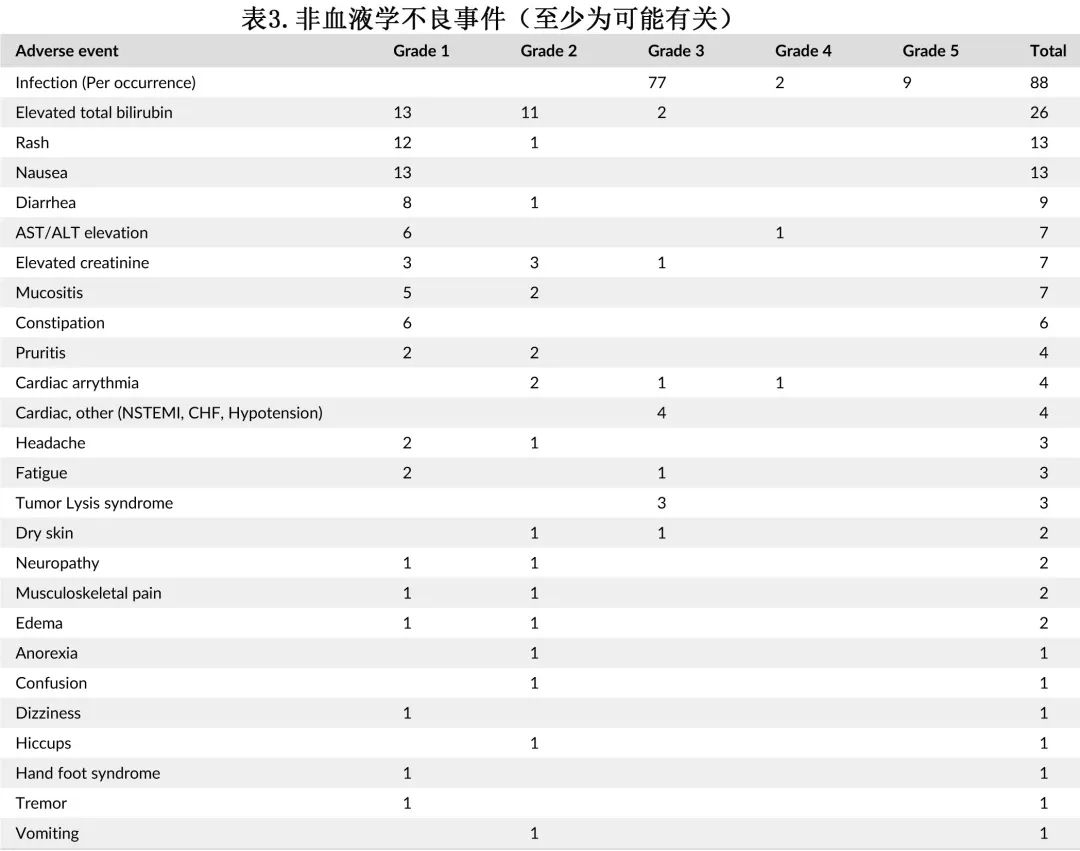
表3总结了最常见的非血液学不良事件(至少可能与研究治疗有关)。大多数为1级或2级,具有自限性,并在支持治疗后消退。最常见的非血液学不良事件包括感染/发热(88例)、胆红素升高(26例)、皮疹(13例)、恶心(13例)、腹泻(9例)、肝转氨酶升高(7例)、肌酐升高(7例)和粘膜炎(7例)。最常见的≥3级不良事件包括感染(88例)、心脏事件(包括非st段抬高型心肌梗死、心力衰竭、低血压,4例)、肿瘤溶解综合征(3例)、胆红素升高(2例)和心律失常(2例)。
总结
该II期研究研究入组80例患者,其中65例为初治的新诊断AML, 15例为经治MDS引起的AML (ts-AML)。中位年龄为55岁。初治组和ts-AML组的CR+CRi分别为83%(54/65)和27%;患者中分别有74%和75%的患者达到MRD阴性。在接受CLIA+索拉非尼治疗的FLT3-ITD突变AML患者中,CR+CRi率为95%,MRD阴性率为81%。中位随访76个月,初治的新诊断AML患者2年和4年OS分别为57%和50%,而ts-AML分别为20%和13%。CLIA+索拉非尼治疗的患者2年和5年OS率分别为63%和59%。4周诱导死亡率为2.5%。最常见的≥3级不良事件包括感染/发热、胆红素升高、皮疹和恶心。
CLIA方案在年轻、fit新诊断AML患者中安全有效,而在ts-AML患者中预后较差,此外在FLT3-ITD突变AML的CLIA中添加索拉非尼可带来较高持久缓解率和良好的长期生存。
参考文献
Kadia TM, et al. Phase II study of cladribine, idarubicin, and ara-C (CLIA) with or without sorafenib as initial therapy for patients with acute myeloid leukemia.Am J Hematol . 2023 Aug 27. doi: 10.1002/ajh.27054.


