肥大细胞在玫瑰痤疮中的研究进展
时间:2023-09-27 14:16:38 热度:37.1℃ 作者:网络
玫瑰痤疮是一种慢性的炎症性皮肤病,主要表现为发生于面部中央(双颊、 下颌、鼻部和前额中央部分)的多形性皮损,包括阵发性潮红、持续性红斑、炎症性丘疹、脓疱和毛细血管扩张等,且呈现反复缓解和加重的特征。玫瑰痤疮对患者的社会心理健康造成负面影响,会降低患者的自尊、自信、社交能力和生活质量。
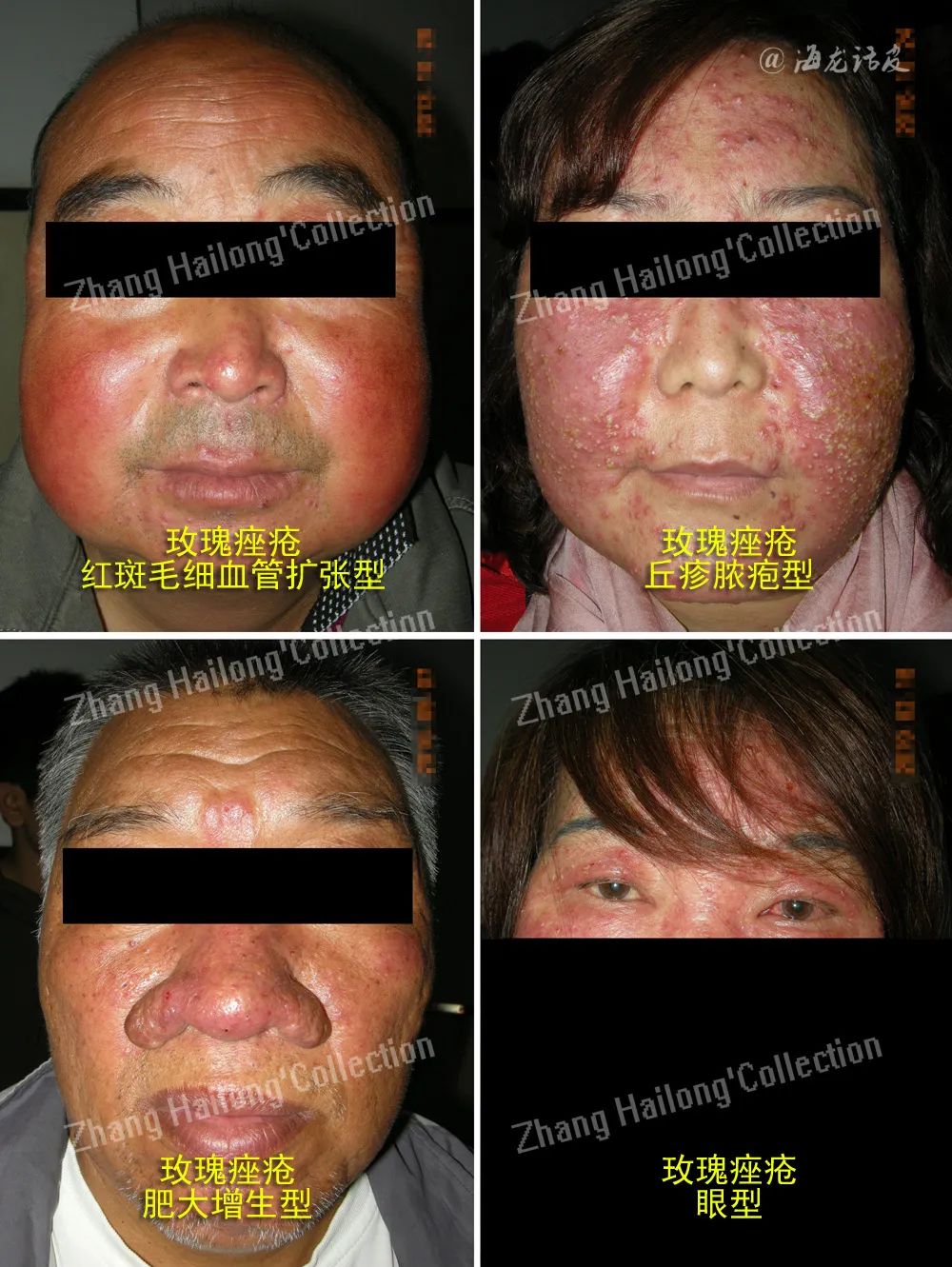
2002年,美国国立玫瑰痤疮协会发布了玫瑰痤疮的标准分类系统,并根据临床表现和体征将其分为4种临床亚型:红斑毛细血管扩张型、丘疹脓疱型、肥大增生型和眼玫瑰痤疮。该分类系统还包括一种特殊类型的玫瑰痤疮(肉芽肿性玫瑰痤疮)。上述传统亚型分类将多个特征合并为离散的类别,不能准确地代表玫瑰痤疮患者复杂的临床表现。
因此,2019年的全球玫瑰痤疮共识(the global rosacea consensus,ROSCO)提出了从亚型到表型的转变,推荐根据临床特征对患者进行管理,而不是根据预设的亚型进行分类。玫瑰痤疮确切的发病机制尚不清楚,遗传因素、免疫因素、局部血管舒缩神经失调和慢性感染等都参与其中。近年来肥大细胞的研究不断增加,其在玫瑰痤疮发病中的地位日益受到重视。
肥大细胞(mast cells,MCs)是一类重要的免疫细胞,它来源于骨髓中的多能造血干细胞,经过一定的分化后迁移到外周循环中,最终作为未成熟的前体细胞在各组织中定居。在组织中,MCs经过与细胞外基质和其他细胞密切的相互作用后成熟。成熟的MCs主要位于大部分组织和器官的血管和神经周围。
MCs在暴露于外环境的区域最为丰富,即呼吸道、胃肠道和泌尿生殖道以及真皮的乳头状和网状层。估计皮肤MCs密度为7000~12000/mm3,这些细胞在免疫监视中起着核心作用,同时也是炎症过程的重要参与者。MCs可以诱导血管舒张、促进血管通透性增加、招募炎症细胞、促进适应性免疫反应、调节血管生成和纤维化等,是过敏反应和其他炎症反应的关键启动因子和调节因子。
肥大细胞参与玫瑰痤疮发病的机制
肥大细胞的激活:
MCs激活的经典途径是免疫球蛋白E(immunoglobulin E,IgE)介导的脱颗粒,MCs表达高亲和力的IgE受体(Fc epsilon RI,FcεRI),它可以将IgE与特异性抗原交联,形成IgE/FcεRI复合物,导致MCs激活。除了经典IgE途径,还有多种途径可以激活MCs。MCs表达了大量的受体,使它们能够被多种细胞、病毒和细菌激活。
例如,病原体和模式识别受体(pattern recognition receptors,PRRs)的结合也可以激活MCs。这些PRRs包括表面Toll样受体(toll-like receptors,TLRs)、胞内TLRs、凝集素样受体等。此外,免疫球蛋白游离轻链(free light chain,FLC)可以不借助Fc受体诱导MCs的激活。LL-37皮内注射构建的小鼠玫瑰痤疮样皮损模型是目前使用最为广泛的玫瑰痤疮动物模型,Muto的研究发现MCs缺陷小鼠在皮内注射LL-37抗菌肽后不会发生玫瑰痤疮样炎症反应。此外MCs稳定剂在实验小鼠体内抑制玫瑰痤疮样炎症的发展,验证了MCs的激活在玫瑰痤疮的发生发展过程中发挥重要作用。
LL-37通过肥大细胞诱导炎症反应机制:
LL-37是人体合成的唯一一种抗菌肽,其作为固有免疫的一部分,除了参与抵抗外源微生物入侵外,还具有强大的趋化和免疫调节功能。在玫瑰痤疮皮损的角质形成细胞中TLR-2受体表达明显上调,从而上调激肽释放酶5(kallikrein-5,KLK-5)表达,将LL-37前体蛋白裂解为活性形式。在细胞实验中观察到LL-37可通过MRGPRX2(mas-related G protein–coupled receptor X2)受体上调TRPV4通道基因的表达,促进肥大细胞脱颗粒。
MCs脱颗粒释放的类胰蛋白酶、糜酶可以激活细胞外基质中的基质金属蛋白酶(matrix metalloproteinases,MMPs)。MMP9激活后将KLK5由前体剪切活化,正反馈引起LL-37表达进一步增加,从而促进玫瑰痤疮的发生和进展。肥大细胞激活后分泌多种炎症介质和趋化因子。如肿瘤坏死因子-α(tumor necrosis factor,TNF-α),可以激活巨噬细胞、内皮细胞和促进多种细胞因子的产生,TNF-α对白细胞有趋化作用,诱导白细胞至炎症部位,促进玫瑰痤疮脓疱的产生。
TRPV通道参与肥大细胞脱颗粒机制:
TRP(transient receptor potential)是一类离子通道,存在于许多组织和细胞类型中,可渗透多种阳离子,如Ca2+、Mg2+等。部分TRP通道可被热、紫外线等物理因素等激活,这与玫瑰痤疮的诱发及加重因素相似,部分TRP通道的激活又与疼痛和瘙痒的产生有关,这与玫瑰痤疮的症状相似,因此TRP通道被认为参与玫瑰痤疮的发病机制。
目前已经发现TRPV(瞬时受体电位香草酸亚型)中的TRPV2和TRPV4在玫瑰痤疮患者中与MCs共定位。Mascarenhas等发现LL-37可以上调原代人MCs的TRPV4通道数量,促进Ca2+内流,增加MCs脱颗粒水平;TRPV4抑制剂处理的MCs脱颗粒能力降低,LL-37对trpv4 的上调依赖于MRGPRX2。
提示可能有LL37/MRGPRX2/TRPV4轴的存在。但也有研究发现,TRPV1、TRPV2和TRPV4不参与MRGPRB2(人类MRGPRX2的小鼠同源基因)受体介导的小鼠源MCs激活,也不参与热或渗透刺激触发的激活通路。目前TRPV通道参与肥大细胞脱颗粒的具体机制仍需进一步探索。
肥大细胞参与血管重构、纤维化:
MCs激活后还可以分泌几种重要的促血管生成分子,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、 血小板衍生生长因子(platelet-derived growth factor,PDGF)、和成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2),这些促血管因子协同导致局部血管和淋巴管重构、血管新生,临床表现为持久性的毛细血管扩张、淋巴水肿。MCs的激活后合成的转化生长因子-β1(transforming growth factor-β1, TGF-β1)、TNF-α可以刺激皮肤成纤维细胞增殖、分化和胶原合成,并促进纤维化的发生,可能参与鼻赘期玫瑰痤疮的发病。
肥大细胞参与神经源性炎症:
多数玫瑰痤疮患者对某些普通的刺激敏感,如紫外线、温度变化、强烈的情绪等。这种皮肤敏感性的改变提示感觉神经和自主神经系统在玫瑰痤疮发病机制中的重要作用。神经源性玫瑰痤疮(neurogenic rosacea,NR)是近年来新提出一种玫瑰痤疮亚型,该型共同特征为面部的瘙痒、灼烧感和刺痛感,对传统治疗反应较差,普瑞巴林、加巴喷丁等神经靶向治疗对NR治疗有效。
在玫瑰痤疮皮损中,感觉神经和血管以及MCs之间都有着紧密的共定位现象,MCs可以被神经纤维释放的垂体腺苷酸环化酶激肽(pituitary adenylate cyclase activating polypeptide,PACAP)、血管活性肠肽(vasoactive intestinal polypeptide,VIP)、P物质(substance P,SP)和降钙素基因相关蛋白(calcitonin gene-related protein,CGRP)等神经肽激活,释放组胺、TNF-α等介质介导炎症反应。MCs释放的TNF-α可以提高IL-6、IL-8的释放,导致小髓鞘Aδ神经纤维和无髓C神经纤维的损害,导致感觉异常、毛细血管功能失调的临床表现。因此NR可能是一种小纤维神经病变。诸多研究提示MCs可能扮演神经源性炎症作用于毛细血管和其他免疫细胞的桥梁,但其具体的机制需要进一步研究。
针对肥大细胞的玫瑰痤疮治疗学进展
随着肥大细胞在玫瑰痤疮发病机制中的地位逐渐确立,肥大细胞也成为玫瑰痤疮治疗中的一个重要靶点。
肥大细胞抑制剂/稳定剂:
色苷酸钠:
作为一种经典的肥大细胞稳定剂,已用于哮喘多年。Muto在2014年证明了系统应用色苷酸钠在抗菌肽诱导的玫瑰痤疮样炎症小鼠模型中的疗效,但目前仍没有进一步的临床试验结果。
羟氯喹:
是一种免疫调节剂,在皮肤科应用广泛,其抗炎作用明确,近年的研究发现,羟氯喹可以抑制 MCs浸润、降低组织中MCs的长期生存率,在 LL-37诱导的小鼠模型中减轻了玫瑰痤疮样皮损。一项纳入6位患者的研究中,口服羟氯喹 200mg/d, 8周后,患者玫瑰痤疮皮损减轻,羟氯喹的安全性和有效性仍需大规模的临床研究来证明。
免疫调节单链寡核苷酸(single-stranded oligonucleotide,ssON):
Dondalska的研究发现ssON在体外和体内实验中抑制LL-37诱导的非IgE依赖的MCs激活,从而抑制MCs脱颗粒,可以改善玫瑰痤疮小鼠模型中 IL-37介导的炎症反应。因此ssON可能作为玫瑰痤疮的潜在药物,实验中的抑制作用依赖于 MRGPRX2受体,这也是近年来研究比较多的玫瑰痤疮靶点。
甲氧基欧芹酚(Osthole):
是一种一种天然植物衍生物,可以通过变构修饰调节MRGPRX2的激活,降低MCs中MRGPRX2 在细胞表面和细胞内的表达水平,在小鼠玫瑰痤疮模型中也抑制了MCs的激活。
溴莫尼定凝胶:
Kim等的一项研究表明外用溴莫尼定凝胶在LL-37诱导小鼠玫瑰痤疮模型中明显减轻了炎症反应,同时观察到炎症部位MCs的明显减少,但具体的机制仍不明确。
苯稀莫德:
Sun研究发现用苯稀莫德(一种芳羟受体激动剂)处理后, LL-37处理的HaCaT细胞中TLR2和四种趋化因子(CCL5,CXCL9,CXCL10 和 CXCL11)基因表达降低,其蛋白质表达也明显降低,在动物实验中也显著改善小鼠玫瑰痤疮样皮损。
肉毒杆菌毒素:
A Choi发现在小鼠模型中,注射肉毒杆菌毒素A显著减少了LL-37诱导的皮肤红斑,肥大细胞脱颗粒和玫瑰痤疮生物标记物(如TRPV2和TRPV4)的mRNA表达,证明了肉毒杆菌毒素A通过抑制肥大细胞治疗玫瑰痤疮样炎症。
光电疗法:
Jiang发现强脉冲光(intense pulsed light,IPL)能够减轻玫瑰痤疮小鼠模型的炎症反应,同时伴有脱颗粒MCs的百分比降低。在体外,IPL降低了P815细胞(小鼠肥大细胞瘤细胞)中MMP-9、KLK5和抗菌肽的表达,减少了炎症细胞因子的释放,抑制了炎症反应,证明抑制肥大细胞脱颗粒可能是IPL治疗玫瑰痤疮的机制之一。
总结
近年来对肥大细胞的研究有许多新的发现,其在许多疾病包括新冠肺炎中充当了炎症的“放大器”,介导了炎症的级联反应。在玫瑰痤疮中,肥大细胞起到炎症扩大、炎症慢性化的作用。
肥大细胞与成纤维细胞、皮脂腺细胞、角质形成细胞等的相互影响有待深入研究。一些药物、光电疗法可抑制肥大细胞的活动,为寻找玫瑰痤疮治疗的新靶标提供依据,也为包括玫瑰痤疮在内的多种皮肤炎症性疾病的治疗提供更广阔的思路。
参考文献:
[1]周兆康,丁徽,葛一平.肥大细胞在玫瑰痤疮中的研究进展[J].2023,9,21.
[2]Baldwin HE, Harper J, Baradaran S, et al. Erythema of Rosacea affects health-related quality of life: results of a survey conducted in collaboration with the national rosacea society[J].Dermatol Ther (Heidelb),2019,9(4):725-734.
[3]Gether L, Overgaard LK, Egeberg A, et al. Incidence and prevalence of rosacea: a systematic review and meta-analysis[J]. Br J Dermatol, 2018,179(2):282-289.
[4]Gallo RL, Granstein RD, Kang S, et al. Standard classification and pathophysiology of rosacea: The 2017 update by the National Rosacea Society Expert Committee[J]. J Am Acad Dermatol, 2018,78(1):148-155.
[5]Wilkin J, Dahl M, Detmar M, et al. Standard classification of rosacea: Report of the national rosacea society expert committee on the classification and staging of rosacea[J]. J Am Acad Dermatol, 2002,46(4):584-587
[6]其他文献略。


