Nature子刊:上海交大赵庆华/贺明团队合作揭示肝-骨轴稳态调控抗骨质疏松新机制
时间:2023-05-19 09:48:50 热度:37.1℃ 作者:网络
骨质疏松症是一种常见的全身性代谢性骨病,破骨细胞驱动的骨吸收和成骨细胞介导的骨形成之间微妙平衡的破坏是骨质疏松的发病基础。除了骨细胞的密切合作外,骨代谢还受到其他器官之间复杂通讯的调节,为骨质疏松症的治疗提供了新的见解。
肝脏是调节许多生理和病理过程的重要器官,包括全身糖脂和维生素D代谢等。慢性肝病患者常合并骨代谢异常,其中约75%的慢性肝病患者会患上严重的骨质疏松症,这表明肝脏在调节骨代谢中起着关键作用。然而,肝脏和骨骼代谢之间的相互作用在很大程度上仍然未知。关于肝脏在原发性骨质疏松症中的作用,报道甚少。Sirtuin2 (SIRT2)是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖性去乙酰化酶,在衰老、代谢、炎症和肿瘤发生等生命活动的调节中发挥着重要作用。但肝细胞中的SIRT2对骨稳态的作用尚不清楚。
近日,由上海交通大学医学院附属第一人民医院骨科临床医学中心赵庆华教授及上海交通大学基础医学院病理生理学系贺明教授领衔的研究团队,在 Nature Metabolism 期刊发表了题为:SIRT2 regulates extracellular vesicle-mediated liver-bone communication 的研究论文。
该团队在研究老年性骨质疏松时发现了由肝细胞SIRT2调控的肝脏-骨骼通讯的新机制,表明靶向肝细胞-破骨细胞通讯的药物可能是未来治疗原发性骨质疏松症的一种潜在策略。

老年小鼠和老年人肝细胞SIRT2的表达增加;肝脏特异性SIRT2缺失可抑制破骨细胞生成并减轻老年骨质疏松小鼠的骨丢失。进一步利用基因敲除小鼠、蛋白质谱、RNA 测序等技术明确了机制:富含亮氨酸的α-2-糖蛋白1(LRG1)是肝细胞衍生的小细胞外囊泡(sEVs)中的一种功能性蛋白,在SIRT2缺陷的肝细胞中,sEVs中的LRG1水平上调,LRG1向骨髓单核细胞(BMDMs)转移增加,进而通过减少NF-κB p65的核易位抑制破骨细胞分化。用携带高水平LRG1的sEVs治疗可抑制人BMDMs和骨质疏松症小鼠的破骨细胞分化。
同时,通过探究骨代谢相关参数与血浆sEVs-LRG1水平之间的关联,研究团队发现血浆sEVs-LRG1与患者的BMD呈正相关,与骨吸收标志物呈负相关。由此,该研究表明靶向肝细胞-破骨细胞通讯的药物可能是未来治疗原发性骨质疏松症的一种潜在策略。
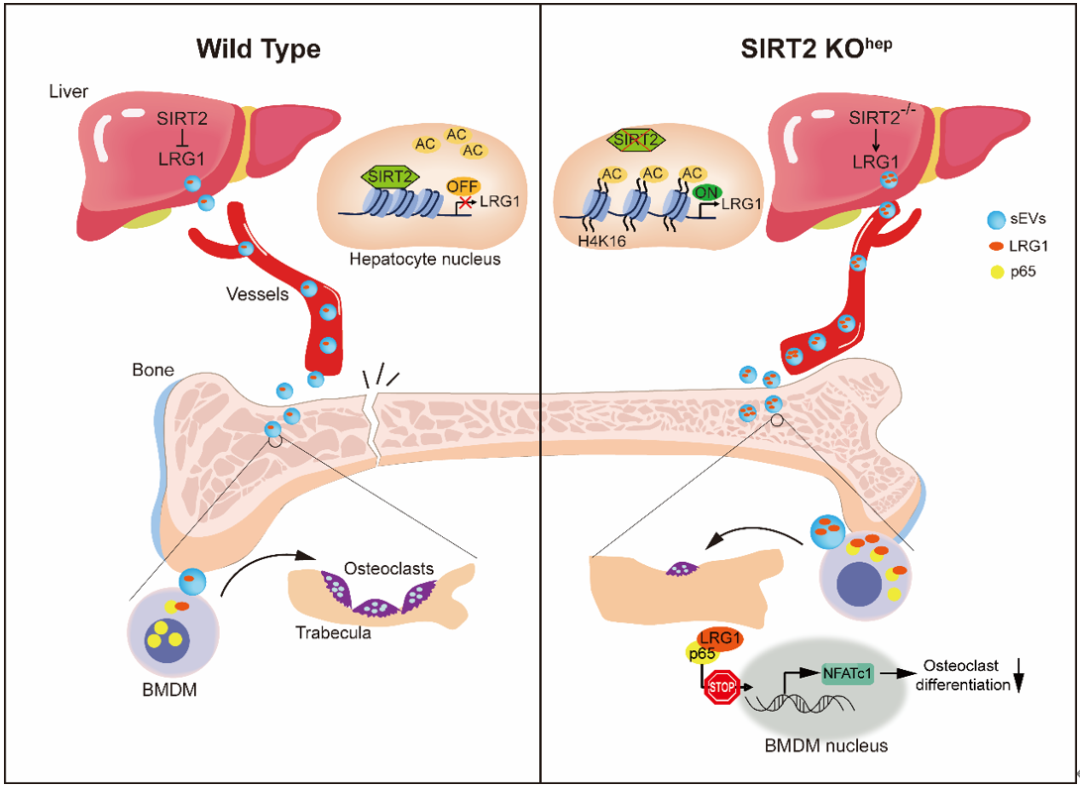
机制图:肝细胞SIRT2调控的肝-骨通讯新机制
总的来说,此项研究阐释了肝细胞-破骨细胞通讯的具体机制,证明了肝脏对破骨细胞分化发挥着关键调控作用。SIRT2-KOhep通过肝细胞来源的sEVs上调肝脏LRG1向BMDMs的转移,从而抑制NF-κB p65-NFATc1的激活和破骨细胞的生成。基于此有望开发出新的有效疗法治疗骨质疏松。
上海交通大学医学院附属第一人民医院骨科临床医学中心赵庆华教授及上海交通大学基础医学院病理生理学系贺明教授为论文通讯作者。赵庆华教授研究生林龙帅为论文第一作者。该研究工作得到了上海交通大学医学院陈国强院士、郑俊克教授、洪登礼教授、赵倩教授,以及右江民族医学院龙喜带教授的帮助和支持。
论文链接:
https://www.nature.com/articles/s42255-023-00803-0


