4篇Cell:全面刷新阿尔茨海默病疾病机制和认知
时间:2023-10-04 14:19:54 热度:37.1℃ 作者:网络
阿尔茨海默病是一种起病隐匿、进行性发展的神经退行性疾病。最新的流行病学资料显示,在全球范围内,每3秒钟就有一个人被诊断为阿尔茨海默病。该病多发于65岁以上的老年人,女性略多于男性。痴呆症已经困扰着全球超过5500万的人群,而阿尔茨海默病(AD)是痴呆症中最常见的一种类型,占据痴呆症病例中的60%-70%。该疾病给个人和社会带来极大的公共卫生负担。根据不同的研究,阿尔茨海默病的发病率随着年龄的增长而增加,但近年来有逐渐年轻化的趋势。
为了找到治疗AD的新靶点,麻省理工学院的研究者对AD患者大脑中各类细胞进行了迄今最广泛的研究,涉及到细胞基因组、表观遗传和转录组等多个遗传水平变化。研究
Religious Orders Study (ROS) 和 the Rush Memory and Aging Project (MAP)的简称,这两个项目由同一批科学家设计。目前有超过1900个捐献者,其中脑的样本有七百余个,主要采集背外侧前额叶的样本。ROS参与者来自全美40多个宗教团体(修女、牧师、兄弟)。ROSMAP的病人数据均进行了多维度的组学测定,包括DNA甲基化(450K芯片测定),基因表达(RNA-seq测定),组蛋白乙酰化修饰(H3K9ac ChiP-seq测定),microRNA表达量(芯片测定),此外每个个体具有完备的基因型数据。数据可以在Synapse下载(Website:https://www.synapse.org/#!Synapse:syn3219045)。该系列的研究领导者为麻省理工学院的蔡立慧教授和Manolis Kellis教授。
此次4篇Cell文章,使用的样本来自427名ROSMAP研究的受试者的大脑,总共用于分析的大脑细胞数量达到了230万个。这4篇论文,向我们展示了迄今为止最全面的AD相关遗传和分子图谱,与以往研究关注淀粉样蛋白斑块不同,该系列研究试图找到的是AD发生的分子驱动因素、最脆弱的细胞类型以及驱动神经变性的其他潜在生物学途径。
两种脆弱的神经元可能是阿尔茨海默病的关键
第一篇论文中,研究人员使用单细胞RNA测序分析了患者样本中54种细胞的基因表达模式,并确定AD患者受影响最大的细胞功能。他们发现,AD患者涉及线粒体功能、突触信号和维持基因组结构完整相关蛋白质的基因表达受损最为显著。

研究者还根据是否出现认识功能障碍,将AD患者分为了两组进行比较。实际上,即使有些人已经出现了一定程度的淀粉样蛋白累积,但仍然可以保持敏锐的认知功能。根据作者的分析,认知能力强的个体,他们前额叶皮层中有两组抑制性神经元的数量更多。这部分细胞在一些出现痴呆症的患者大脑内表现出更脆弱、更易死亡的特征。
这也说明,特定的抑制性神经元是维持认知功能的关键,即使存在AD的病理特征,这部分细胞仍能支持健康的认知功能。
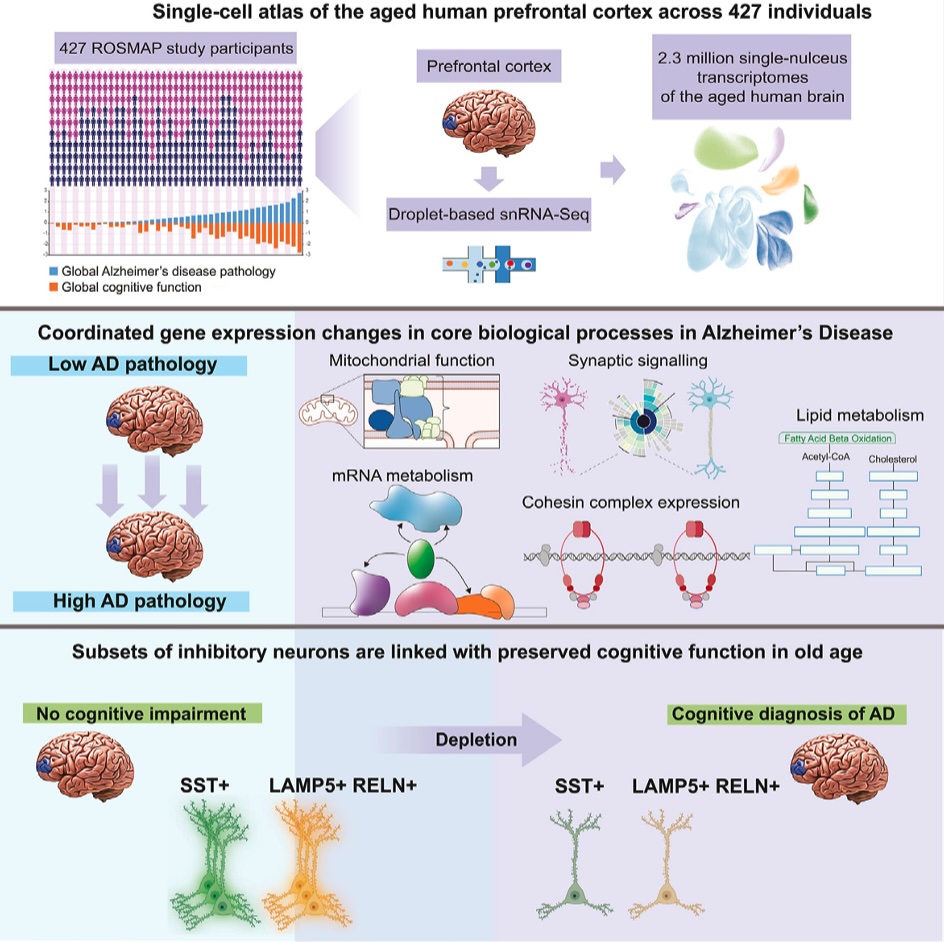
图1 文献1
二、基因组变异的作用
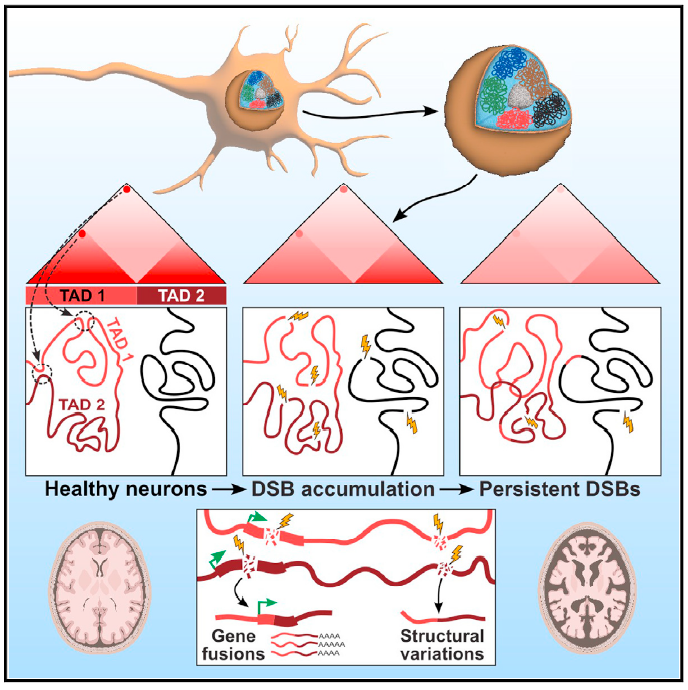
第二篇论文聚焦于基因组变异在神经退行性疾病中的作用。在阿尔茨海默病等神经退行性疾病中,神经元中持续存在DNA双链断裂(DSB),是一个典型的早期病理标志。这对基因组的完整性和稳定性究竟会造成什么样的破坏?

研究团队基于数据库中的单核RNA测序技术,分析了去世者的前额叶皮层样本,发现在阿尔茨海默病患者的样本中,兴奋性神经元的体细胞嵌合基因融合(mosaic gene fusion)增加。
基因融合指的是两个基因的部分序列融合形成嵌合基因,在后续的生物学过程中可能形成异常转录本或蛋白质。在肿瘤的发生过程中,由于染色体易位、缺失等原因所致的基因融合是常见的重要病因。而此次研究发现,在神经退行性疾病的病理过程中,具有DNA损伤修复和衰老基因特征的兴奋性神经元中,基因融合事件尤其突出。
研究示意图(图片来源:文献[2])
在神经变性小鼠模型中,体细胞基因组结构变异和基因融合同样在DNA双链断裂的神经元中多发。此外,在DNA双链断裂多发的神经元中还可以观察到,基因组的三维组织结构同样发生了渐进的多尺度破坏,与突触、神经元发育和组蛋白基因的转录变化是一致的。这证明神经元的DNA双链断裂对基因组稳定性及其三维结构组织的破坏是神经退行性疾病进展过程中的病理步骤。
三、小胶质细胞的炎症状态可能是阿尔茨海默病核心因素
第三篇论文主要关注了小胶质细胞,它们扮演着大脑中免疫细胞的角色,主要负责清除大脑中的废物,还会对损伤和感染做出反应,也能参与神经元的通讯过程。

在2015年,蔡立慧教授与Kellis教授就曾发现,全基因组关联研究中找到的与AD相关的变异主要活跃在小胶质细胞等免疫细胞中,远远超过其他的大脑细胞类型。
在新研究中,作者借助RNA测序,根据数百种基因的表达水平将小胶质细胞划分成了12种不同的状态。结果显示,随着AD的进展,更多的小胶质细胞逐渐进入了炎症状态。大脑中不断加重的炎症会导致血脑屏障功能出现退化,神经元之间的交流变得更加困难。
除此之外,AD患者大脑中用于促进大脑平衡、维护大脑功能正常运作的小胶质细胞数量显著减少了,研究者根据转录组分析,找到了一些在维持小胶质细胞稳态中比较重要的基因,他们计划在未来探索激活这些基因或相关表达分子的方式,以此来控制小胶质细胞的状态,减少大脑中的炎症。
四、阿尔茨海默病转录组图谱
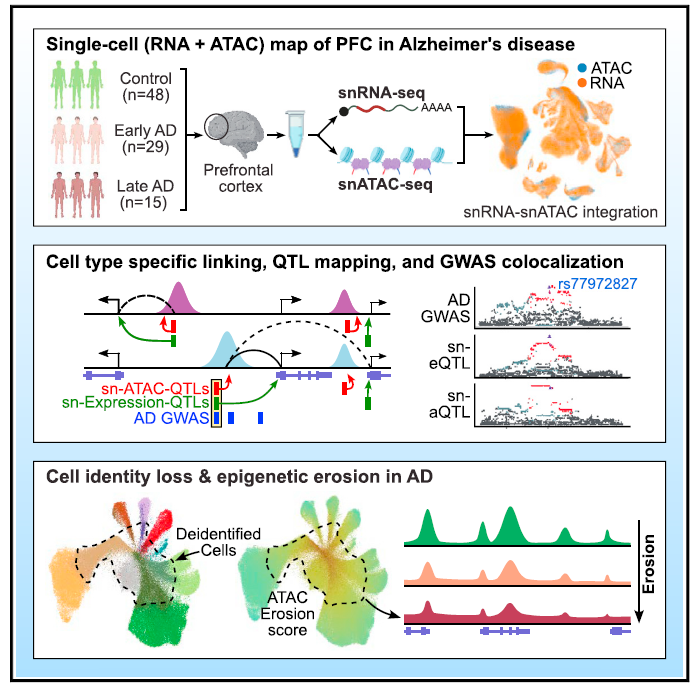
在第4篇论文中,研究团队对44名阿尔茨海默病患者以及48名健康人群的前额叶皮质样本,构建了表观基因组和转录组图谱,从表观遗传层面解析了阿尔茨海默病进程中的调控程序,并且揭示了晚期患者的表观遗传组侵蚀与细胞身份丧失现象。

近期的研究工作已经找到了数十个具有阿尔茨海默病风险的非编码位点,但这些位点在转录组、表观遗传与细胞水平上的机制与转录调控通路在很大程度上仍然未知,这也阻碍了对新疗法的搜寻。
为了解决以上问题,研究团队使用了一种名为ATAC-Seq的技术,该技术能够以单细胞分辨率测定整个基因组中位点的可及性。将以上数据与单细胞RNA测序数据相结合,研究团队得以将基因表达量信息与该基因的可及性联系起来。
▲研究示意图(图片来源:参考资料[4])
利用该途径,研究团队能够追踪阿尔茨海默病相关基因的基因表达与表观基因组可及性的变化,他们还鉴定出了最有可能表达这些疾病相关基因的细胞类型,发现其最常发生在脑部的免疫细胞——小胶质细胞中。
此外,研究还发现随着阿尔茨海默病的进展,在晚期疾病的大脑中出现了全局性的表观基因组调节障碍,各类细胞都会遭遇表观遗传组侵蚀现象,以及细胞身份的丧失。这些发现也为阿尔茨海默病的机制研究指出了新的方向。
上述4篇文章从全新的角度解析阿尔茨海默病的机制,也为阿尔茨海默病的新药研发带来新的思路。
参考资料:
[1]Single-cell atlas reveals correlates of high cognitive function, dementia, and resilience to Alzheimer’s disease pathology. Cell (2023). DOI: https://doi.org/10.1016/j.cell.2023.08.039

