【协和医学杂志】自身免疫性疾病患者T淋巴细胞线粒体损伤定量分析及其临床价值探讨
时间:2023-10-20 20:36:06 热度:37.1℃ 作者:网络
自身免疫性疾病(AID)是由于自身免疫应答达到一定强度后导致机体组织和细胞发生病理性损害,进而表现出一系列临床症状的一类疾病。目前AID尚无统一的分类标准,按受累器官范围可分为器官特异性AID和系统性AID,尤以后者受累范围更广、危害更大[1]。
系统性红斑狼疮(SLE)、类风湿关节炎(RA)以及干燥综合征(SS)均属于系统性AID[2-4],其病因均未完全阐明,临床尚缺乏特效干预手段,开展病因学相关研究可辅助临床实现疾病的精准诊疗。
在细胞内,线粒体通过氧化磷酸化反应合成的三磷酸腺苷(ATP)为细胞提供能量,故线粒体在机体的代谢调节中扮演着重要角色。研究显示,线粒体损伤是AID发病及病情进展的重要促进因素之一[5]。
自身免疫反应过程中,免疫细胞将对自身细胞抗原(包括线粒体成分)发生攻击,导致线粒体损伤和破坏,而损伤的线粒体可释放多种细胞因子和自身抗原,进一步刺激自身免疫反应持续进展,以加剧疾病严重程度和病情损害范围。
线粒体损伤对AID的影响主要包括以下方面[6-10]:(1)损伤的线粒体可诱导免疫细胞凋亡和坏死,激活炎症反应和自身免疫反应。因线粒体损伤导致的线粒体自噬障碍参与了多种AID发病和病情恶化过程,如SLE、RA等。(2)线粒体外膜破裂及线粒体释放的抗原可进一步激活免疫细胞,诱导并加剧炎症反应、自身免疫反应和组织破坏。
T淋巴细胞是重要的免疫细胞,其代谢转变可通过影响糖酵解途径及线粒体自噬功能进而影响机体的自身免疫反应,但T淋巴细胞线粒体损伤和代谢功能失调与AID的相关性仍缺乏强有力的循证医学证据支持。故本研究通过流式细胞术初步量化评估AID患者外周血T淋巴细胞线粒体损伤情况,以期为AID病因学研究提供线索。
1 材料与方法
1.1 研究对象
回顾性收集2023年3—4月北京协和医院风湿免疫科诊治的AID患者及同期体检健康人群的临床资料。
AID患者纳入标准:(1)SLE、RA、SS诊断标准分别符合2019美国风湿病学会(ACR)SLE分类诊断标准[2]、2010年ACR及欧洲风湿病学会RA诊断标准[3]、2016版ACR SS分类诊断标准[4];(2)进行了T淋巴细胞线粒体功能检测。
排除标准:(1)合并肿瘤性疾病;(2)合并其他影响免疫功能的疾病。
健康人群来自北京协和医院体检中心,纳入标准:体检证实无肿瘤、AID相关疾病。排除标准:(1)妊娠状态;(2)近3个月内存在病原体感染。
本研究已通过北京协和医院伦理审查委员会审批(审批号:JS-2156),并豁免患者知情同意。
1.2 研究方法
1.2.1 样本预处理
(1)取AID患者和健康人群空腹静脉血2 mL置于含EDTA的抗凝管中;
(2)取100 μL充分混匀的外周血样本置于含20 μL抗体检测试剂的流式管中,充分震荡混匀后室温避光静置孵育15 min;
(3)向流式管中加入2 mL室温放置的溶血素,混匀后室温避光静置孵育15 min;
(4)将流式管置于离心机中,300×g离心5 min去除上清液;
(5)加入200 μL PBS,漩涡震荡混匀后将重悬液加入预先装有线粒体探针的八联管中;
(6)充分漩涡震荡,于37 ℃恒温培养箱避光孵育30 min。
1.2.2 流式细胞仪法检测外周血淋巴细胞水平及线粒体膜电位
采用CytekTM NL-CLC全光谱流式细胞仪检测外周血T淋巴细胞线粒体膜电位(MMP)并进行数据分析,检测试剂为CD8+19 FITC/CD3+56 PE/CD45 PC5.5/CD4 PC7/MitoDye检测试剂盒[泛肽生物科技(浙江)有限公司],检测指标:CD3+T淋巴细胞(T)及其亚群[CD3+CD4+ T淋巴细胞,即辅助性T淋巴细胞(Th)和CD3+CD8+T淋巴细胞,即杀伤性T淋巴细胞(Tc)]百分比、线粒体质量。其中线粒体质量以MMP表示,MMP数值越高表示细胞线粒体质量(包括体积和数量)越大。
MMP可以升高、降低,亦可保持正常,其中线粒体膜电位偏低细胞百分比(MMP-low%)是指线粒体膜电位偏低的细胞占该类细胞总数的百分比,其数值越低提示细胞活性越差、线粒体功能障碍越严重。
Th/Tc比值为Th百分比与Tc百分比的比值,其可评估机体的免疫状态。本试剂盒中该比值的正常参考范围为0.7~3.1,<0.7时为免疫功能低下。根据Th/Tc比值,将AID患者分为免疫功能低下亚组和免疫功能正常亚组。
1.3 统计效能估算
本研究拟纳入AID患者70例,健康人群20名,采用G*Power软件进行统计效能估算。统计方法为两样本非参数检验,参数设置如下:双侧检验,一类错误为α=0.05,二类错误为β=0.2,经计算统计效能为73.53%。
1.4 统计学处理
采用GraphPad Prism 9和R 4.2.2进行统计分析及图表绘制。基线资料年龄符合正态分布,以均数±标准差表示;性别、自身抗体阳性率以频数(百分数)表示;T淋巴细胞MMP-low%不符合正态分布,以中位数(四分位数)表示,组间比较采用Kruskal-Wallis H 检验和Mann-Whitney U 检验。
采用Spearman相关法分析T淋巴细胞及其亚群线粒体功能障碍情况与免疫状态(Th/Tc比值)的相关性。采用受试者工作特征(ROC)曲线评估各指标诊断AID的临床价值,结果以曲线下面积(AUC)表示,并采用Delong检验对AUC进行统计学分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入与排除标准的AID患者70例,健康人群20名。AID患者中,男性11例,女性59例;平均年龄(43.82±16.58)岁;免疫功能低下20例,免疫功能正常者50例。
SLE患者33例,男性7例、女性26例,平均年龄(35.00±13.79)岁,抗核抗体阳性率为96.97%(32/33);RA患者19例,男性3例、女性16例,平均年龄(53.32±12.77)岁,抗环瓜氨酸肽(CCP)抗体阳性率为64.29%(9/14,5例未检测);SS患者18例,男性1例、女性17例,平均年龄(52.11±19.93)岁,抗SSA/SSB(Sjögren syndrome A/Sjögren syndrome B)抗体阳性率100%(14/14,4例未检测)。
健康人群中,男性4例、女性16例,平均年龄(41.90±12.76)岁。AID患者与健康人群年龄(P=0.489)、性别比例(P=0.650)均无统计学差异。
2.2 AID患者外周血T淋巴细胞及其亚群线粒体功能障碍定量分析
SLE患者、RA患者、SS患者CD3+T淋巴细胞MMP-low%(T MMP-low%)、CD3+CD4+T淋巴细胞MMP-low%(Th MMP-low%)、CD3+CD8+T淋巴细胞MMP-low%(Tc MMP-low%)均低于健康人群,差异具有统计学意义(P 均<0.05),见表1和图1。
表1 AID患者与健康人群外周血T淋巴细胞及其亚群线粒体质量比较[M(P25, P75),%]
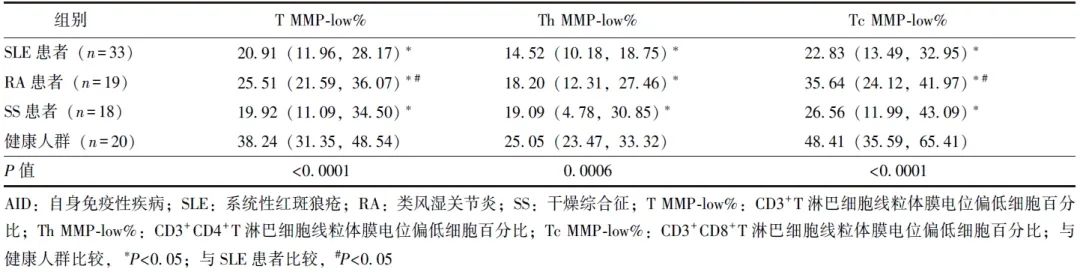
图1 AID患者与健康人群CD3+T淋巴细胞、CD3+CD4+T淋巴细胞、CD3+CD8+T淋巴细胞线粒体质量比较
T MMP-low%、Th MMP-low%、Tc MMP-low%、AID、SLE、RA、SS:同表1
2.3 免疫功能状态与T淋巴细胞及其亚群线粒体功能障碍的关系
AID患者中,免疫功能低下亚组和免疫功能正常亚组T MMP-low%、Th MMP-low%、Tc MMP-low%均低于健康人群,差异具有统计学意义(P均<0.05)。相较于免疫功能正常亚组,免疫功能低下亚组T MMP-low%、Th MMP-low%、Tc MMP-low%均呈降低趋势,但差异均无统计学意义(P均>0.05)。免疫功能低下亚组、免疫功能正常亚组和健康人群之间Th MMP-low%/Tc MMP-low%比值差异无统计学意义(P=0.056),见表2。
表2 不同免疫状态的AID患者与健康人群T淋巴细胞及其亚群线粒体质量比较[M(P25, P75)]
Spearman相关性分析显示,T MMP-low%、Th MMP-low%、Tc MMP-low%、Th MMP-low%/Tc MMP-low%比值中,仅发现Th MMP-low%/Tc MMP-low%比值与AID患者Th/Tc比值具有相关性(r=-0.39,P=0.001),见图2。
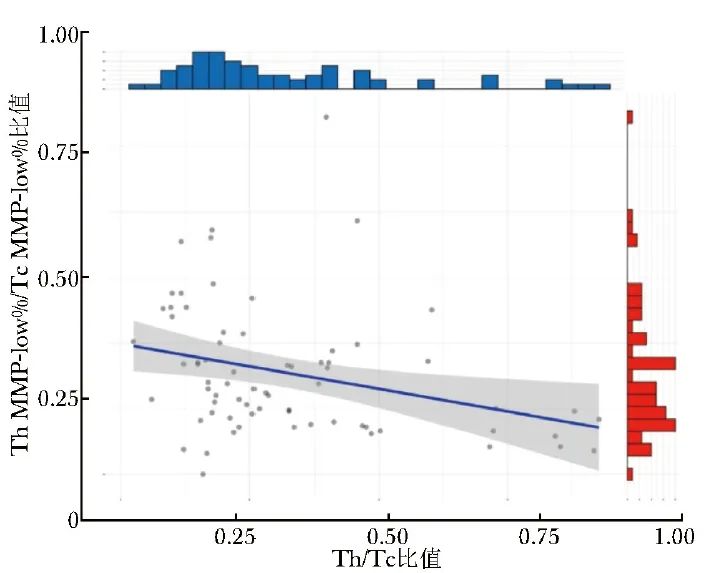
图2 AID患者Th MMP-low%/Tc MMP-low%比值与Th/Tc比值的相关性
Th MMP-low%、Tc MMP-low%、AID:同表1;Th/Tc:Th百分比与Tc百分比的比值
2.4 T淋巴细胞及其亚群线粒体功能障碍指标对AID的诊断价值
ROC曲线显示,T MMP-low%、Tc MMP-low%、Th MMP-low%识别AID的AUC分别为0.83(95% CI:0.74~0.92)、0.82(95% CI: 0.73~0.92)、0.77(95% CI: 0.67~0.88),Th/Tc比值识别AID的AUC仅为0.64(95% CI:0.53~0.76),而Th MMP-low%/Tc MMP-low%比值在AID与健康人群的识别中无统计学意义(P=0.299),见图3。
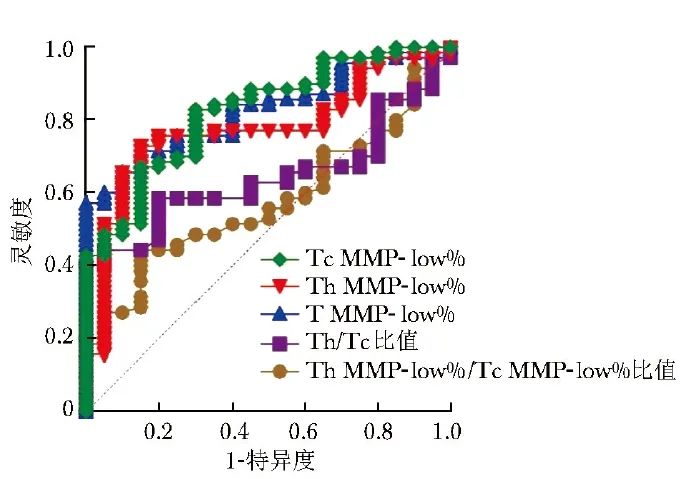
图3 T淋巴细胞及其亚群线粒体功能障碍相关指标识别AID的ROC曲线图
ROC:受试者工作特征;Th/Tc:同图2;T MMP-low%、Th MMP-low%、Tc MMP-low%、AID:同表1
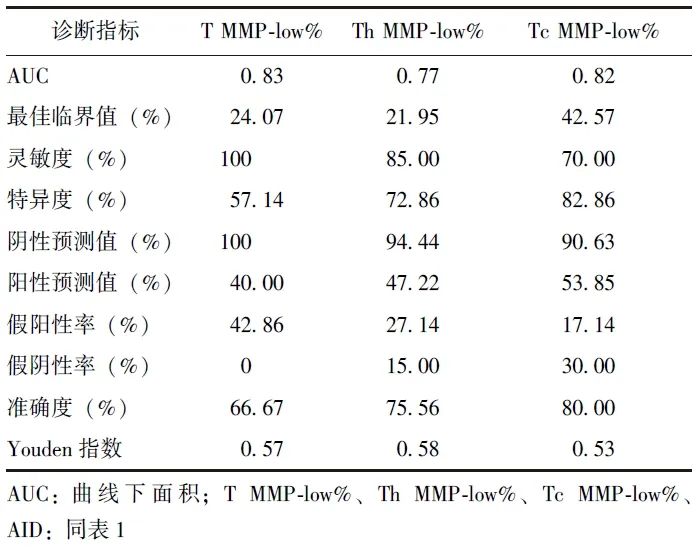
Delong检验显示,T MMP-low%、Tc MMP-low%、Th MMP-low%识别AID的AUC均无统计学差异(P均>0.05),且均高于Th/Tc比值(P均<0.05)。鉴于T MMP-low%、Tc MMP-low%、Th MMP-low%识别AID的临床价值最高,进一步计算了其灵敏度、特异度及最佳临界值等指标,见表3。
表3 T MMP-low%、Tc MMP-low%、Th MMP-low% 识别AID的临床价值
3 讨论
本研究结果显示,相较于健康人群,AID患者外周血T淋巴细胞及其亚群MMP-low%(T MMP-low%、Th MMP-low%、Tc MMP-low%)均降低,且免疫功能低下患者中此现象更加显著。ROC曲线显示,T MMP-low%、Th MMP-low%、Tc MMP-low%识别AID的AUC分别为0.83、0.77、0.82,提示AID患者可能存在外周血T淋巴细胞线粒体损伤且其对AID具有良好的诊断价值。
AID是由于机体免疫系统异常并攻击自身组织、器官和细胞而引起的一类疾病,具有损害范围广、多系统受累的特征,如SLE患者体内存在针对自身细胞核抗原物质的IgG抗体,形成的大量免疫复合物可沉积于肾小球、关节以及多种脏器的小血管壁,进而激活补体,造成多器官和多系统病变,严重者可危及生命[2];RA是一种慢性、反复发作、主要累及关节部位的系统性致残性AID,发生率为1%~3%,患者在发病第2年即可出现不可逆的骨关节破坏[3];SS主要侵犯泪腺和唾液腺等外分泌腺,表现为高度的淋巴细胞浸润,最常见症状为口、眼干燥,但亦可引起内脏损伤[4]。由于AID发病机制复杂,开展其病因学相关研究非常重要。
T淋巴细胞可调节和控制其他免疫细胞活性,对机体自身免疫反应失控具有预防作用,故推测T淋巴细胞与AID发病具有一定相关性[1,11-12]。线粒体是细胞内的重要能源生产器,其生成的ATP可为细胞提供能量,以维持各种生理功能的正常运行;同时线粒体在细胞凋亡、免疫应答等多种生物学过程中亦发挥一定的调节作用。
越来越多的研究表明,T淋巴细胞线粒体损伤及代谢功能失调可能为AID的重要促进因素[6-10,13-15]。早期一项纳入25例SLE患者和25名健康人群的研究提取了受试者外周血单个核细胞后对MMP进行了检测,结果显示SLE患者MMP升高,提示其存在一定程度的线粒体功能损伤[16]。
多项研究显示[17-19],SLE患者的外周血单核细胞线粒体基础耗氧率呈下调状态,淋巴细胞线粒体糖酵解相关酶活性呈降低状态,糖酵解代谢途径呈减弱状态,进而影响了组织代谢功能。
Lee等[20]研究显示,线粒体损伤引起的活性氧(ROS)生成增多可进一步诱发多种细胞因子水平失衡,可能为SLE病情进展的机制之一。SLE患者体内的T淋巴细胞可通过活化哺乳动物雷帕霉素靶蛋白(mTOR)通路进而影响线粒体功能,参与SLE的发生和发展过程,且雷帕霉素已被证实可通过抑制mTOR通路起到延缓SLE小鼠疾病进展的作用[21]。
针对RA的研究得到了相似结果,即RA患者外周血可检出上调的游离线粒体DNA(mtDNA)[22];CD4+ T淋巴细胞可出现一定程度的线粒体功能损伤,主要表现为线粒体耗氧量和ATP生成减少[23];活化的T淋巴细胞可抑制糖酵解途径,抑制三羧酸循环,进而影响机体脂肪酸生成过程以致诱发代谢重编程,可能为免疫功能紊乱的驱动因素[24]。SS相关研究方面,研究显示SS患者的唾液腺内免疫微环境失衡,部分线粒体相关基因表达量变化具有显著意义[25]。
线粒体通过氧化磷酸化过程将产生的能量以电化学势能的形式储存于线粒体内膜,以致内膜两侧质子及其他离子浓度分布不对称,继而形成了MMP。适宜且稳定的MMP是氧化磷酸化的前提条件,对于维持线粒体正常功能具有重要意义。
生理情况下,线粒体内膜MMP保持内负、外正的状态,以维持质子泵功能、驱动ATP形成,为细胞的生命活动提供能量支持。线粒体质量是线粒体内膜呼吸链上的有效蛋白含量,代表了免疫细胞代谢能力的上限。而MMP是线粒体内外的电压差,代表了免疫细胞代谢水平的实际状态。
病理情况下,线粒体稳态失衡并出现功能异常,线粒体代偿性合成增多,以致线粒体质量增大,表现为线粒体DNA合成增多和线粒体MMP增高,继而引起ATP生成速率提高,最终导致细胞凋亡。
本研究结果显示,SLE、RA、SS患者外周血T淋巴细胞及其亚群MMP-low%(T MMP-low%、Th MMP-low%、Tc MMP-low%)均降低,尤以免疫功能低下患者中此现象更为显著,且Th MMP-low%/Tc MMP-low%比值与AID患者Th/Tc比值具有相关性。
MMP可代表免疫细胞代谢水平的实际状态,并反映机体免疫免疫功能的即时状态,本研究AID患者的T淋巴细胞MMP-low%均低于健康对照组,提示AID患者尤其是免疫力低下患者,T淋巴细胞活性可能更差、线粒体功能障碍更严重,与既往针对SLE患者单个核细胞线粒体存在损伤的研究结果相一致[16]。
本研究ROC曲线显示,T MMP-low%、Tc MMP-low%、Th MMP-low%识别AID的AUC分别为0.83、0.82、0.77,提示上述指标有望应用于AID的早期诊断,推测线粒体损伤可能的致病机制:
(1)线粒体损伤将导致线粒体通透性转换孔开启,引起多种离子、分子及其他生化物质异常释放,进而参与细胞凋亡、炎症反应、免疫反应等多种生理与病理过程;
(2)线粒体损伤可释放游离mtDNA、心磷脂及线粒体甲酰化多肽等线粒体内容物,这些成分作为损伤相关的分子模式(DAMPs),通过模式识别受体(PRR)相关通路进一步诱发炎症反应并调控Ⅰ型干扰素通路、NLPR3炎症小体、Toll样受体9等信号通路放大免疫炎症[12];
(3)线粒体在机体代谢调节中亦发挥重要作用,T淋巴细胞代谢改变可通过影响机体的糖酵解途径及线粒体自噬功能,进而影响机体的自身免疫反应。
本研究首次基于流式细胞术检测了外周血淋巴细胞线粒体损伤情况,目前临床评估外周血淋巴细胞线粒体功能的常用方法包括线粒体膜电位测定、线粒体呼吸链酶活性测定、有氧代谢和无氧代谢测定、mtDNA拷贝数测定、线粒体ROS水平测定、线粒体分裂与融合及细胞凋亡与线粒体外逸相关分子测定[26-31],但操作繁琐且需要特殊仪器/设备,而通过流式细胞仪表面染色的方法评估外周血淋巴细胞线粒体损伤情况,具有操作简便,对设备和技术要求低的优势,故本研究可为后续线粒体损伤相关研究提供新的测定方法。
本研究局限性:(1)仅纳入了SLE、RA、SS 3种常见的AID患者作为研究对象,而AID异质性较强,其他类型AID患者T淋巴细胞线粒体损伤情况仍需进一步研究;(2)研究指标较单一,仅通过MMP变化可能无法全面、客观反映线粒体损伤程度;(3)为横断面研究,线粒体损伤与AID的因果关系及其详细机制仍需大样本前瞻性研究进一步证实和探究。
综上,AID患者外周血T淋巴细胞线粒体存在一定程度的损伤,并可能为病情进展的重要因素之一。了解线粒体损伤对T淋巴细胞免疫反应的影响及其与AID发病机制的关系,对于疾病诊断、预防及治疗策略的制定均具有重要意义。未来研究中,应进一步阐明T淋巴细胞线粒体损伤诱发AID的详细分子机制,以期从分子水平上探寻AID发病机制,实现临床对该类疾病的精准诊疗。
参考文献
[1]Pisetsky DS. Pathogenesis of autoimmune disease[J]. Nat Rev Nephrol,2023,19:509-524.
[2]Aringer M, Costenbader K, Daikh D, et al. 2019 European League Against Rheumatism/American College of Rheumatology Classification Criteria for Systemic Lupus Erythe-matosus[J]. Arthritis Rheumatol,2019,71:1400-1412.
[3]Kay J, Upchurch KS. ACR/EULAR 2010 rheumatoid arthritis classification criteria[J]. Rheumatology,2012,51:vi5-vi9.
[4]Shiboski CH, Shiboski SC, Seror R, et al. 2016 American College of Rheumatology/European League Against Rheumatism Classification Criteria for Primary Sjögren's Syndrome: A Consensus and Data-Driven Methodology Involving Three International Patient Cohorts[J]. Arthritis Rheumatol, 2017,69:35-45.
[5]Soriano BL, Brenner D. Metabolism and epigenetics at the heart of T cell function[J]. Trends Immunol, 2023,44:231-244.
[6]Becker YLC, Duvvuri B, Fortin PR, et al. The role of mitochondria in rheumatic diseases[J]. Nat Rev Rheumatol, 2022,18:621-640.
[7]Chen PM, Tsokos GC. Mitochondria in the Pathogenesis of Systemic Lupus Erythematosus[J]. Curr Rheumatol Rep,2022,24:88-95.
[8]Clayton SA, MacDonald L, Kurowska SM, et al. Mitochondria as Key Players in the Pathogenesis and Treatment of Rheumatoid Arthritis[J]. Front Immunol,2021,12:673916.
[9]Faas MM, de Vos P. Mitochondrial function in immune cells in health and disease[J]. Biochim Biophys Acta Mol Basis Dis,2020,1866:165845.
[10]Jiao Y, Yan Z, Yang A. Mitochondria in innate immunity signaling and its therapeutic implications in autoimmune diseases[J]. Clin Exp Immunol,2023,14:1160035.
[11]Saadh MJ, Kazemi K, Khorramdelazad H, et al. Role of T cells in the pathogenesis of systemic lupus erythematous: Focus on immunometabolism dysfunctions[J]. Int Immunopharmacol,2023,119:110246.
[12]Shu P, Liang H, Zhang J, et al. Reactive oxygen species formation and its effect on CD4(+) T cell-mediated inflammation[J]. Front Immunol, 2023,14:1199233.
[13]Quintero GDC, Muñoz UM, Vásquez G. Mitochondria as a key player in systemic lupus erythematosus[J]. Autoimmunity,2022,55:497-505.
[14]Chávez MD, Tse HM. Targeting Mitochondrial-Derived Reactive Oxygen Species in T Cell-Mediated Autoimmune Diseases[J]. Front Immunol, 2021,12:703972.
[15]Weyand CM, Wu B, Huang T, et al. Mitochondria as disease-relevant organelles in rheumatoid arthritis[J]. Clin Exp Immunol, 2023,211:208-223.
[16]Gergely PJ, Grossman C, Niland B, et al. Mitochondrial hyperpolarization and ATP depletion in patients with systemic lupus erythematosus[J]. Arthritis Rheum, 2002,46:175-190.
[17]Wahl DR, Petersen B, Warner R, et al. Characterization of the metabolic phenotype of chronically activated lymphocytes[J]. Lupus,2010,19:1492-1501.
[18]Lee HT, Lin CS, Lee CS, et al. Increased 8-hydroxy-2'-deoxyguanosine in plasma and decreased mRNA expres-sion of human 8-oxoguanine DNA glycosylase 1, anti-oxidant enzymes,mitochondrial biogenesis-related proteins and glycolytic enzymes in leucocytes in patients with systemic lupus erythematosus[J]. Clin Exp Immunol, 2014,176:66-77.
[19]Lee HT, Lin CS, Pan SC, et al. Alterations of oxygen consumption and extracellular acidification rates by glutamine in PBMCs of SLE patients[J]. Mitochondrion,2019,44:65-74.
[20]Lee HT, Wu TH, Lin CS, et al. Oxidative DNA and mitochondrial DNA change in patients with SLE[J]. Front Biosci,2017,22:493-503.
[21]Warner LM, Adams LM, Sehgal SN. Rapamycin prolongs survival and arrests pathophysiologic changes in murine systemic lupus erythematosus[J]. Arthritis Rheum, 1994,37:289-297.
[22]Hajizadeh S, DeGroot J, TeKoppele JM, et al. Extracellular mitochondrial DNA and oxidatively damaged DNA in synovial fluid of patients with rheumatoid arthritis[J]. Arthritis Res Ther,2003,5:R234-R240.
[23]Li Y, Shen Y, Jin K, et al. The DNA Repair Nuclease MRE11A Functions as a Mitochondrial Protector and Prevents T Cell Pyroptosis and Tissue Inflammation[J]. Cell Metab,2019,30:477-492.e476.
[24]Yang Z, Fujii H, Mohan SV, et al. Phosphofructokinase deficiency impairs ATP generation, autophagy, and redox balance in rheumatoid arthritis T cells[J]. J Exp Med, 2013,210:2119-2134.
[25]Li N, Li Y, Hu J, et al. A Link Between Mitochondrial Dysfunction and the Immune Microenvironment of Salivary Glands in Primary Sjögren's Syndrome[J]. Front Immunol, 2022,13:845209.
[26]Mankowski RT, Wohlgemuth SE, Bresciani G, et al. Intraoperative Hemi-Diaphragm Electrical Stimulation Demons-trates Attenuated Mitochondrial Function without Change in Oxidative Stress in Cardiothoracic Surgery Patients[J]. Antioxidants (Basel),2023,12:1009.
[27]Yennemadi AS, Keane J, Leisching G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications[J]. Lupus,2023,32:603-611.
[28]Nanto HF, Yamazaki M, Murakami H, et al. Chronic heat stress induces renal fibrosis and mitochondrial dysfunction in laying hens[J]. J Anim Sci Biotechnol,2023,14:81.
[29]Zhang S, Lv Y, Luo X, et al. Homocysteine promotes atherosclerosis through macrophage pyroptosis via endoplasmic reticulum stress and calcium disorder[J]. Mol Med,2023,29:73.
[30]Ren X, Zhou H, Sun Y, et al. MIRO-1 interacts with VDAC-1 to regulate mitochondrial membrane potent ial in Caenorhabditis elegans[J]. EMBO Rep, 2023, 24:e56297.
[31]Clifton LA, Wacklin KHP, Ådén J, et al. Creation of distinctive Bax-lipid complexes at mitochondrial membrane surfaces drives pore formation to initiate apoptosis[J]. Sci adv,2023,9:eadg7940.


