Leukemia:华中科技大学梅恒/胡豫开发新的治疗方法,在复发或难治性多发性骨髓瘤中具有临床活性
时间:2023-10-22 23:34:07 热度:37.1℃ 作者:网络
多发性骨髓瘤(MM)包含异质性细胞,这对于单靶免疫疗法提出了挑战。
2023年10月17日,华中科技大学梅恒及胡豫共同通讯在Leukemia在线发表题为“Bispecific CS1-BCMA CAR-T cells are clinically active in relapsed or refractory multiple myeloma”的研究论文,该研究构建了双特异性的CS1-BCMA CAR-T细胞,旨在通过CS1增强BCMA靶向。共有16名复发或难治性(RR)MM患者接受了CS1-BCMA CAR-T细胞输注。六名患者(38%)出现了细胞因子释放综合症,其中31%为1-2级。未观察到神经毒性。最常见的严重不良事件是血液学方面的,包括白细胞减少(100%),中性粒细胞减少(94%),淋巴细胞减少(100%)和血小板减少(31%)。三名患有单一骨髓外疾病(sEMD)的患者未作出反应。
在中位随访246天后,有13名患者(81%)出现整体反应并达到最低残留病变阴性,其中6名(38%)达到严格完全缓解(sCR)。在13名应答者中,1年整体生存率和无进展生存率分别为72.73%和56.26%。有四名患者维持了sCR,中位持续时间为17个月。有四名患者出现BCMA+和CS1+复发或进展。一名患者在抗BCMA CAR-T治疗失败后出现了反应。CAR-T细胞在中位406天内持续存在。可溶性BCMA可作为效力监测的理想生物标志物。CS1-BCMA CAR-T细胞在RRMM患者中具有良好的安全性和临床活性。

双特异CAR-T细胞疗法已被提出,以缓解单一靶向CAR-T细胞的一些限制。CS1,也被称为CD319,SLAMF7和CRACC,是一种细胞表面糖蛋白,在多发性骨髓瘤(MM)患者的诊断和复发时高度表达。针对CS1的elotuzumab已获批准用于复发或难治性多发性骨髓瘤(RRMM)的治疗。关于BCMA靶向CAR-T细胞输注后一些复发患者不可逆的BCMA丧失,但其MM细胞保持CS1表达。因此,该研究的目标是在治疗MM中增强对BCMA的靶向。
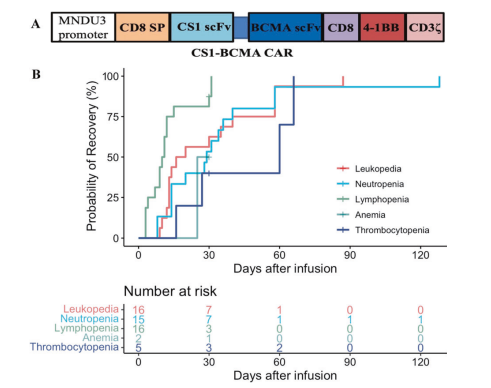
CS1-BCMA CAR结构示意图及3-4级细胞减少的恢复时间(图片源自Leukemia)
CS1靶向的CAR-T或CAR-NK细胞在体内和体外均具有强大且一致的抗骨髓瘤活性。然而,CS1在一部分正常淋巴细胞,包括NK、T和B细胞上表达。单一的CS1靶向CAR-T细胞表现出对CS1+/high正常淋巴细胞的选择性同胞杀伤,但保留了CS1-/low并保留了功能性淋巴细胞。具有两个完整独立CAR分别靶向BCMA和CS1的复合CAR-T细胞在MM小鼠模型中比单一靶向CAR-T细胞具有更卓越的抗骨髓瘤效果。串联的BCMA/CS1 CAR-T细胞与复合CAR-T细胞相比,具有更强的增殖能力且同胞杀伤较少。
受此启发,作者设计了一种串联的双特异性CS1-BCMA CAR,其中包含一种新型的抗-CS1单链抗体片段(scFv,克隆7A8D5)和一种新型的抗-BCMA scFv(克隆4C8A)。双特异性的CS1-BCMA CAR-T细胞在临床前研究中对靶向MM细胞非常有效。该研究报告了作者在作者的I期临床试验中(NCT04662099)对RRMM患者进行CS1-BCMA CAR-T细胞的初步安全性,疗效和体内动力学的研究。来那度胺(Lenalidomide)增强了对MM异种移植模型中CS1靶向CAR-T细胞的抗骨髓瘤活性和持久性。因此,在CS1-BCMA CAR-T细胞输注后,作者进一步推广了来那度胺的维持治疗。
BCMA可以通过γ-分泌酶直接从MM细胞表面剪切,形成可溶性BCMA(sBCMA)。sBCMA与骨髓中的肿瘤负担和疾病状态呈正相关,但与生存率呈负相关。与此同时,sBCMA的基线水平和早期变化可以预测MM患者的临床反应和预后。与抗-BCMA CAR-T细胞治疗后的响应者相比,PB中sBCMA的基线水平和早期变化更快地下降,而与非响应者相比,CS1也可以通过未知机制被脱落以形成可溶性CS1(sCS1)。sCS1通过与表面CS1的同源相互作用和随后的激活SH逆磷酸酶2(SHP-2)和ERK信号通路促进了MM细胞的生长。基线sCS1是elotuzumab治疗的预测生物标志物。作者在受治疗患者的PB和BM中纵向监测了sBCMA和sCS1的变化,以研究它们在CS1-BCMA CAR-T细胞治疗期间的预测价值。
原文链接:
https://doi.org/10.1038/s41375-023-02065-x


