肺癌顶级期刊丨EGFR/TP53共突变再遇到这些抑癌基因变异,TKI效果更差!
时间:2023-10-31 14:31:01 热度:37.1℃ 作者:网络
转移性EGFR突变NSCLC患者在接受TKI 治疗期间不可避免地出现疾病进展。共存的肿瘤抑制基因(TSG)变异与不良预后相关,但关于这些基因变异对患者预后影响的详细分析数据有限。本研究纳入了接受EGFR-TKIs治疗且有肿瘤基因组谱的EGFR突变NSCLC患者。通过TP53和另外5个TSGs(RB1、NF1、ARID1A、BRCA1和PTEN)变异将该队列分层为3个亚组:携带TP53突变和≥1个其他TSG突变(TP53mut/TSGmut)、携带TP53突变但无其他TSG突变(TP53mut/TSGwt)、TP53wt。在2个独立队列中评估了患者特征和临床预后。
101例患者来自耶鲁大学癌症中心,182例患者来自AACR Project GENIE数据库。在耶鲁大学队列中,有65例(64%)检测到TP53突变(其中23例为TP53mut/TSGmut, 42例为TP53mut/TSGwt)。虽然TP53突变的存在与较差的预后相关,但在Yale和GENIE队列中,TP53mut肿瘤中存在其他TSG变异与侵袭性特别强的疾病和更差的临床预后相关。具体来说,在接受一线TKI治疗的耶鲁大学队列中,TP53mut/TSGmut患者的PFS和OS均短于TP53mut/TSGwt患者(PFS:HR 2.03,CI 1.12-3.69,p<0.01;OS:HR 1.58,CI 0.82-3.04,P=0.12)或TP53wt患者(PFS:HR 2.4,CI 1.28- 4.47,P<0.001;OS:HR 2.54,CI 1.21-5.34,P<0.005)。在接受奥希替尼作为二线治疗的患者中,也观察到TP53mut/TSGmut患者的预后较差。
TP53mut/TSGmut患者代表了一个以侵袭性疾病表型和EGFR-TKIs治疗预后较差为特征的患者亚组。这一信息对于理解TKI治疗的不同预后的生物学基础非常重要,并且有助于识别需要奥希替尼单药治疗之外的其他治疗干预的患者。
研究背景
在NSCLC患者中,EGFR激活突变是最常见的可用药驱动突变。TP53体系突变是迄今为止与EGFR突变同时发生的最常见变异,发生率为55%~65%,几项临床研究已证实TP53突变是接受EGFR-TKI治疗患者的不良预测指标。然而,在TP53突变状态和临床预后之间的这一关联并非绝对的,数项较小的回顾性研究并未证实这一关联。因此,进一步研究EGFR/TP53共突变肿瘤及其突变可能具有重要意义。
与TP53不同,通常在不到10%的病例中发现其他TSGs变异,在EGFR突变NSCLC中,TP53以外的TSGs的功能和临床意义尚未得到充分研究。既往研究将某些TSGs(包括RB1、PTEN或ARID1A)变异与接受EGFR-TKI治疗患者的不良预后相关联,但EGFR突变NSCLC中这些其他TSGs的总体低突变率限制了这些研究。因此,了解多个TSGs变异所产生的影响可能有助于识别当前治疗获益有限的患者,阐明有待在分子水平上进一步研究的观察结果。
在这项研究中,研究者探索了在接受EGFR-TKIs治疗的EGFR突变NSCLC患者中,TSGs变异的临床影响,以确定在TP53突变状态的背景下,其他TSGs变异是否影响预后。
研究设计
本研究回顾性分析了2016-2021年期间在耶鲁大学癌症中心接受EGFR TKI一线治疗的IV期EGFR突变NSCLC患者。本研究纳入了对肿瘤组织或循环肿瘤DNA(ctDNA)进行了全面NGS或者肿瘤全外显子组测序(WES)的患者。收集所有患者的临床特征、PFS和OS。在诊断时(TKI治疗前)或一线EGFR-TKI耐药时(TKI治疗后)采集肿瘤或血液样本。其中34例患者获得了TKI治疗前后的配对样本(20对WES,14对NGS)。
在 AACR Project GENIE数据库中,本研究纳入了接受一线EGFR TKI厄洛替尼治疗并且可获得TKI治疗前或治疗后基因组数据的EGFR突变NSCLC患者。接受奥希替尼治疗的患者未被纳入研究,因为大多数这些患者之前接受过(靶向EGFR)全身治疗。182例患者有可获得的有关TSG变异的基因组数据,174例患者有可获得的肿瘤突变率(基因变异数/相应NGS panel中检测的基因数)。
研究结果
临床特征:
本研究共确定了101例在耶鲁大学癌症中心接受一线TKI治疗,并接受了肿瘤基因组分析的 IV期EGFR突变NSCLC患者。表1列出了该队列的临床特征。大多数患者携带EGFR 19del(57例,56%)或L858R突变(30例,30%)。复合突变和其他罕见突变分别见于10例(10%)和4例(4%)患者中。68例(67%)接受第1或第2 代TKI治疗和33例(33%)接受第3代TKI奥希替尼治疗作为一线EGFR-TKI。21例患者在第1或第2代TKI治疗进展后,接受奥希替尼作为二线EGFR-TKI治疗。37例患者在EGFR-TKI治疗前进行了肿瘤基因组测序,64例患者在TKI治疗发生原发或获得性耐药时进行了肿瘤基因组测序。在携带TP53突变(N=65,64%)和无TP53突变的患者之间,基线人口统计学数据无差异(表1)。值得注意的是,EGFR 19号外显子缺失突变的肿瘤比L858R突变或复合突变的肿瘤更常见TP53突变(63% vs 31% vs 3%,P=0.013,表1)。TP53突变还与基线肝转移相关(34% vs 14%,P= 0.03)。另外,本研究纳入了182例接受厄洛替尼作为一线EGFR TKI的EGFR突变NSCLC患者,这些患者接受了肿瘤基因组分析,是来自AACR Project Genie数据库的一个独立队列。在这一队列中,TP53mut和TP53wt病例的基线人口统计学数据无差异。

表1
EGFR/TP53突变肿瘤显示出独特的突变谱:
鉴于EGFR突变肿瘤通常携带TSGs共变异,研究者试图研究是否存在TSGs更频繁与TP53共变异的模式。因此,研究者首先查询了AACR GENIE数据库中接受EGFR-TKI治疗的EGFR突变NSCLC患者队列。研究者关注了TP53之外的其他TSGs,包括本研究中所有基因组panel均覆盖的基因:ARID1A、ATM、BRCA1、CDKN2A、NF1、PTEN、RB1、SMAD4和STK11。在这些TSGs中,研究者发现与TP53wt肿瘤相比,在TP53mut肿瘤中,RB1、ARID1A、BRCA1、NF1和PTEN的突变频率更高(图1A)。重要的是,TP53mut病例中,这5个额外TSGs中有≥1个发生变异的频率显著高于TP53wt病例中的(18.1% vs 6.1%,P=0.025,图1A)。同样,在耶鲁大学队列中,TP53mut肿瘤中这些TSGs(BRCA1除外)的突变频率较高(图1B),且与TP53wt肿瘤相比,TP53mut肿瘤中这5个额外TSGs中有≥1个发生变异的数量更多,但这一差异未达到统计学显著性(35% vs 19%,P=0.19,图1B)。值得注意的是,在两个队列中,在TP53wt肿瘤中ATM变异更为常见。
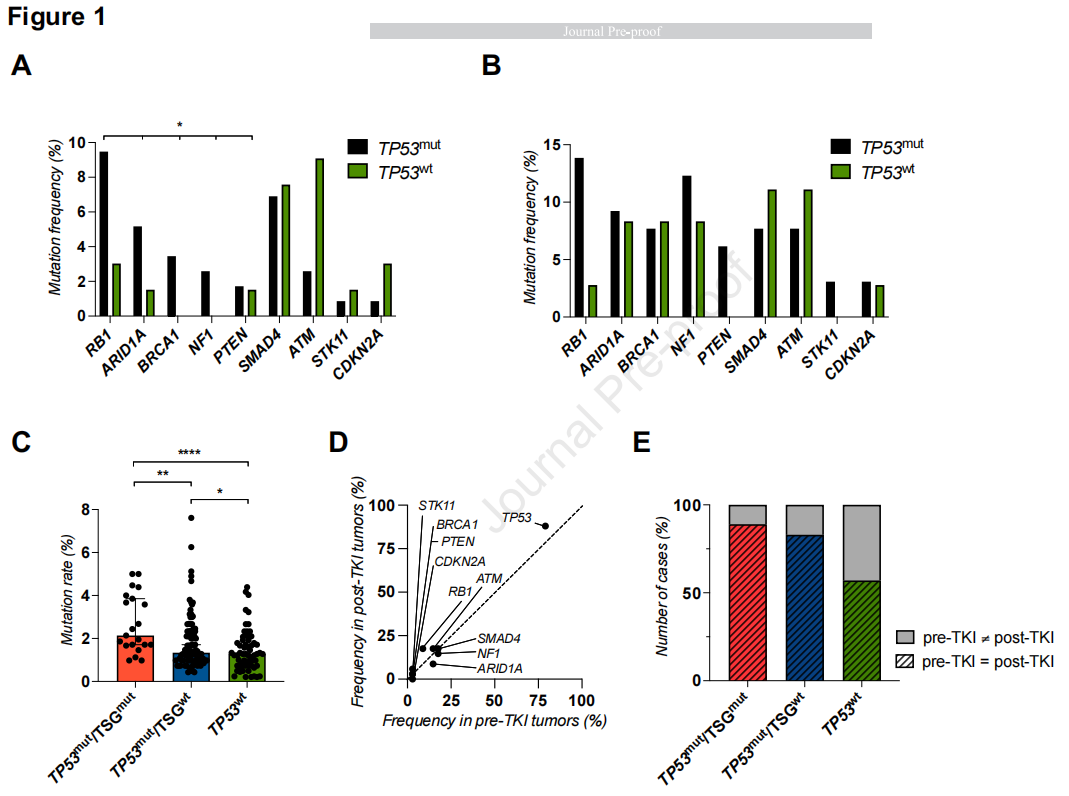
图1
鉴于观察到的这5个额外TSGs(RB1、ARID1A、BRCA1、NF1和PTEN)的关联,研究者决定在EGFR/TP53共突变肿瘤的背景下进一步研究它们。此外,之前的研究表明,在EGFR突变NSCLC中,这些TSGs与治疗耐药或更差预后相关。研究者将耶鲁大学队列和GENIE队列分为以下3组:TP53mut和≥1个这额外TSGs变异(TP53mut/TSGmut)、TP53mut和无这5个额外TSGs变异(TP53mut/TSGwt)、TP53wt。在GENIE队列中,TP53mut/TSGmut的中位肿瘤突变率显著高于TP53mut/TSGwt(2.1 vs 1.3个突变/Mb,P=0.003)或TP53wt(2.1 vs 1.3个突变/Mb,P<0.0001)(图1C)。
接下来,研究者研究了TSG变异是否在EGFR-TKI治疗期间获得或在治疗之前存在。在该机构接受治疗的患者中,对TKI治疗前和治疗后的配对肿瘤样本(N=34)进行了基因组测序,发现TSG变异(测序检测涵盖的全部9个TSGs)的频率无显著差异(图1D)。在本研究详细调查的另外5个TSGs中,只有RB1在TKI治疗后的样本中更常发现(18% vs 9%),但这种差异无统计学意义。重要的是,在TKI治疗前后配对的肿瘤标本中,大多数病例(79%)被一致地分为TP53mut/TSGmut、TP53mut/TSGwt或TP53wt,其中TKI治疗前后的TP53mut/TSGmut病例的一致率最高(89%)(图1E)。
在EGFR突变NSCLC中,TP53突变多发生在DNA结合域:
为了更好地表征EGFR突变NSCLC中的TP53突变,研究者比较了两个研究队列中TP53突变的分布。在耶鲁大学队列中纳入的TP53mut肿瘤中,大多数TP53突变(80%)发生在密码子100~300之间的DNA结合结构域(DBD),且DBD相关突变以错义突变(79.7%)、无义突变(10.9%)和移码突变(7.8%)为主。在11例患者(17%)中发现了多个TP53变异。在GENIE队列中,研究者发现了类似的分布:大多数TP53突变发生在DBD(87%),这些突变大多数是错义(74.8%)、移码(9.7%)和无义(5.8%)突变。2例(1.7%)患者存在TP53基因多位点变异。值得强调的是,在耶鲁大学和GENIE队列的TP53mut/TSGmut病例中,TP53突变的分布相似:在TP53mut/TSGmut病例中,大多数TP53突变发生在DBD(耶鲁:84%,GENIE:91%),其中错义突变最常见(耶鲁:85%,GENIE:75%)。
在EGFR突变NSCLC中,TP53突变和TSG变异共发生与侵袭性疾病表型相关:
接下来,研究者假设TP53mut/TSGmut亚组可能具有不同的临床病理特征。在耶鲁大学队列中比较了TP53mut/TSGmut、TP53mut/TSGwt或TP53wt肿瘤患者的相关临床特征,发现组间差异无统计学意义(表1)。然而,TP53mut/TSGmut肿瘤在一线EGFR-TKI治疗时的原发疾病进展率高于TP53mut/TSGwt或TP53wt肿瘤患者(21.7% vs 6.4% vs 8.4%,P=0.08,图2A)。疾病进展时,尽管各组受累器官部位的模式无显著差异(图2B),但与TP53mut/TSGwt或TP53wt肿瘤患者相比,TP53mut/TSGmut肿瘤患者发生较广泛进展(定义为≥3个器官进展)的可能性显著较高(40.9% vs 15.8% vs 2.9%,P=0.0009,图2C)。
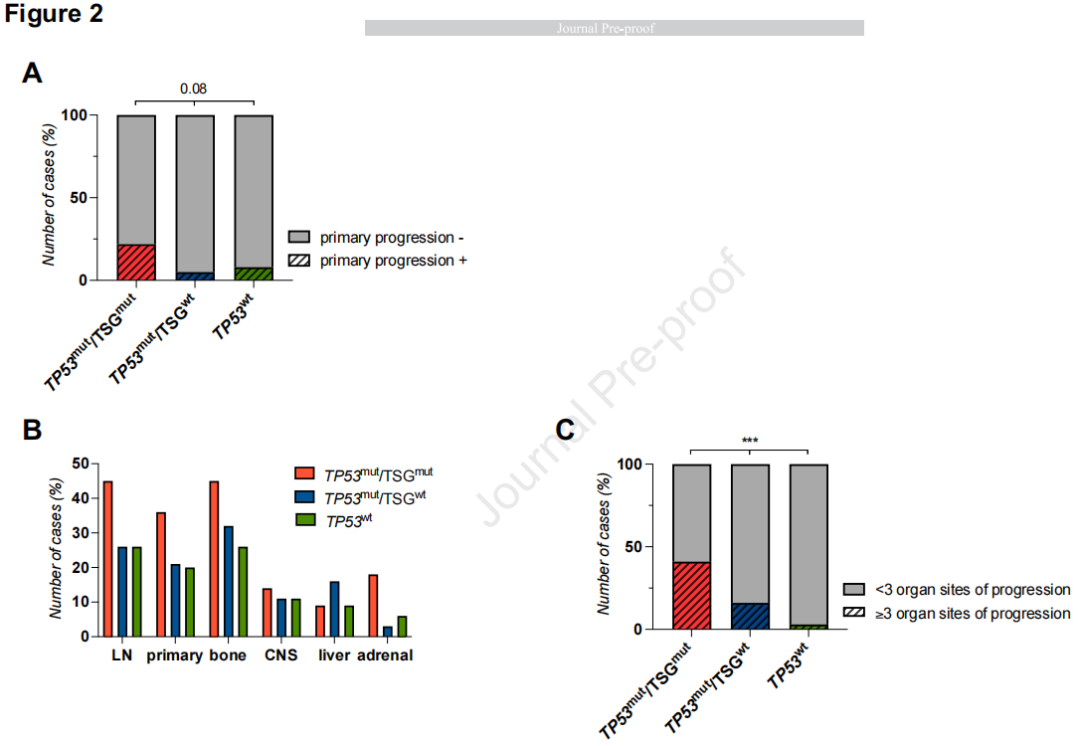
图2
接下来,研究者旨在确定在一线TKI治疗中是否观察到组间预后的差异。与之前的报告相似,在耶鲁大学队列中,与TP53wt肿瘤患者相比,TP53mut肿瘤患者一线TKI治疗的OS较短,PFS有较短的趋势(中位OS:30.2个月vs 48.8个月,HR 1.68, CI 1.05-2.70, P=0.035;中位PFS:8.6vs 12.6个月,HR 1.46, CI 0.97-2.21, P=0.09)。在TP53突变的病例中,错义突变、无义突变和移码突变病例的预后无差异(PFS:P=0.61, OS:P=0.71)。
重要的是,将TP53mut患者分为TP53mut/TSGmut组和TP53mut/TSGwt组后,TP53mut/TSGmut患者的一线EGFR-TKIs疗效明显差于TP53mut/TSGwt患者(中位PFS:8.0 vs 10.6个月,HR 2.03, CI 1.12~3.69, P=0.006;中位OS:30.0个月vs 33.3个月,HR 1.58, CI 0.82-3.04, P=0.12)或TP53wt肿瘤(中位PFS:8.0个月 vs 12.6个月,HR 2.4, CI 1.28-4.47, P<0.0001;中位OS:30.0 vs 48.8个月,HR 2.54, CI 1.21-5.34, P=0.0013,P=0.001)(图3A和图3B)。TP53mut/TSGwt患者与TP53wt患者的PFS和OS差异无统计学意义(P=0.49,P=0.21)。使用多变量Cox回归分析,在控制其他临床病理参数后,TP53mut/TSGmut状态与EGFR TKI治疗中较差的PFS(HR 2.19,CI 1.24-3.87,P=0.007)和OS (HR 2.29,CI 1.23-4.25,P=0.009)独立相关(表2),进一步强调了在EGFR/TP53突变的NSCLC中同时发生TSG变异的强大预测能力。

图3
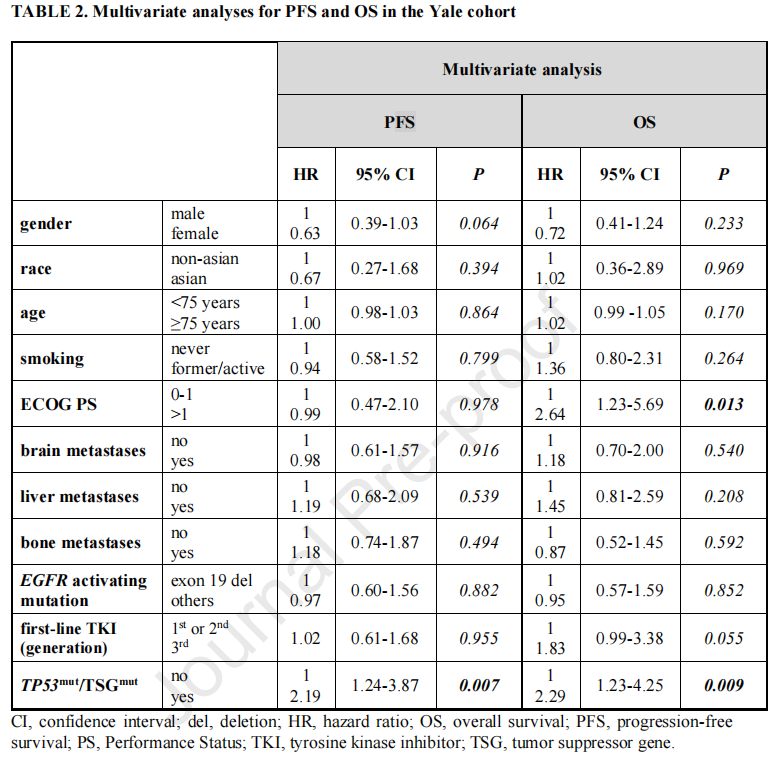
表2
在二线接受奥希替尼治疗的患者中(N=21),TP53突变状态与PFS或OS均无显著相关性(TP53mut vs TP53wt:中位PFS 3.7 vs 10.0个月,HR 292 1.50, CI 0.60~3.73, P=0.36;中位OS 17.5个月 vs 30.6个月,HR 1.42, CI 0.56-3.59, P=0.43)。然而,与接受一线TKI治疗患者的结果一致,接受二线TKI治疗的TP53mut/TSGmut患者的PFS显著较短于TP53mut/TSGwt患者(中位PFS 1.6 vs 7.7个月, HR 5.93, CI 0.76-46.33, P<0.001; 中位OS 10.2 vs 28.3个月, HR 2.61, CI 0.56-12.19, P=0.098)和TP53wt患者(中位PFS 1.6 vs 10.0个月, HR 4.27, CI 0.66-27.47, P=0.003; 中位OS 10.2 vs 30.6个月, HR 5.08, CI 0.70-36.81,P=0.002)(图3C和图3D)。同样,TP53mut/TSGwt和TP53wt肿瘤患者的PFS和OS无显著差异。重要的是,T790M突变在三组间的分布相对相似(TP53mut/TSGmut:75%,TP53mut/TSGwt:88%,TP53wt:78%)。
为了确定在TP53wt肿瘤中,突变仅发生这5个TSGs是否预示较差的预后,研究者将TP53wt亚组细分为TP53wt/TSGmut和TP53wt/TSGwt 。虽然受样本量小的限制,但在TP53wt亚组中,额外的TSG变异与较差的PFS或OS不相关。总之,这项分析表明,在EGFR/TP53突变肿瘤中,额外特定的TSG变异影响PFS和OS。
为了在一个独立队列中研究TP53/TSG共变异对EGFR突变NSCLC患者预后的影响,研究者对AACR GENIE队列进行了类似的分析。关于OS和PFS分析,研究者分别获得了179例和155例患者的数据。正如在耶鲁大学队列中观察到的那样,TP53突变状态与OS相关(TP53mut vs TP53wt:中位OS 29.1个月vs 54.2个月,HR 1.99, CI 1.36-2.91,P=0.001),并在较小程度上与PFS相关(TP53mut vs TP53wt:中位PFS 7.3个月vs 9.6个月,HR 1.41, CI 0.99-1.98, P=0.059)。然而,与TP53mut/TSGwt患者(中位PFS 2.5 vs 7.7个月,HR 2.33, CI 1.11 317-4.90,P=0.001)或TP53wt患者(中位PFS 2.5 vs 9.6个月,HR 2.55, CI 1.19-5.49,P=0.0006, P<0.001)相比,TP53mut/TSGmut患者的PFS显著较短(图4A)。TP53mut/TSGwt与TP53wt患者的PFS差异无统计学意义(P=0.20)。对于OS,虽然在数值上不同,但TP53mut/TSGmut患者与TP53mut/TSGwt患者(中位OS 25.0个月 vs 31.6个月,HR 1.30, CI 0.72-2.36,P=0.34)或TP53wt肿瘤患者(中位OS 25.0个月 vs 54.2个月,HR 322 2.65, CI 1.22-5.75,P=0.001)之间的差异并非均具有统计学显著性(图4B)。TP53mut/TSGwt组和TP53wt组患者的中位OS分别为31.6和54.6个月,差异有统计学意义(HR 1.87, CI 1.24-2.81,P=0.005)。
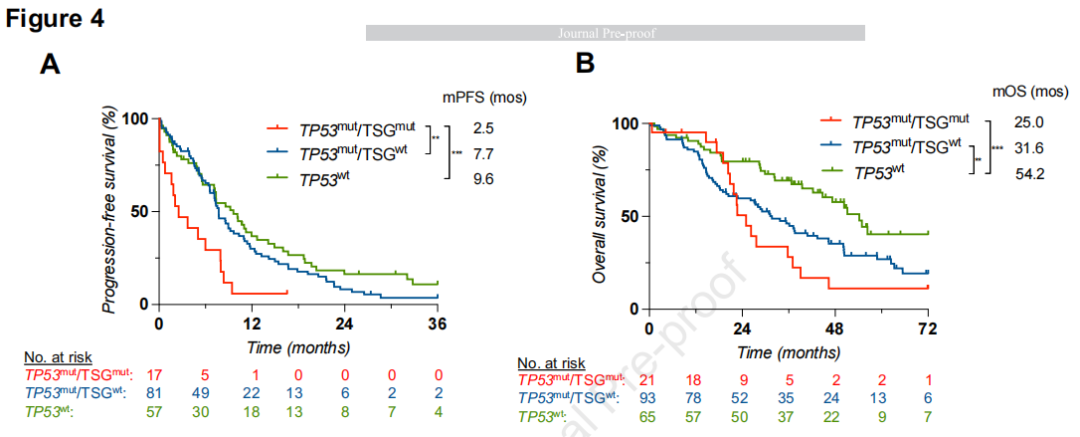
图4
在不同EGFR突变NSCLC中,TP53突变和TSG变异共发生与预后不良相关:
为了研究不同的EGFR激活突变是否影响这些观察到的预后模式,研究者对19号外显子缺失和L858R病例进行了亚组分析。考虑到基于EGFR激活突变分层后样本量较小,因此研究者合并了两个队列。在19号外显子缺失组中,TP53mut/TSGmut、TP53mut/TSGwt和TP53wt三组患者的PFS和OS差异仍然存在:TP53mut/TSGmut患者的预后差于TP53mut/TSGwt患者(中位PFS 5.0 vs 9.6个月,HR 2.23,CI 1.14-4.36,P=0.001;中位OS 30.0个月对36.1个月,HR 1.88, CI 0.95-3.73, P=0.02)或TP53wt肿瘤(中位PFS 5.0 331个月 vs 10.7个月,HR 2.65, CI 1.30 -5.40,P=0.0001;中位OS 30.0 vs 51.8个月,HR 4.27, CI 1.72-10.59,P<0.0001)。在L858R组中,三组间PFS差异仍有统计学意义:TP53mut/TSGmut组较TP53mut/TSGwt组(中位PFS 2.5个月 vs 7.4个月,HR 2.32, CI 1.13-4.75,P=0.002;中位OS 25.0个月 vs 26.1个月,HR 1.00, CI 0.54-1.87,P=0.99)或TP53wt(中位PFS 2.5个月 vs 8.6个月,HR 2.25,CI 1.10-4.59,P=0.004;中位OS 25.0 vs 44.7个月,HR 1.50, CI 0.73-3.06,P=0.23)的PFS更短,但OS无显著统计学意义。综上所述,本研究数据表明,携带额外特定TSGs变异的肿瘤代表了一组EGFR-TKIs治疗预后较差的患者人群。
讨 论
虽然在改善转移性EGFR突变NSCLC患者预后方面取得了显著进展,但患者不可避免地在接受EGFR-TKIs治疗后出现疾病进展。此外,EGFR-TKIs的缓解持续时间存在显著差异,这凸显出需要确定预后较差的患者亚群,这些患者可能从更积极的治疗中获益。虽然TSGs共变异被描述为分子和临床异质性的决定因素,但详细的预后分析数据有限。在本研究中,调查了2个接受EGFR-TKIs治疗的EGFR突变NSCLC患者队列,结果表明,伴有特定TSGs共变异的EGFR/TP53突变患者代表了一个亚组,其特征是侵袭性疾病表型和EGFR-TKIs治疗的不良预后。
在研究的两个队列中,64%的肿瘤携带TP53变异,这与之前的研究相似。TP53基因突变主要发生在DBD第100~300位密码子之间,且以错义突变为主。DBD外的突变几乎均为无义突变或移码突变。这一观察到的TP53变异模式与之前在人类癌症中研究TP53突变的研究一致。在DBD处的变异导致TP53的DNA结合能力丧失,从而失去其主要的肿瘤抑制功能。此外,TP53的几个热点突变是功能获得性变异,使突变型p53蛋白具有额外的致癌功能。在GENIE队列中,研究者在TP53中发现了至少13个与功能获得性表型相关的变异,但它们在EGFR突变NSCLC中的作用仍然未知。研究者发现,TP53mut与TP53wt肿瘤中观察到的相比,具有较高的总突变率,这与之前的报道一致。之前对EGFR突变NSCLC的基因组研究表明,TP53变异发生在肿瘤发生过程中的早期,因此可能增加基因组不稳定性和对额外基因变异的耐受性。
TP53突变在EGFR突变NSCLC中的作用是之前研究的主要焦点,但关于在EGFR-TKI治疗背景下,其他TSG变异对EGFR驱动肺癌的影响的知识有限。因此,研究者分析了治疗前后配对肿瘤标本的代表性队列,重点关注TSGs变异。在本研究中,研究者所研究的TSGs的总变异频率在EGFR-TKI治疗前和治疗后的配对肿瘤标本之间没有观察到显著差异。虽然TP53和RB1的变异频率在疾病进展时略高,但目前尚不清楚这些变异是在TKI治疗期间新出现的,还是在诊断性肿瘤标本中未被NGS检测到。最近一项对EGFR突变NSCLC患者配对样本的分析同样发现,TP53突变不仅是治疗前的躯干突变,而且有一些是TKI治疗期间的亚克隆。与TP53不同,研究者发现RB1变异一致存在于未经治疗的肿瘤样本。在一项更大规模的研究中,与使用EGFR-TKI治疗前的样本相比,在EGFR-TKI治疗进展时获得的肿瘤样本中,TP53和NF1共变异更常见,然而,该研究未包括配对对样本。总之,未来需要对更大的配对肿瘤队列进行分析,以进一步研究在TKI治疗的背景下,EGFR突变NSCLC中TSG变异。
研究者发现,与EGFR/TP53wt肿瘤相比,EGFR/TP53突变肿瘤发生TP53以外的其他TSGs变异更有可能。这些其他TSGs包括NF1、RB1、PTEN、ARID1A和BRCA1。在EGFR突变的NSCLC中,除TP53之外的TSGs变异发生率不到10%,因此,对特定TSGs的功能和预后分析大多局限于TP53。然而,之前的一些研究表明部分TSGs在EGFR突变NSCLC中具有潜在作用。例如,NF1低表达通过上调RAS-MAPK信号与TKI耐药相关,而NF1低表达的肿瘤与TKI的原发性和获得性耐药相关。TP53/RB1共突变肿瘤富集全基因组倍增,并且与组织学小细胞转化相关。PTEN缺失也被证明是导致TKI耐药的原因。虽然BRCA1或ARID1A在EGFR突变NSCLC中的潜在功能性作用仍有待确定,但与T790Mwt耐药肿瘤相比,BRCA1变异更常见于EGFR T790Mmut耐药肿瘤,而且最近的一篇综述提示,在EGFR突变NSCLC中,ARID1A缺失可能促进上皮-间质转化并激活PI3K-AKT信号通路。重要的是,已知这些TSGs中有一些参与细胞周期调节和/或DNA修复,并且在EGFR-TKIs治疗的疾病进展时,肿瘤样本中细胞周期通路相关基因变异频率的增加更为常见。本研究结果与之前的研究一致,即在EGFR突变NSCLC中,TP53和其他TSGs共变异与细胞周期失调增强和/或DNA损伤修复降低有关,从而使肿瘤细胞对进一步的基因变异产生耐受性。在TP53突变肿瘤中,研究者发现TP53mut/TSGmut肿瘤的突变率显著高于TP53mut/TSGwt肿瘤。突变负荷的这种差异是由于这些额外的TSG变异,还是TSG变异是突变率增加的结果,需要进一步研究。
尽管有临床前证据表明这些不同的TSGs在EGFR突变NSCLC中具有功能作用,但在EGFR突变NSCLC中,鉴于TSGs变异的总体发生率较低,因此研究TSGs变异对EGFR-TKI的PFS和OS影响的研究主要集中在TP53。
重要的是,在本研究中,研究者证明了这些额外的TSGs变异与侵袭性疾病表型和EGFR-TKIs治疗预后较差相关。这些结果在两个独立的EGFR突变NSCLC患者队列和19号外显子缺失和L858R突变患者中一致。此外,TP53mut/TSGmut突变状态的预后作用独立于其他已知的不良预后因素,包括脑转移和肝转移,以及较差的体能状态。TP53突变和其他TSGs突变在导致不良预后方面的相对作用需要在未来更大规模的研究中确定。TSGs共变异与NSCLC的不良预后相关。Zhang等人发现在TP53、STK11 416或MGA中携带≥2个共突变的东亚肺腺癌患者预后特别差。另外一项研究强调了其他TSGs变异的重要性,该研究表明,与TP53突变病例相比,伴有TP53/RB1共突变的EGFR突变患者的治疗停药时间更短。与上述发现一致,最近的一项研究发现,TP53与细胞周期相关基因(CDK4、CDK6、MDM2、CDKN2A和CDKN2B等)共变异的患者接受EGFR-TKIs治疗后的预后不良。除了较差的临床预后外,研究者还发现TP53mut/TSGmut患者比TP53wt和TP53mut/TSGwt患者更具侵袭性的疾病表型,EGFR-TKIs更难治,并且在疾病进展时,与更播散的疾病进展模式相关。与本研究结果一致,Zhang等人证明,在所有与致癌驱动因素无关的肺腺癌中,携带两种TSG共变异的患者在疾病复发时更有可能发生多处转移。
本研究有几个局限性,包括回顾性设计和相对较低的样本量。由于样本量低和其他TSG变异频率低,研究者无法分离出每种TSG对临床预后的影响。此外,尽管以前的研究发现基于组织和基于ctDNA的测序一致率为90%,但本研究中纳入的患者要么有基于组织的测序数据,要么有基于ctDNA的测序数据。此外,本研究包括了治疗期间不同时间点的患者测序数据,因为研究者发现在TKI治疗前后配对的样本中,TSG分析的一致性很高(TSG)。奥希替尼目前被广泛用作EGFR突变NSCLC患者的一线TKI,然而,纳入本研究的大多数患者(耶鲁大学队列的66%,GENIE队列的100%)接受的是第一代或第二代EGFR-TKI治疗。本研究纳入的所有患者接受了EGFR-TKI治疗,因此目前尚不清楚TSG变异的影响是预后还是预测结果作用。然而,研究者对两个独立队列的EGFR突变NSCLC患者的分析确定了EGFR/TP53突变和特定TSG共变异与侵袭性疾病表型和EGFR-TKI不良预后相关。这些发现可能对理解TKI在EGFR突变患者中产生不同预后的生物学基础,以及选择患者接受奥希替尼单药治疗之外的替代或更积极的干预具有重要意义。
参考文献:
Stockhammer, Paul et al. “Co-occurring Alterations in Multiple Tumor Suppressor Genes are Associated with Worse Outcomes in Patients with EGFR-mutant Lung Cancer.” Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer, S1556-0864(23)02264-5. 6 Oct. 2023, doi:10.1016/j.jtho.2023.10.001



