STTT 中南大学湘雅二医院刘海丹团队发表综述《心血管疾病中的RNA修饰:对治疗干预的启示》
时间:2023-11-19 06:21:58 热度:37.1℃ 作者:网络
心血管疾病多发于40岁以上的成年人,是全球死亡的首要原因,近年来有年轻化的趋势,造成了巨大的全球疾病负担。机制研究可以加深对疾病的认识,为寻找新的诊疗靶点、发现新的治疗药物和开发新的治疗策略提供理论依据。心血管疾病发生发展的具体机制仍未阐释清楚,还有大量的未知领域亟待研究人员的探索。近年来,大量研究探索了RNA修饰在心血管疾病发生发展中的机制及其在临床治疗干预中的潜在应用前景。
2023年10月27日,中南大学湘雅二医院心血管外科临床基因诊断治疗中心刘海丹团队在Signal Transduction and Targeted Therapy杂志发表了题为“RNA modification in cardiovascular disease: implications for therapeutic interventions”的综述文章。该综述详细介绍了常见RNA修饰及其机制,系统回顾了RNA修饰在心血管系统疾病中的作用,总结了基于RNA修饰治疗心血管疾病的基础和应用前景,为进一步研究RNA修饰在疾病发生发展及治疗中的作用提供了新思路。

RNA修饰是一种广泛存在于哺乳动物的化学修饰(图1),半个世纪以来随着技术的发展和进步,超过100种RNA修饰的神秘面纱逐渐被揭示。研究人员已经发现一些RNA修饰具有特定的生物学作用,在细胞生长分化、器官发育和疾病发生发展中发挥着不可或缺的作用。RNA修饰是一个动态的、可逆的过程,主要由“Writer”书写器、“Eraser”擦除器和“Reader”读取器三类关键蛋白调控,它们也被并称为RNA修饰“Regulator”。其中,“Writer”和“Eraser”通常为作用完全相反的催化酶,负责形成或者去除化学修饰。例如,“Writer” METTL3催化形成m6A,“Eraser” FTO去除RNA中的m1A和m6A修饰,“Eraser” ALKBH1将m5C修饰氧化成hm5C或f5C等其他修饰。“Reader”通过识别化学修饰并与RNA结合,来调控RNA代谢或功能,包括但不限于RNA加工、出核、稳定性、降解和mRNA翻译。
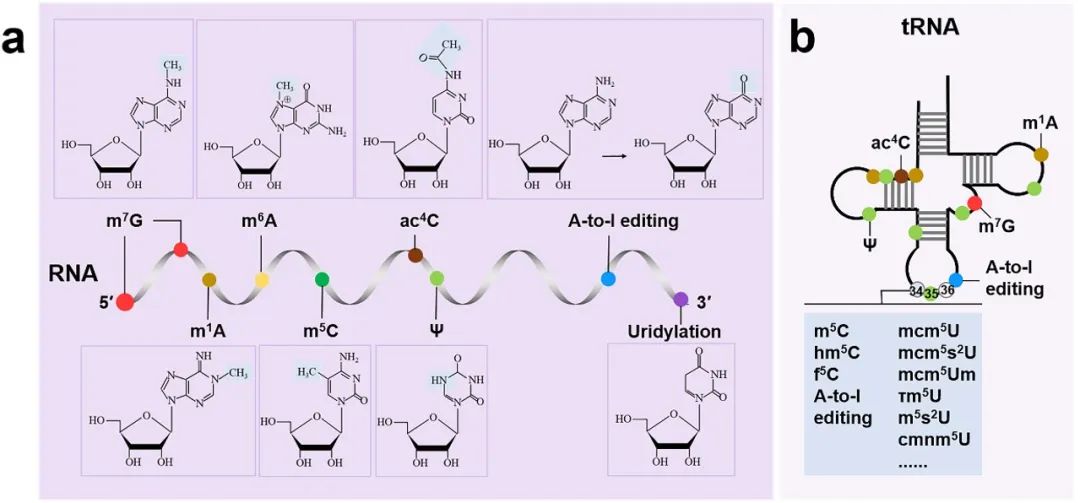
图1. 哺乳动物中的RNA修饰
本文全面综述了m6A、m1A、m5C和m7G甲基化、ac4C乙酰化、尿苷化、假尿苷(Ψ)、腺苷-肌苷RNA编辑(adenosine-to-inosine editing, A-to-I editing)和tRNA的U34修饰(wobble uridine 34)及其生物学功能。重点介绍了这些RNA修饰在高血压、动脉粥样硬化和冠心病、心肌病、心衰、肺动脉高压、心律失常等心血管疾病中的作用(图2)。并基于心血管疾病治疗的主要原则,从细胞生物学的角度,指明了RNA修饰用于治疗的方向和应用前景。例如,如何通过干预RNA修饰来抑制炎症反应、减少心肌细胞的丢失和抑制细胞损伤,如何通过干预RNA修饰来促进心肌细胞再生和修复。心血管疾病的治疗一直以来是世界性难题,可喜的是,随着技术发展和研究深入,基于RNA修饰的策略在治疗心血管疾病中展现出了一定的效果,一些临床试验也在积极开展中。目前报道的RNA修饰“Regulator”的抑制剂或激动剂极其有限,发现或者开发直接靶向“Regulator”的药物也极具前景。

图2. 心血管疾病中的RNA修饰
尽管RNA修饰在心血管疾病中的研究取得了一定的进展,该综述强调RNA修饰的复杂性和一些未解决的争议问题。首先,RNA修饰是一个动态的过程。一方面,细胞内外环境变化都可能引起RNA修饰的改变,另一方面,RNA修饰具有一定的可逆性。第二,RNA修饰的特异性,主要体现为“Regulator”的底物特异性和细胞/组织特异性。第三,RNA修饰之间可能存在错综复杂的交互作用。不同的RNA修饰不仅可共用同一个“Regulator”。例如,FTO是m6A和m1A修饰的“Eraser”,YTHDF2是m6A和m5C修饰的“Reader”。而且,RNA修饰之间存在相互调控作用。期待未来有更多的研究能够突破这些难题。
中南大学湘雅二医院心血管外科博士研究生王聪为第一作者,中南大学湘雅二医院刘海丹研究员以及中南大学湘雅三医院李伟副研究员为该论文的共同通讯作者。该工作得到了国家自然科学基金、湖南省自然科学基金的资助。
原文链接:
https://www.nature.com/articles/s41392-023-01638-7


