Nat Commun:MSK经验分享:肿瘤和匹配正常样本综合突变谱MSK-IMPACT Heme可加强对血液肿瘤的临床评估
时间:2023-11-29 20:30:06 热度:37.1℃ 作者:网络
近年来,基因测序的临床应用使血液肿瘤的诊治趋于精准化,某些基因如激酶类突变、转录因子突变、表观遗传类突变的存在不但可以帮助确定治疗方案,还有助于预测药物疗效。
与成功实现大规模前瞻性实体瘤分子分析的工作流程不同,对血液肿瘤体细胞突变的评估存在独特的挑战,例如缺乏可操作的与患者匹配的正常对照,影响变异等位基因频率(VAF)的拷贝数改变经常发生,因此该指标无法可靠地区分体细胞起源与胚系起源。
近日,美国纪念斯隆-凯特琳癌症中心(MSKCC)研究团队通过展示MSK-IMPACT Heme的开发和临床经验分享了应对上述独特挑战的经验。MSK-IMPACT Heme是针对血液肿瘤可操作靶点的综合突变谱,是通过基于杂交捕获和高覆盖率的NGS分析平台获得的肿瘤和匹配正常DNA获得体细胞突变的综合数据集。
结果表明,对肿瘤和匹配的正常样本进行大规模测序在血液肿瘤中是可行的,可用于指导血液肿瘤患者的诊断、预后、治疗选择和未来监测。该成果已发表在Nature Communications上,文章题为“Enhanced clinical assessment of hematologic malignancies through routine paired tumor and normal sequencing”。

文章发表在Nature Communications
不同胚系标志物的前瞻性临床测序及应用
研究团队开发了MSK-IMPACT Heme以靶向400个已知参与血液肿瘤病理生物学的基因,这些基因被用于血液肿瘤的诊断和预后,并且是实验性或已批准治疗药物的靶点。为了准确地识别血液肿瘤的体细胞突变,研究人员使用唾液和指甲作为胚系DNA来源(图1a)。在一系列等位基因频率(范围0.02-0.97)内,该突变检测对113个样本中的278个已知突变具有100%的敏感性和100%的特异性。
研究团队对来自1937名患者的2383个肿瘤样本进行了测序,涉及85种不同的血液肿瘤(图1b)。其中,1602份(67%)与指甲DNA匹配,664份(28%)与唾液DNA匹配,27份(1%)与两者都匹配。对于同种异体干细胞移植后进行测序来自48例患者的67个(3%)样本,来自非肿瘤组织的宿主和供体DNA都被测序作为比较(图1d)。
研究人员根据疾病形态观察到唾液和指甲中不同水平的体细胞肿瘤突变。在指甲样本中检测到的突变几乎在所有病例中都发现了高肿瘤:指甲VAF比率(中位数为8;范围为1.5-38),支持了指甲对照样本用于破译肿瘤患者样本中检测到的胚系与体细胞变异具有一定效用,唾液在髓系肿瘤中作为胚系对照的作用有限(图1e-g)。
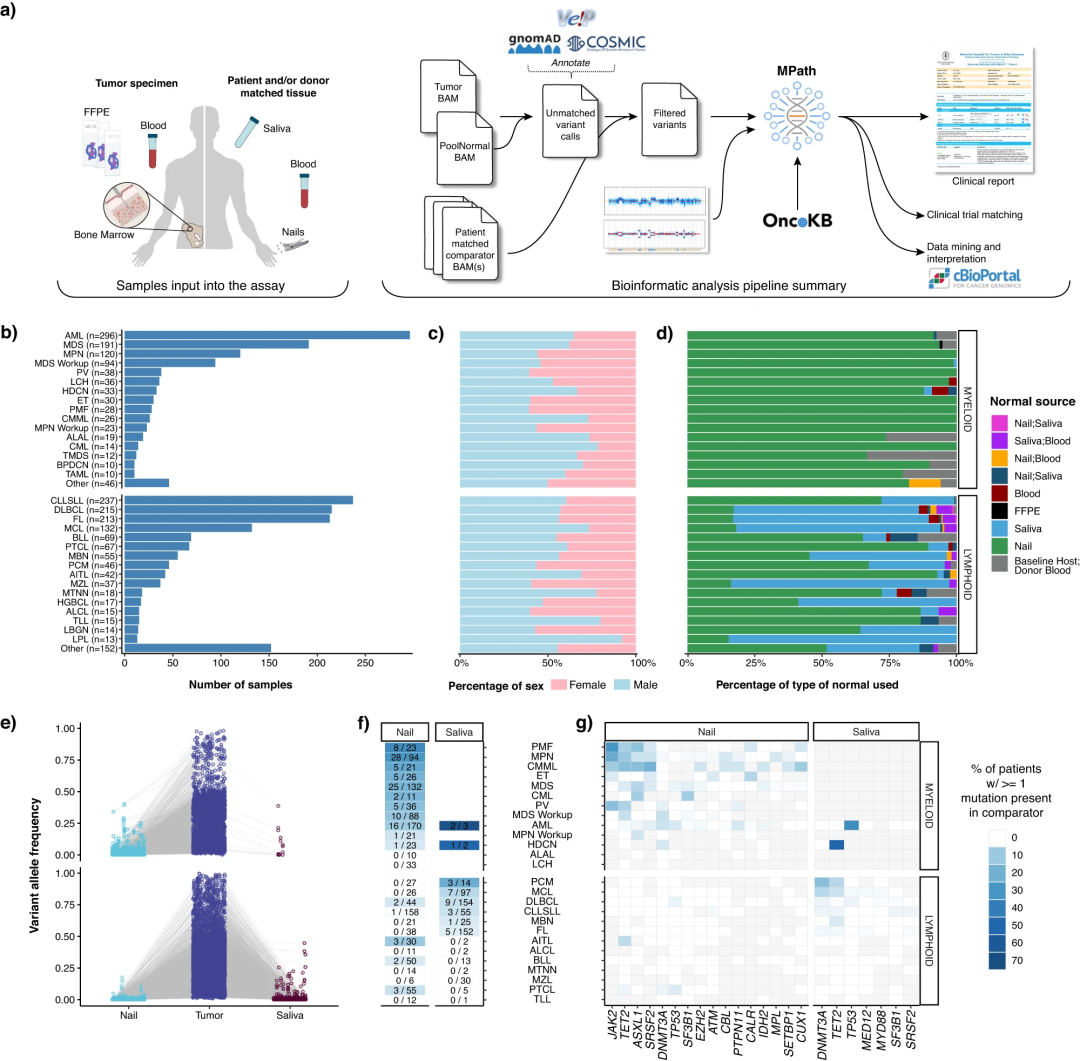
图1.MSK-IMPACT Heme工作流程、样本分布和正常组织中的体细胞突变分布
使用宿主和供体正常对照识别移植环境中的体细胞突变
为了识别具有预后和诊断意义的小型和大规模体细胞拷贝数改变(SCNA),研究人员开发了一种算法(FACETS2n),该算法利用来自患者不匹配正常样本的覆盖数据,并结合患者匹配的等位基因频率来估计integer水平的拷贝数以及等位基因失衡(如拷贝中性杂合性缺失cnLOH)。来自64个临床样本的MSK-IMPACT Heme FACETS2n分析具有92.9%的敏感性和100%的特异性,与高密度单核苷酸多态性(SNP)阵列分析结果高度一致。
为了进一步证明使用宿主和供体正常组织进行统一分析的实用性,研究团队报道了一例接受异基因干细胞移植治疗的37岁急性髓系白血病患者。研究人员对该患者的复发骨髓进行了MSK-IMPACT Heme分析,发现能够在嵌合患者中准确区分所有宿主和供体多态性与体细胞突变,其中宿主和供体衍生多态性的VAF范围与真正的体细胞突变重叠(图2a)。
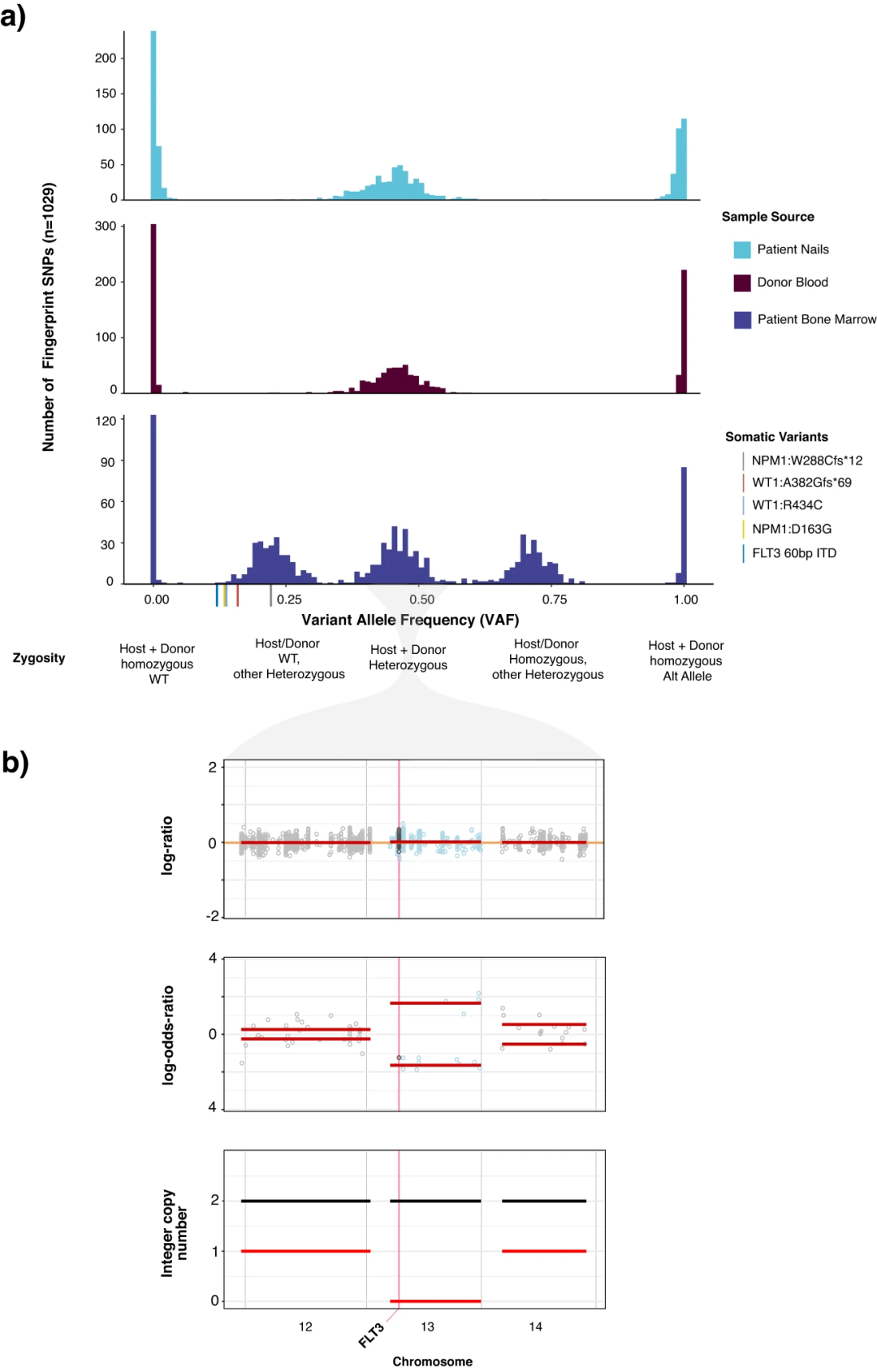
图2.患者案例示例,突出了IMPACT-HEME在移植后嵌合患者中检测复杂突变和等位基因特异性拷贝数的能力
除了去除背景多态性外,使用FACETS2n还可以在移植后环境中进行更复杂的局部拷贝数分析。研究人员使用来自患者指甲和供体血液的DNA作为移植后骨髓活检的基线样本对照,检测到13号染色体q臂的cnLOH(图2b)。此外,研究人员还证明了使用MSK-IMPACT Heme分析流式细胞分选样本的实用性。
体细胞基因组图谱
研究团队从2290份样本中鉴定出12893个体细胞突变,4231个基因水平和7566个broad染色体臂水平的体细胞拷贝数改变。MSK-IMPACT Heme工作流程的实施使复杂肿瘤样本的表征成为可能,包括流动分选样本和嵌合移植后患者的肿瘤样本。1937例患者中有1885例(97.3%)发现体细胞基因组突变,包括非同义SNV、Indel和染色体臂水平拷贝数改变等。
除了基因水平的拷贝数改变外,FACETS2n还能准确评估等位基因特异性拷贝数状态,包括CN-LOH。CN-LOH在433个样本中被发现(19%)。研究还在单个肿瘤样本中发现含有多个体细胞突变的基因,这可能反映了双等位基因失活、多个亚克隆或异常的体细胞超突变。

图3.通过MSK-IMPACT Heme分析血液肿瘤的体细胞基因组图谱
突变特征
与实体瘤相比,血液肿瘤往往具有较低的体细胞突变水平,这可能是患者对免疫检查点抑制反应相对令人失望的原因。在MSK-IMPACT Heme分析中,研究人员计算了所有样本的肿瘤突变负荷(TMB)(图4a)。与髓系恶性肿瘤相比,淋巴系肿瘤的TMB更高。研究发现,肿瘤的突变过程可归因于激活诱导的胞苷脱氨酶(AID)活性、错配修复(MMR)缺陷、紫外线照射(UV)、化疗等(图4b)。
研究显示,通过使用匹配的正常个体识别体细胞改变,可以更准确地评估这些肿瘤中的TMB,展示了TMB升高的血液肿瘤靶向测序的突变特征分析能力,有助于确定潜在的突变过程,并有可能利用这些数据影响患者管理。
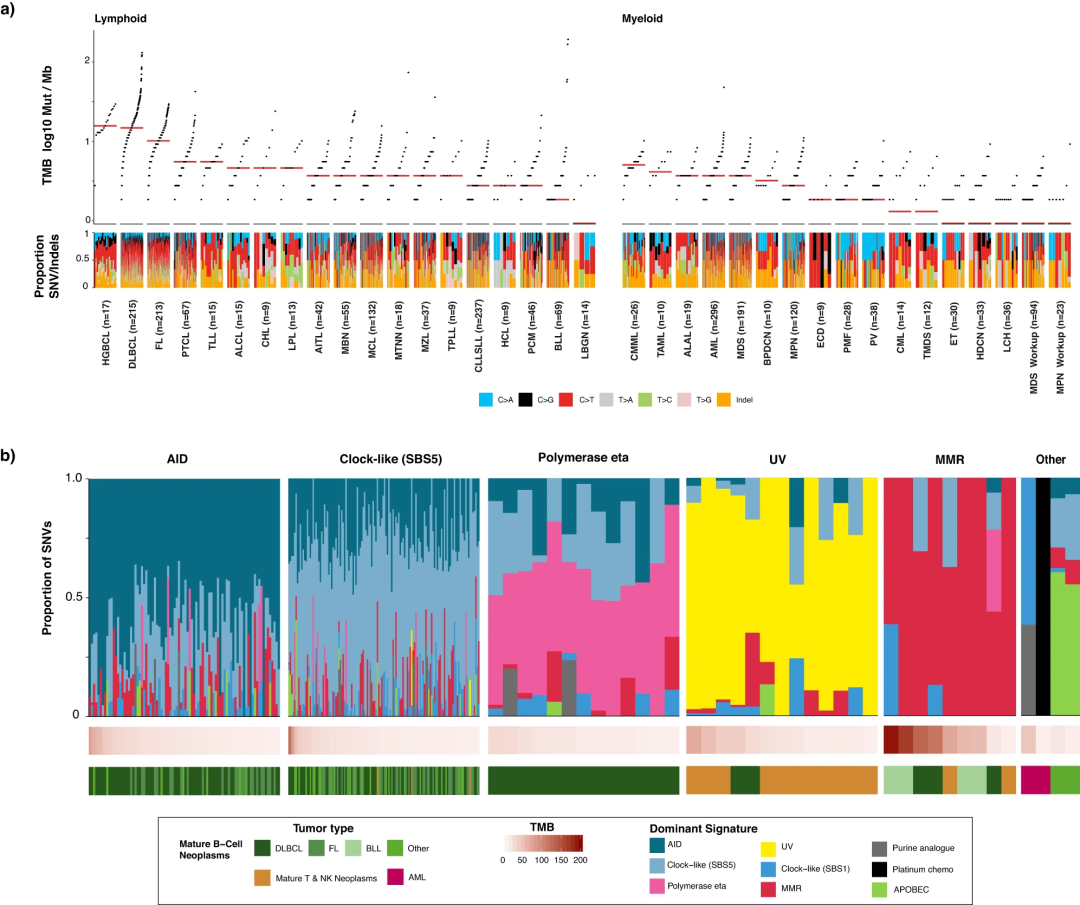
图4. MSK-IMPACT Heme队列中的突变特征分析
临床可操作性
研究人员还进一步评估了前瞻性分子谱分析的临床应用,以指导使用OncoKB数据库进行患者管理。OncoKB的证据水平系统可根据证据水平注释基因突变,这些突变或者是药物敏感性的预测生物标志物,或者对诊断或预后具有重要意义。研究团队基于在样本中检测到突变的最高水平证据对患者样本进行分类,发现10.6%的患者至少有一个潜在的临床可操作突变,71.5%存在致癌突变(图5a),43%患者至少有一个具有诊断或预后意义的突变。这一分析反映了该队列在疾病水平上的可操作性被低估,因为MSK-IMPACT Heme分析不包括可操作基因融合或重排的靶标检测,这些靶标可能在未来的panel设计迭代中得到解决。
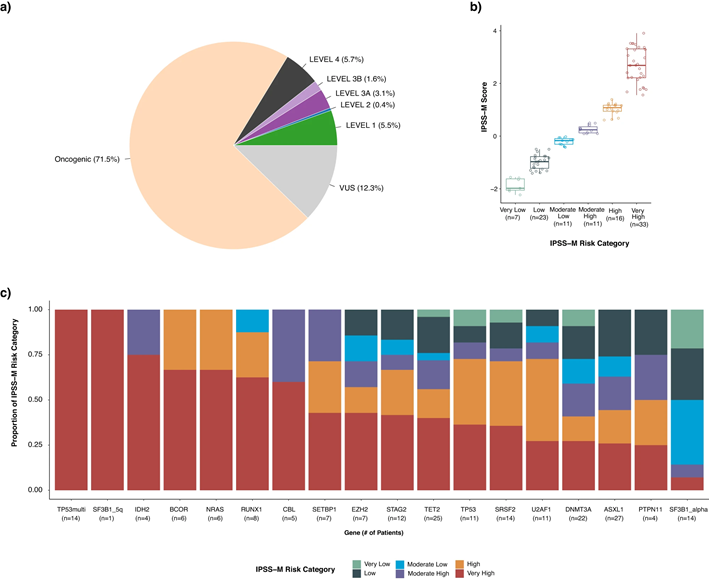
图5.MSK-IMPACT Heme结果的临床可操作性
将MSK-IMPACT Heme检测到的体细胞拷贝数改变与常规核型(G-banding)和FISH相结合,可以更灵敏地检测拷贝数改变。研究还证明了利用MSK-IMPACT Heme队列区分SF3B1改变患者亚组的能力(图5c)。通过对匹配正常组织中的候选突变进行基因分型,从报告中去除胚系突变,能够更好地识别用于MRD评估的适当标志物,并防止假阳性结果。
该研究报告了大规模的前瞻性临床测序工作的经验,有助于指导血液肿瘤患者的诊断、预后、治疗选择和未来监测。研究表明,肿瘤和匹配正常样本的大规模测序在血液肿瘤中是可行的,包括造血干细胞移植后的患者和患有多种并发恶性肿瘤的患者。这一流程的周转时间是可变的,在该队列中通常为2-3周。根据获取肿瘤-正常匹配的时间框架,可能会缩短周转时间,进一步强调了多学科方法对于工作流程优化的重要性。
研究人员相信,随着持续的研究和数据共享,广泛的基因组评估将支持了解所有血液肿瘤患者的病理生物学,确定新的药物靶点,并改善无创监测。
该研究全部数据集共享在cBioPortal:https://www.cbioportal.org/study?id=heme_msk_impact_2022.
论文原文:
Ptashkin, R.N., Ewalt, M.D., Jayakumaran, G. et al. Enhanced clinical assessment of hematologic malignancies through routine paired tumor and normal sequencing. Nat Commun 14, 6895 (2023). https://doi.org/10.1038/s41467-023-42585-9


