Cell Reports 复旦大学孟丹教授团队揭示BACH1调控人胚胎干细胞向血管平滑肌细胞分化的新机制
时间:2023-12-06 14:33:52 热度:37.1℃ 作者:网络
人胚胎干细胞具有分化为体内任何类型细胞的能力,包括分化为多种类型的血管细胞。血管平滑肌细胞是血管的主要细胞成分,对维持血管壁的完整性和血管功能至关重要。多能干细胞衍生的血管平滑肌细胞可用于血管疾病建模、药物研发和血管组织工程,有广泛的应用价值。研究体外血管平滑肌细胞分化是如何受到调控的,能够提高干细胞体外分化效率,有着促进血管治疗发展的科学价值。
2023年11月20日,复旦大学基础医学院孟丹教授团队在《细胞报告》(Cell Reports)杂志在线发表了题为《BACH1通过CARM1介导的H3R17甲基化调控人胚胎干细胞向血管平滑肌细胞的分化(BACH1 regulates the differentiation of vascular smooth muscle cells from human embryonic stem cells via CARM1-mediated methylation of H3R17)》的最新研究成果。这项工作表明转录因子BACH1在调控人胚胎干细胞向血管平滑肌细胞分化中起到重要作用,BACH1促进了中胚层阶段后的平滑肌分化。该研究对理解干细胞定向分化至血管细胞过程中阶段性的调控机制具有重要启示,可能为开发干细胞治疗血管疾病的临床应用提供新思路。

孟丹教授研究团队前期围绕转录因子BACH1进行一系列的研究,证实BACH1是干细胞自我更新的关键调控因子,通过表观遗传学修饰维持人以及小鼠胚胎干细胞多能性;另外,BACH1通过调控染色质开放性影响血管平滑肌细胞表型转换,促进血管损伤后新生内膜增生。相关成果分别发表在《科学进展》(Science Advance, 2019)和《核酸研究》(Nucleic Acids Research, 2021, 2023)。但是,BACH1在干细胞向血管平滑肌细胞分化过程中的具体作用及其机制尚不清楚。

图1. 这张图展示了BACH1调控基因转录和干细胞分化的过程,就像一场华丽的体操表演。体操运动员代表转录因子BACH1,手中的缎带代表DNA,背景的体操球代表干细胞
研究首先发现,在体外诱导人胚胎干细胞向血管平滑肌细胞分化的过程中,BACH1的表达逐渐升高。之后研究人员利用CRISPR‒Cas9技术构建了敲除BACH1的人胚胎干细胞系,诱导WT和BACH1-KO干细胞向平滑肌细胞分化,收取分化不同时间点的细胞进行检测,发现敲除BACH1明显降低了平滑肌标志基因CNN1(钙调蛋白-1)、TAGLN(转凝蛋白)和ACTA2(α-平滑肌肌动蛋白)的水平。免疫荧光和流式结果显示,BACH1敲除的干细胞向平滑肌细胞分化的效率降低。另一方面,研究人员建立了DOX诱导的BACH1过表达细胞系,发现在中胚层分化之后,过表达BACH1促进干细胞向血管平滑肌细胞分化。这些结果说明,BACH1在中胚层之后的血管平滑肌分化中起到正向调节作用。
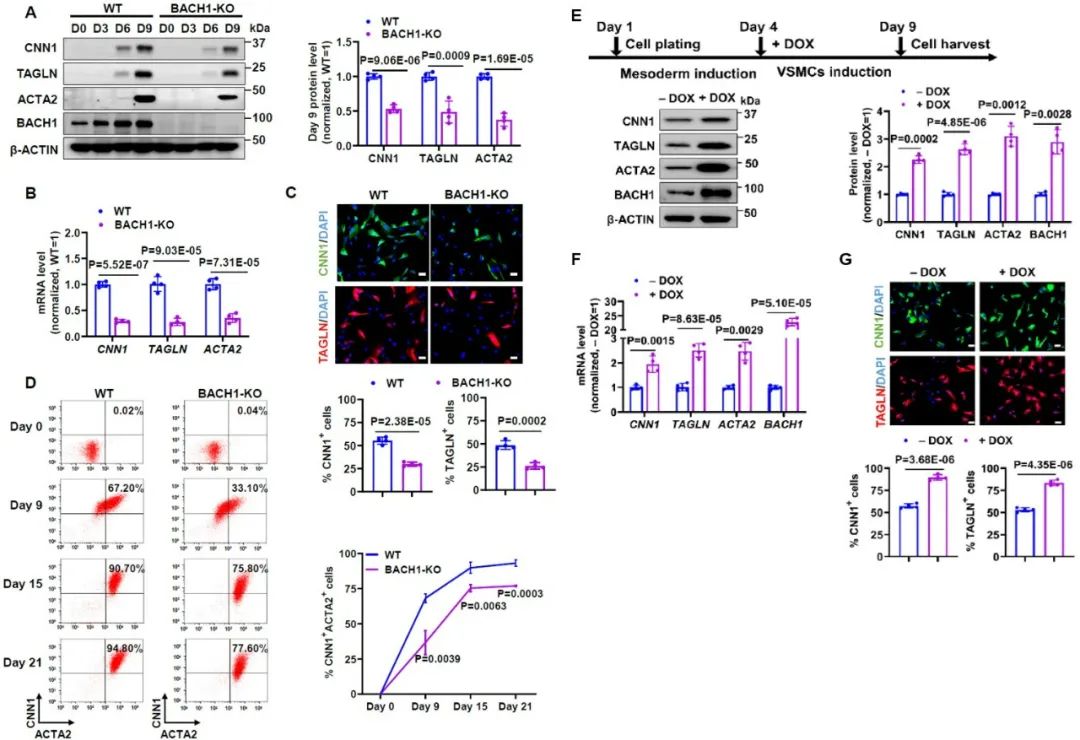
图2. BACH1促进中胚层细胞向血管平滑肌细胞的体外分化
研究人员进一步探索BACH1调控平滑肌标志基因的机制,对分化第6天的细胞进行了高通量转录组测序,发现BACH1敲除细胞中下调的差异基因与干细胞发育和平滑肌分化相关,平滑肌标志基因在BACH1敲除细胞中明显下调,这表明BACH1在由人胚胎干细胞衍生的平滑肌细胞的发育过程中扮演着重要角色。通过检测分化不同时间BACH1在平滑肌标志基因上的富集情况,发现BACH1在分化第6天时富集较高。研究人员利用靶向切割和标记技术(CUT&Tag)获得了BACH1的DNA结合谱,发现BACH1富集在基因启动子区,尤其是结合在平滑肌标志基因启动子区。以上结果说明,BACH1在血管平滑肌分化过程中结合在基因启动子区,转录激活平滑肌标志基因,促进其表达。
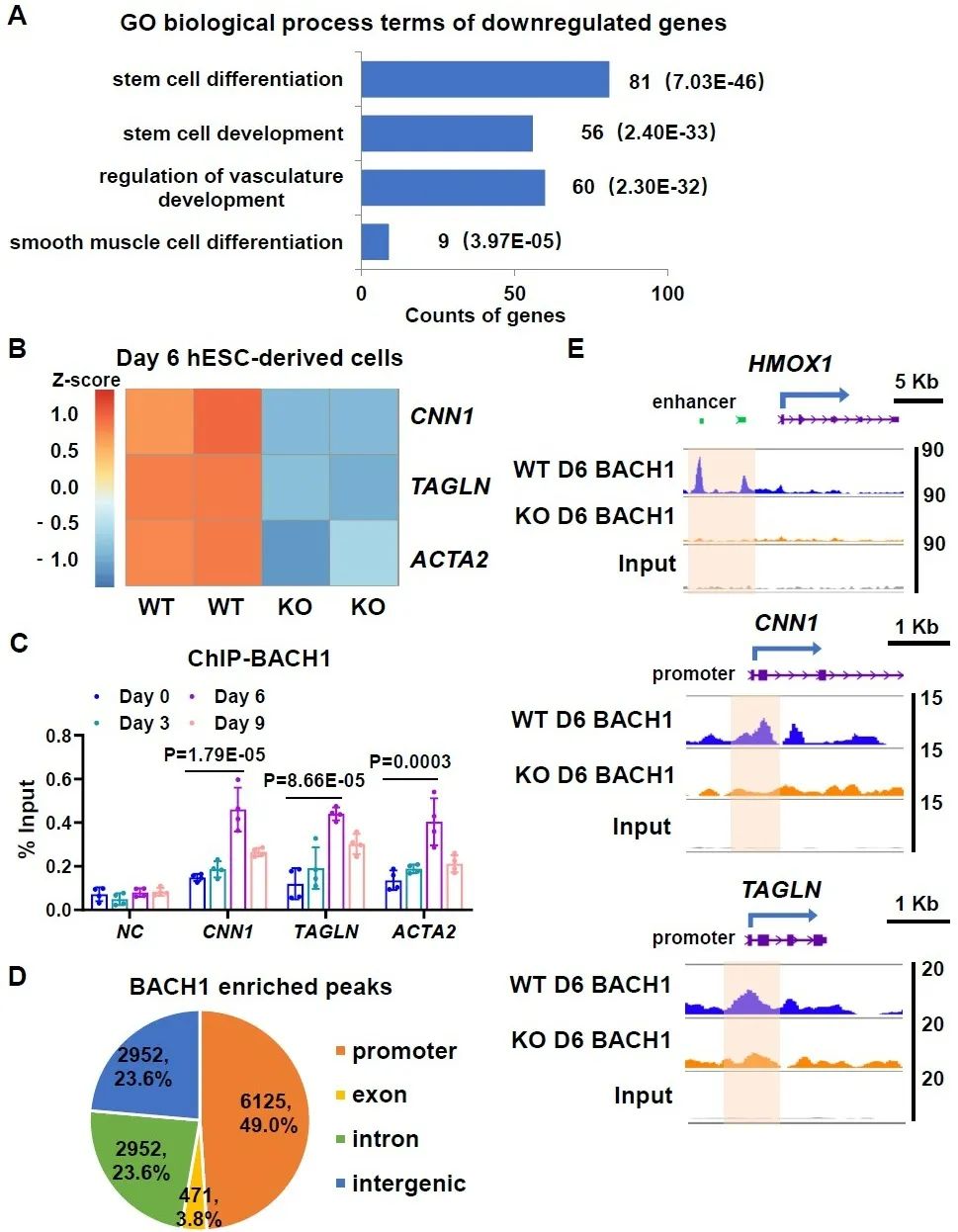
图3. BACH1结合在血管平滑肌标志基因启动子区,促进其表达
机制上,研究人员通过质谱发现了BACH1与共激活因子相关精氨酸甲基转移酶1 (CARM1)结合,CARM1通过催化组蛋白H3第17/26位精氨酸(R17/26)甲基化,促进基因转录激活。进一步研究发现,BACH1依靠其bZIP结构域与CARM1结合,上调平滑肌标志基因的表达水平。
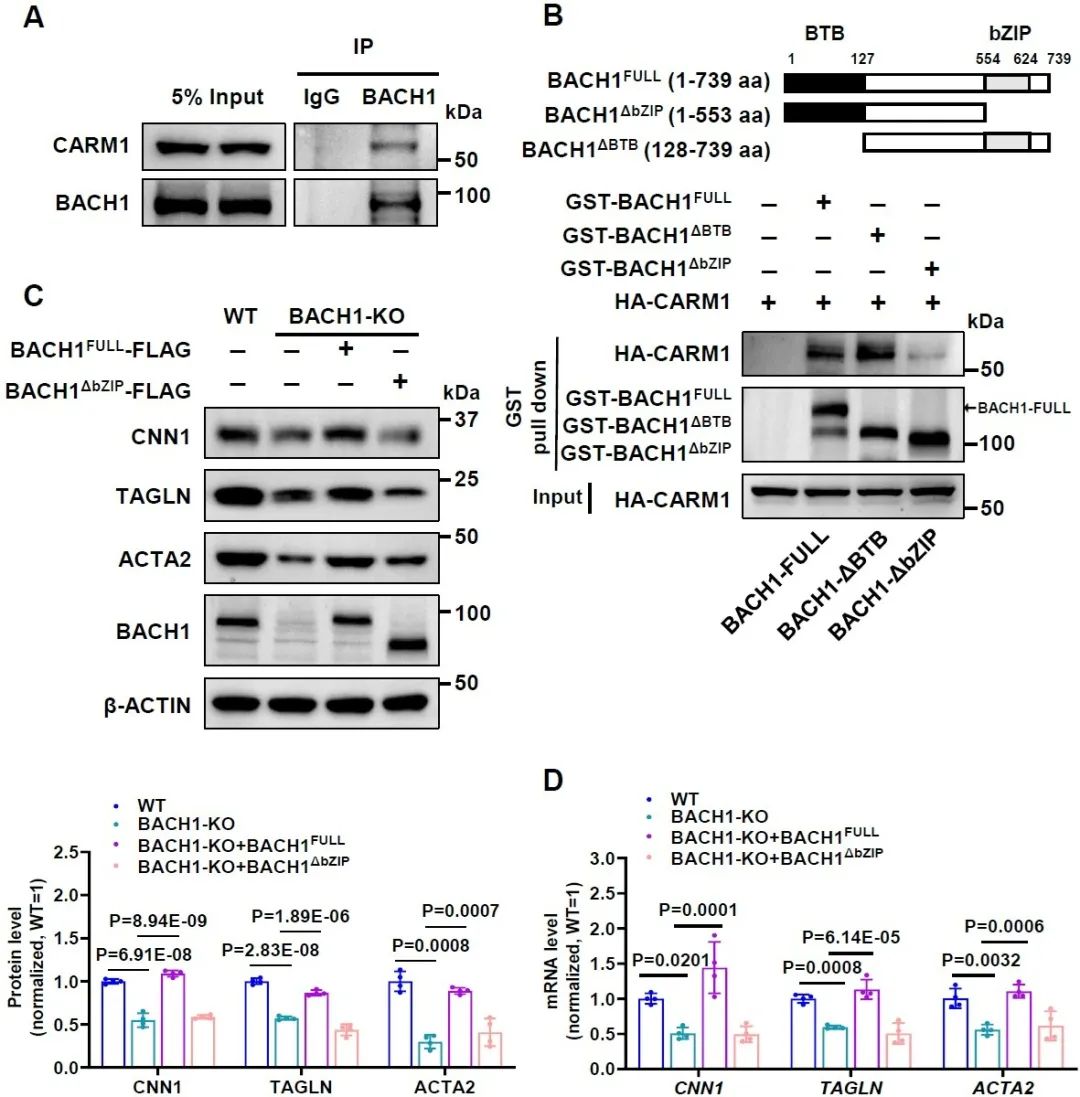
图4. BACH1通过其bZIP结构域与CARM1结合,促进平滑肌标志基因的表达
研究人员检测了CARM1及其组蛋白标志物组蛋白3第17位精氨酸二甲基化(H3R17me2)在平滑肌基因上的富集情况,发现与BACH1类似,在分化第6天时富集最多。对分化第6天的细胞进行CUT&Tag检测,发现BACH1与CARM1、H3R17me2在基因转录起始位点有共定位,敲除BACH1抑制了CARM1和H3R17me2在平滑肌基因启动子区的富集。研究人员进一步将BACH1、CARM1和H3R17me2的CUT&Tag数据取交集,筛选出3599个BACH1-CARM1-H3R17me2富集基因。将这些靶基因与分化第6天的高通量转录组测序数据进行综合分析,最终筛选出605个基因受到BACH1调控,BACH1敲除后有304个基因表达上调,301个基因表达下调。下调的基因中包含了参与平滑肌表型调节的基因。以上结果表明,BACH1、CARM1和H3R17me2在基因组上共富集,在平滑肌分化过程中BACH1招募CARM1到基因启动子区,上调启动子区H3R17me2修饰水平。
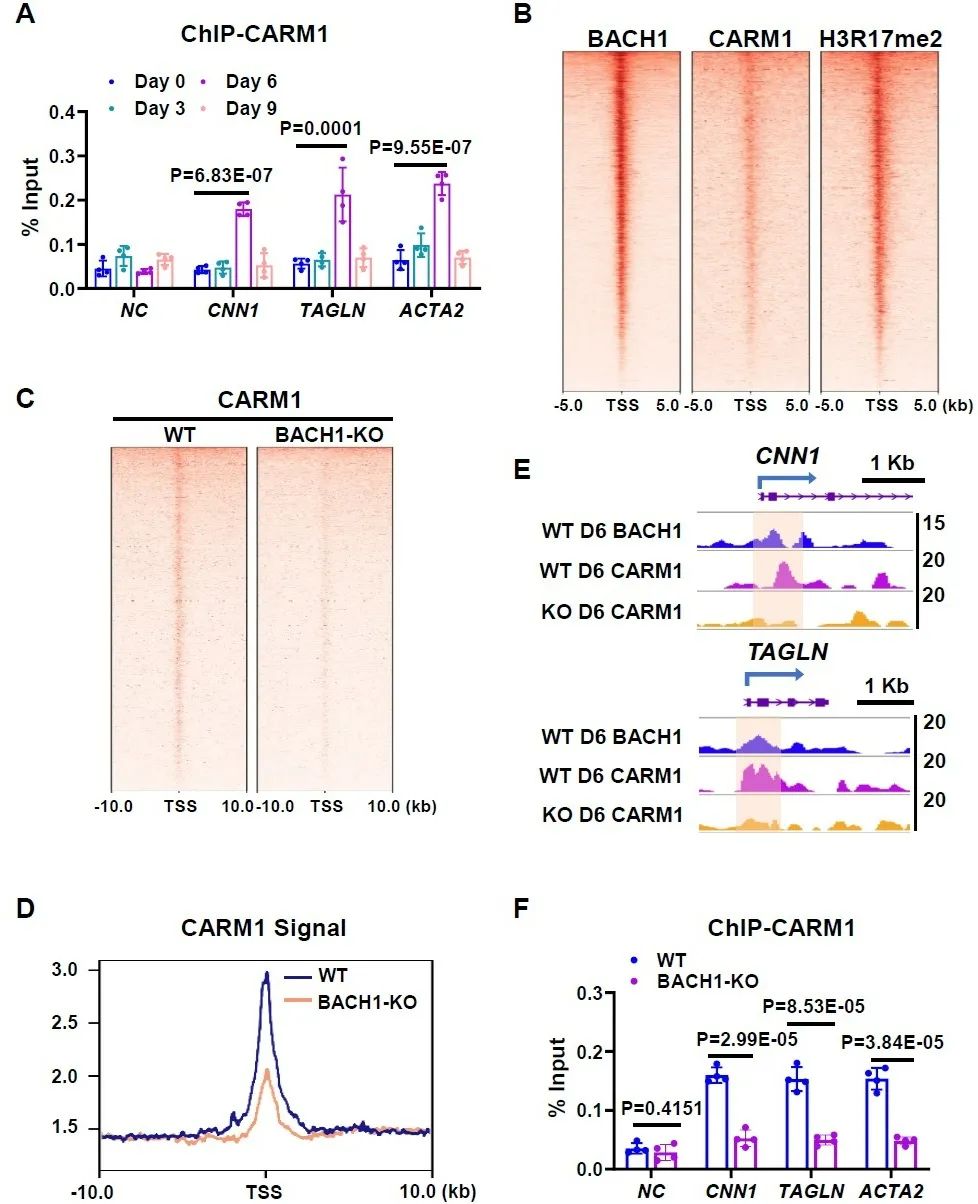
图5. 在平滑肌分化过程中BACH1招募CARM1富集到平滑肌基因启动子区
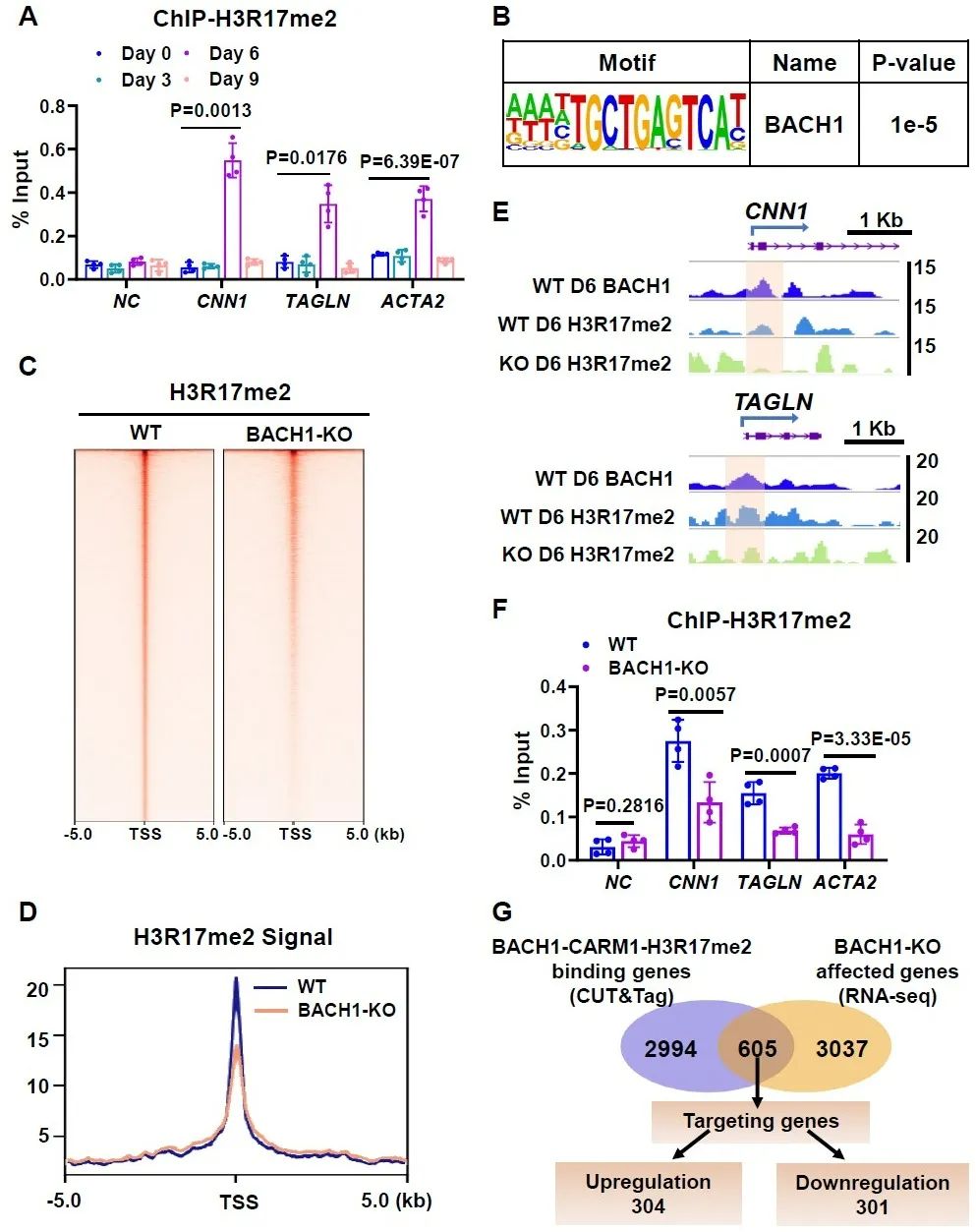
图6. BACH1缺失降低了平滑肌标志基因启动子区上H3R17me2修饰
进一步研究发现,过表达BACH1促进的平滑肌标志基因表达,在使用siRNA抑制CARM1或使用H3R17me2抑制剂TBBD(鞣花酸)之后被阻断。以上结果说明,BACH1通过CARM1和H3R17me2调控血管平滑肌标志基因表达。
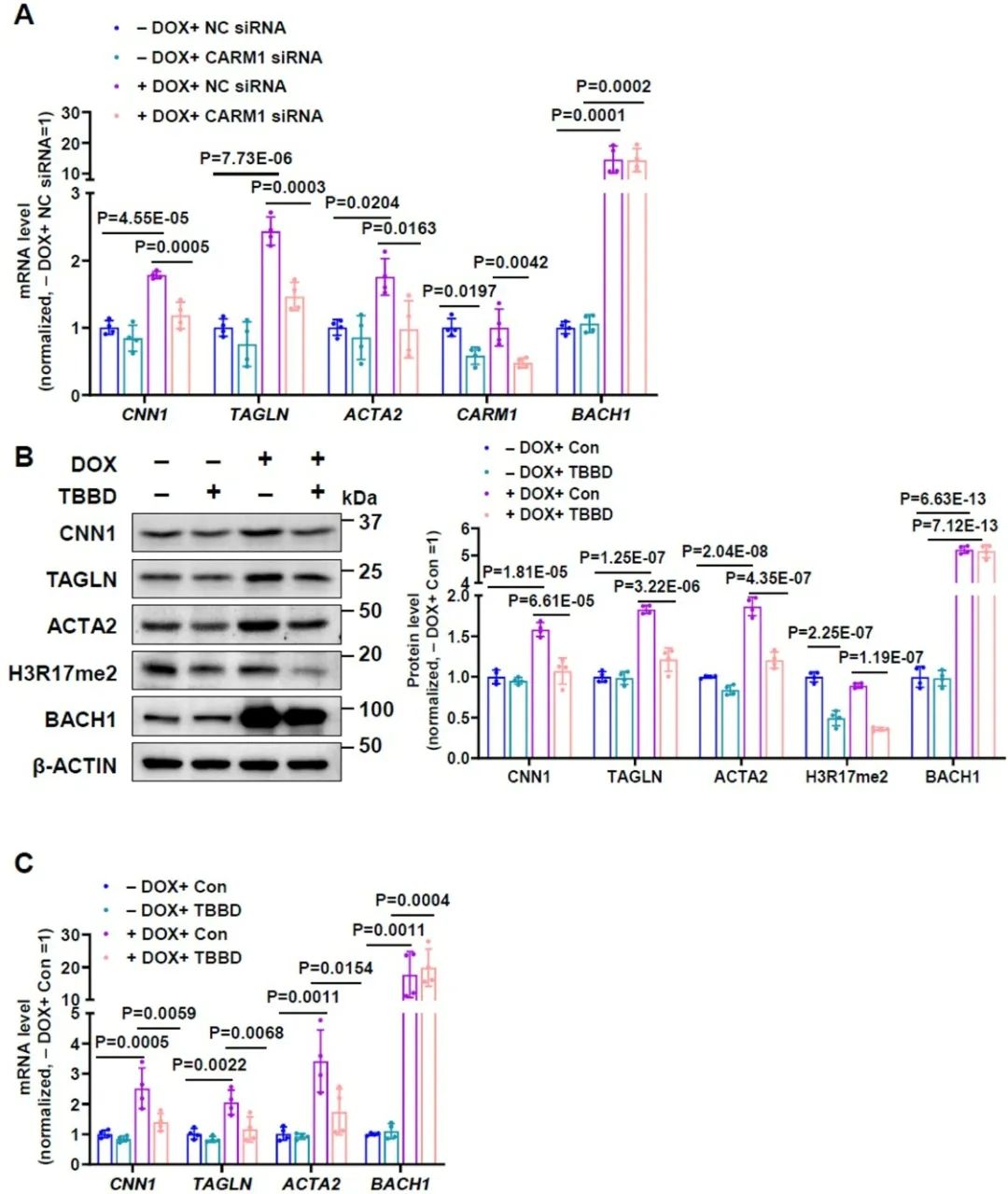
图7. BACH1通过CARM1及其H3R17me2组蛋白修饰促进血管平滑肌分化
综上,这项研究表明,转录因子BACH1对人胚胎干细胞中胚层阶段后的体外血管平滑肌细胞分化起正向调节作用。BACH1将精氨酸甲基转移酶CARM1招募到平滑肌标志基因启动子区,通过增加组蛋白3第17位精氨酸二甲基化修饰,促进平滑肌标志基因表达,从而促进干细胞中胚层分化阶段后的体外平滑肌分化。该研究为干细胞定向分化至血管细胞的机制提供了新的见解。结合之前的研究,证明BACH1在干细胞自我更新、中胚层和心血管谱系分化过程中起重要作用,对于再生医学领域的相关研究具有重要的科学意义。

图8. 本研究的机制示意图
复旦大学基础医学院何韫荃博士研究生和郭阶雨博士后为本文的共同第一作者,复旦大学基础医学院孟丹教授、魏香香青年副研究员和王新红副教授为本文的共同通讯作者。复旦大学为第一作者单位。该研究得到了瑞士苏黎世大学Elena Osto教授等人的大力支持;同时得到了来自国家自然科学基金重大研究计划重点项目、国家自然科学基金重点国际合作项目、上海市优秀学术带头人项目、上海市科委科技创新行动计划以及上海市科委启明星项目和复旦大学卓识杰出人才项目等基金的资助。
原文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01480-8


