偏头痛发病机制不明,以『脑肠轴假说』为基础的治疗策略初见成效!
时间:2024-01-12 20:56:38 热度:37.1℃ 作者:网络
『偏头痛』是一种常见的遗传与环境因素共同作用的原发性脑功能异常性疾病,最新的国际头痛分类标准(3版)将其定义为持续4~72小时的、伴有相关症状(包括恶心、呕吐、畏光和畏声)的、反复发作的中至重度头痛。
在西方发达国家,女性患病率为18% ~ 18.2%,男性患病率为 6% ~ 6.5%,我国偏头痛的年患病率为 9.3%,造成很多人的社会失能。
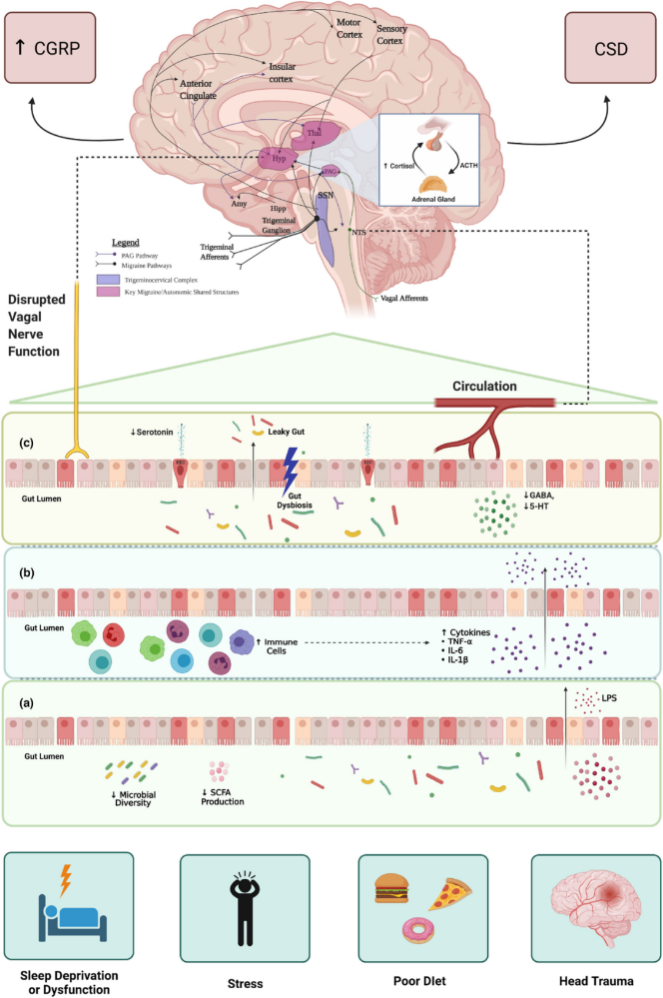
尽管如此,其病理生理机制尚不完全清楚,仅在假说阶段,如皮层扩散抑制(CSD)假说、三叉神经血管假说、血脑屏障(BBB)功能障碍理论。前者指出了大脑与神经炎症的相互关系,后两者指出神经和血管是发病的关键因素。
很多研究报道了偏头痛患者的胃肠道相关表现:
♦ 常伴有胃肠道症状,最常见的是恶心和呕吐。
♦ 20%的偏头痛患者会因摄入巧克力、奶酪、红酒、西红柿、碳水化合物、发酵产品和坚果等食物而诱发偏头痛。
♦ 肥胖患者偏头痛发作的频率和严重程度明显高于超重或正常体重的个体。
♦ 多种胃肠道疾病已被报道与偏头痛有关,如炎症性肠病、肠易激综合征、幽门螺杆菌感染等。如头痛病史长、头痛频率高的偏头痛患者被诊断为肠易激综合征的概率更高。
♦ 由于肠道菌群丰富,肠道功能通常与免疫系统有关。细菌失调与炎症介质研究发现消化系统疾病的发病可伴有以偏头痛为主要特征的神经系统症状。
♦ 在小鼠模型中也已经发现了偏头痛的程度和持续时间与肠道微生物群异常有关。
现有研究表明,肠道菌群和脑之间可以通过『肠-脑轴』的双向调节作用,整合肠神经和中枢神经的活动。脑通过自主神经系统和神经内分泌作用,影响肠道功能和菌群构成。
反过来,菌群代谢产物可以经血液循环进入中枢,发挥神经调质作用。此外,肠道菌群已经被证实能调节内脏痛和慢性痛,所以可以推测肠道菌群和肠-脑轴参与偏头痛的病理机制。
已知的是,偏头痛的发病机制可能与体内降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、内皮素等血管舒缩因子,5-羟色胺(5-hydroxytryptamine,5-HT)、P物质(substance-P,SP)等神经递质及白细胞介素(interleukin,IL)、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)等细胞炎症因子的紊乱密切相关。
那么脑肠轴是如何通过神经肽和炎症因子产生联系的呢?
1 炎症因子
在肠道中,免疫细胞(包括巨噬细胞、肥大细胞、T细胞/调节性T细胞和小胶质细胞等)及其炎症介质,如白细胞介素(IL-1β、IL-6和IL-18、肿瘤坏死因子α (TNF-α)和干扰素γ (IFN)被认为是传入末梢的致敏剂与内脏疼痛的诱导剂。此外,促炎细胞因子,包括IL-1β、IL-6、IL-8和TNF-α与偏头痛有关,并且在偏头痛发作期间增加。
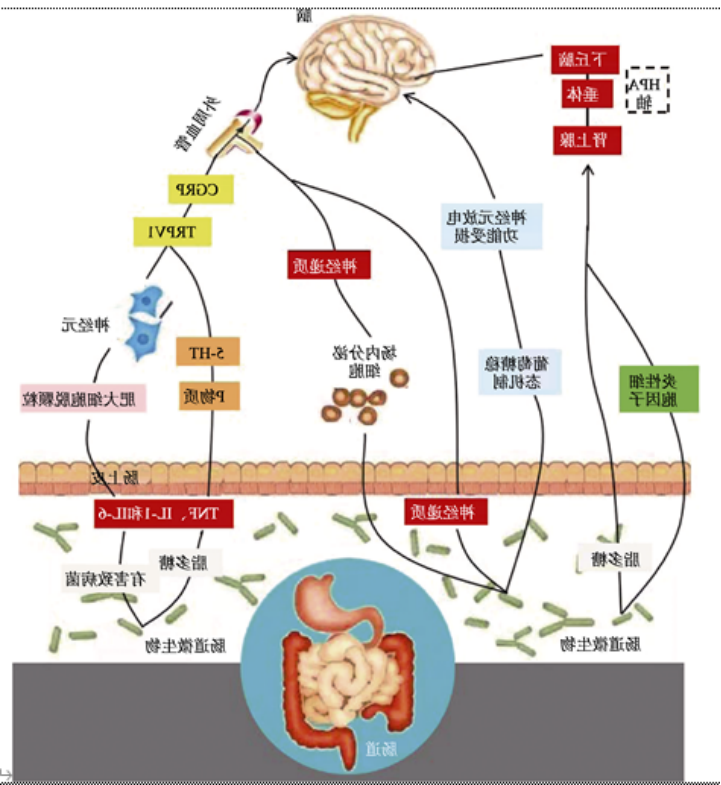
2 神经肽
在肠道菌群失衡后,肠脑轴和神经炎症反应则主要由『神经肽』介导。微生物源性神经递质作为间接信号,影响肠道菌群组成,在肠脑轴中发挥重要作用。中枢神经系统以迷走神经为中间通路,通过释放神经肽调节整个肠道微生物群。
降钙素基因相关肽(CGRP)
孟德尔随机化分析支持肠易激综合征和偏头痛之间的潜在因果关系,并指出CGRP可能通过胃肠道免疫细胞和肠道运动参与调节肠道微生物平衡。有研究表明,CGRP信号通路会受到肠道菌群的影响,因为这种神经递质在生态失调中水平升高可能是偏头痛患者使用益生菌的可能理由之一。
肠道共生微生物可激活CGRP伤害感受器或受体活性修饰蛋白1 (Ramp1)来控制CGRP的释放。动物实验表明,CGRP可以降低伤害感受器消融的小鼠患结肠炎的程度及发病率。
在动物模型中外周给药CGRP的研究表明,CGRP抑制胃酸分泌。此外,CGRP可通过调节中枢迷走神经以抑制胰酶分泌。
P物质(SP)
呕吐是最常见的胃肠道反应之一,也是由SP控制的。在中枢神经系统中,后脑区和孤束核控制呕吐反射,并含有高水平的SP。SP与NK1R结合引发呕吐,故NK1R拮抗剂可阻止呕吐反射的信号传导,并被证明可减轻化疗引起的呕吐的严重程度。此外,胃肠道系统含有NK1R,因此SP可在肠道内的固有神经和部分外源性感觉神经中存在。胃肠道肠运动神经元释放乙酰胆碱和SP到平滑肌,调节胃运动。乙酰胆碱是胃肠道平滑肌收缩的主要神经递质,因此提出SP增加胃肠道平滑肌对乙酰胆碱的敏感性的猜想是合理的。
垂体腺苷酸环化酶激活肽(PACAP)
PACAP在神经调节、神经源性炎症和伤害感受中发挥作用。有证据表明,感觉神经元发生炎症后PACAP发生上调,PACAP与CGRP在部分硬脑膜神经纤维中共表达,也与中枢致敏和疼痛的情绪负荷有关。PACAP对革兰氏阳性菌、革兰氏阴性菌和真菌均具有抗菌活性,可直接影响膜杀灭细菌的功能。
通过研究PACAP治疗是否能缓解模拟人类肠道菌群状况的实验性亚急性回肠炎,在肠道和肠外均发现了PACAP的炎症改善作用,表现为肝和肺中凋亡细胞计数降低,促炎细胞因子分泌减少,并伴有回肠和结肠上皮粘膜和固有层中T细胞数量减少。这为PACAP可能成为包括IBD在内的肠道炎症的一种新的治疗选择提供了强有力的证据和进一步的支持。
5-羟色胺(5-HT)
一些研究表明,肠道菌群的改变、内脏疼痛、分泌的调节和蠕动反射的启动可能导致5-羟色胺信号的调节。肠道细菌产生的神经递质在不同类型的细胞之间传递信息,特别是在肠-脑轴上。5-羟色胺(5-HT)是一种生物胺,参与控制饮食行为、体温调节、性行为和睡眠,存在于神经末梢、神经元体、肠嗜铬胃细胞和血小板中。
在一项癌症患者的研究中,细胞毒性药物诱导肠粘膜肠嗜铬细胞释放5-HT,刺激邻近迷走传入神经上的5-HT受体,迷走传入神经的去极化刺激呕吐中枢,最终引起『呕吐反射』。目前估计至少有7个不同的受体家族(5-HT1-7),其中许多有亚型。研究表明,不止一种亚型与偏头痛的发展有关。
此外,5-HT受体在免疫细胞(包括单核细胞、巨噬细胞、淋巴细胞和树突状细胞)上的存在,可能揭示了这种神经递质对免疫调节的影响。这个问题也可以解释5-HT对炎症的影响,肠的状态及其在增加胃肠道疾病易感性方面的作用(如克罗恩病、溃疡性结肠炎、乳糜泻和憩室炎)。
且有研究认为,色氨酸-犬尿氨酸途径可能是胃肠道微生物群影响中枢神经系统功能的主要途径之一,因为肠道细菌菌株中存在合成酶,这些合成酶可能产生色氨酸代谢物(如喹啉酸和犬尿酸)。而色氨酸为5-HT的前体。
谷氨酸
作为一种兴奋性神经递质,通过皮质扩张性抑制(CSD)、中枢致敏和刺激三叉神经系统等多种作用参与偏头痛的病理生理。与对照组相比,偏头痛患者血浆和脑脊液中谷氨酸水平升高已有报道。
另一方面,这种神经递质在肠神经系统(ENS)和肠-脑轴(沿传入神经元从肠道传递到大脑)中的作用已被深入研究。此外,研究表明谷氨酸可能影响胃肠道的炎症和氧化应激。谷氨酸通路的紊乱参与了多种胃肠道疾病的发病机制,如IBD、IBS、胃食管反流、胃酸分泌亢进等。
神经肽Y(NPY)
是去甲肾上腺素能系统功能的指标,通过脑循环调节影响脑血流量。在偏头痛发作期可检测到较高水平的NPY。有趣的是,这种神经递质在肠-脑轴的各个层面都被检测到。NPY通路也被认为有助于改变胃肠道功能及其血流、免疫系统和炎症状态、疼痛、能量稳态、情绪、情绪以及行为和大脑的其他功能(如认知)。
胆囊收缩素(Cholecystokinin, CCK)
是由肠内分泌细胞(I细胞)在小肠粘膜层合成的,哺乳动物的大脑(如:皮层、丘脑、中边缘、导水管周围灰质(PAG)和中脑)和脊髓。该肽抑制胃排空和胃酸分泌,刺激胆囊收缩和胰腺分泌,并通过CCK1受体在大脑中引起『饱腹感』。
CCK1R在位于胃肠道壁的迷走神经传入末端的存在进一步证实了内分泌和旁分泌协同作用的假设。CCK1R在中脑边缘结构、下丘脑和脑干核中的位置及其与多巴胺、血清素、谷氨酸、下丘脑激素和神经肽的相互作用解释了CCK在行为、情绪和锥体外系功能中的特定作用。
与CGRP一样,CCK在PAG中产生,可能与内源性疼痛信号系统有关,其水平在偏头痛中升高。CCK也存在于三叉神经节,刺激三叉神经节可导致局部CCK升高。对于偏头痛和肥胖之间的关联,一种可能的解释是高脂肪饮食导致CCK分泌,因为十二指肠内游离脂肪酸可刺激CCK分泌。
此外,CGRP、P物质(SP)、血管活性肠肽和神经肽Y等物质被认为对多种肠道细菌菌株(例如大肠杆菌、粪肠球菌、以及嗜酸乳杆菌)具有抗菌作用,因此推测可能参与了肠道和大脑之间的双向关系。有研究称,SP的结肠浓度会随着抗生素治疗和随后的生态失调而增加,而副干酪乳杆菌(Lactobacillus paracasei)会减弱这种反应。
3 短链脂肪酸(SCFAs)
短链脂肪酸(SCFAs,即:丁酸酯、丙酸酯和醋酸酯)对维持肠道屏障的完整性至关重要。这些物质是由远端结肠的细菌产生的。有研究表明,肠道微生物群的活性以及肠道中SCFAs的水平可能受到膳食因素的影响,包括纤维素和益生菌。
除了影响肠道/全身免疫外,SCFAs绕过门静脉循环,可通过循环到达中枢神经系统。由于肠道通透性与炎症状态之间的双向关联,肠道通透性的增强可以通过脂多糖(LPS)渗漏刺激炎症和免疫反应,随后促炎细胞因子可以增强肠道通透性。另一方面如前所述,促炎细胞因子如TNF-α、IL-1β、IL-6也可能引起三叉神经通路的伤害性反射,并在偏头痛发作中发挥作用。
4 肠道菌群
偏头痛患者的肠道微生物群的物种多样性(α多样性)和代谢功能降低,产丁酸菌减少。与没有偏头痛的人相比,在偏头痛患者的口腔和粪便样本中观察到能够减少硝酸盐、亚硝酸盐和一氧化氮的细菌丰度更高,如嗜血杆菌属和Rothia属。
一项研究比较了26名偏头痛患者与29名健康受试者口腔肠道微生物群的差异,结果显示,与健康对照组相比,偏头痛组的小球藻、巨球菌、密螺旋体、Fretibacterium、SR1、incertae sedis的丰度显著增加,而微球菌、狭义梭状芽胞杆菌、罗氏菌、Turicibacter和Granulicatella的丰度在属水平上显著降低。
老年偏头痛女性与健康对照者肠道菌群组成和功能的差异表明,偏头痛女性的厚壁菌群显著富集,尤其是梭状芽胞杆菌,健康对照者的益生菌显著富集,如史密斯甲烷杆菌,prausnitzii粪杆菌和青少年双歧杆菌。
研究表明,如果给予偏头痛患者益生菌补充剂可明显减少偏头痛发作频率及与之相关的不满意强度。一项针对40例偏头痛患者的研究表明,连续90天服用益生菌、矿物质、维生素可改善80%患者的生活质量,并缓解一半以上患者的疼痛。
益生菌可使发作性和慢性偏头痛患者受益,其改善偏头痛的作用可能与改善肠道完整性和调节肠道-中枢神经系统轴密切相关。以肠道微生物群为目标可能是一种潜在的治疗偏头痛的方法。
5 饮食
饮食食品一直是引发偏头痛的一个因素。在此基础上,已经研究了许多饮食干预措施在偏头痛治疗中的功效。其中研究得最好的是『生酮饮食』。
生酮饮食是一种高脂肪、低碳水化合物、中等蛋白质的饮食。一项对 96 名偏头痛女性进行生酮饮食的研究表明,在改用生酮饮食后 1 个月开始,偏头痛发作频率、头痛天数和药物摄入量均有所下降,并在整个 6 个月的研究中持续改善。
因此,在治疗偏头痛方面,通过“偏头痛饮食”、抑制肠道炎症,减少肠壁损伤,也可能成为治疗偏头痛的一种新方法。
目前的证据表明,肠-脑轴可能影响偏头痛,尽管解释这种相互作用的机制尚不完全清楚。一般来说,这种相互作用似乎受到多种因素的影响,如炎症介质(IL-1β、IL-6、IL-8和TNFα)、肠道微生物群、神经肽和血清素途径、应激激素和营养物质。
饮食策略可能会影响偏头痛的病程,并可能成为一个有价值的策略,以改善偏头痛的管理。然而,由于饮食控制偏头痛的证据有限,因此无法得出明确的结论。
参考文献
[1] Welander NZ, Olivo G, Pisanu C, Rukh G, Schiöth HB, Mwinyi J. Migraine and gastrointestinal disorders in middle and old age: A UK Biobank study. Brain Behav. 2021 Aug;11(8):e2291. doi: 10.1002/brb3.2291. Epub 2021 Jul 21. PMID: 34291601; PMCID: PMC8413796.
[2] Qasim H, Nasr M, Mohammad A, Hor M, Baradeiya AM. Dysbiosis and Migraine Headaches in Adults With Celiac Disease. Cureus. 2022 Aug 24;14(8):e28346. doi: 10.7759/cureus.28346. PMID: 36168375; PMCID: PMC9506300.
[3] Liu J, Xi K, Zhang L, Han M, Wang Q, Liu X. Tryptophan metabolites and gut microbiota play an important role in pediatric migraine diagnosis. J Headache Pain. 2024 Jan 5;25(1):2. doi: 10.1186/s10194-023-01708-9. PMID: 38177986; PMCID: PMC10768287.
[4] LenglarT L, Caula C, Moulding T, Lyles A, Wohrer D, Titomanlio L. Brain to Belly: Abdominal Variants of Migraine and Functional Abdominal Pain Disorders Associated With Migraine. J Neurogastroenterol Motil. 2021 Oct 30;27(4):482-494. doi: 10.5056/jnm20290. PMID: 34642268; PMCID: PMC8521460.
[5] 刘洁琼,于生元.肠道菌群与偏头痛的关系探讨[J].中国疼痛医学杂志,2019,25(01):6-10.
[6] Zhou, Y., Pang, M., Ma, Y. et al. Cellular and Molecular Roles of Immune Cells in the Gut-Brain Axis in Migraine. Mol Neurobiol (2023). https://doi.org/10.1007/s12035-023-03623-1
[7] Miao S, Tang W, Li H, Li B, Yang C, Xie W, Wang T, Bai W, Gong Z, Dong Z, Yu S. Repeated inflammatory dural stimulation-induced cephalic allodynia causes alteration of gut microbial composition in rats. J Headache Pain. 2022 Jun 25;23(1):71. doi: 10.1186/s10194-022-01441-9. PMID: 35752773; PMCID: PMC9233368.
[8] 常露露,刘顶鼎,曾贵荣等.肠道微生物参与偏头痛发病机制的研究进展[J].中国现代应用药学,2022,39(04):560-565.DOI:10.13748/j.cnki.issn1007-7693.2022.04.022.
[9] Arzani M, Jahromi SR, Ghorbani Z, Vahabizad F, Martelletti P, Ghaemi A, Sacco S, Togha M; School of Advanced Studies of the European Headache Federation (EHF-SAS). Gut-brain Axis and migraine headache: a comprehensive review. J Headache Pain. 2020 Feb 13;21(1):15. doi: 10.1186/s10194-020-1078-9. PMID: 32054443; PMCID: PMC7020496.


