J Ethnopharm:蛋白质组学分析揭示黄连干姜汤修复肠道屏障机制,减轻溃疡性结肠炎
时间:2024-01-12 21:16:18 热度:37.1℃ 作者:网络
溃疡性结肠炎(UC)是一种伴有腹痛、腹泻和便血的慢性肠道炎症。临床应用《备急千金要方》黄连干姜汤(HGD)治疗UC。然而,HGD治疗UC的具体机制尚不清楚。我们的研究致力于证明HGD对结肠炎的治疗作用,并阐明其潜在的机制。采用UPLC-MS对HGD的成分进行了鉴定。给予3%右旋糖酐硫酸钠(DSS)溶液诱导UC小鼠一周,再给予HGD处理一周。观察体重波动、疾病活动指数(DAI)、结肠长度和结肠组织病理变化,评价HGD的治疗效果。用ELISA和qPCR检测炎症状态。采用蛋白质印迹、qPCR和免疫荧光检测紧密连接蛋白的表达。进行基于串联质谱标签(TMT)的蛋白质组学和网络药理学,以筛选和预测HGD调节的潜在靶点和途径。基于UPLC-MS/MS分析,在HGD中鉴定出100种成分。处理7天后,HGD显著减轻了结肠炎相关症状,包括体重减轻、结肠缩短、DAI评分增加、组织病理学病变。HGD还降低了炎症细胞因子IL-6和IL-1β水平,增加了杯状细胞的数量,并恢复了结肠中紧密连接蛋白Occludin和Claudin-1。网络药理学研究预测,结肠炎小鼠的紧密连接和MAPK通路可能受到HGD的影响。利用基于TMT的蛋白质组学研究筛选出APOC1作为HGD治疗小鼠的关键靶点。进一步的蛋白质印迹结果显示HGD降低了APOC1、p-P38和p-JNK的表达。HGD在中剂量和高剂量下改善结肠炎小鼠的一般症状,这可能与通过抑制APOC1-JNK/P38 MAPK信号通路恢复紧密连接和肠道屏障完整性和功能有关。
广州中医药大学于洋和汪玉梅教授在Journal of Ethnopharmacology上发表题为Huanglian Ganjiang decoction alleviates ulcerative colitis by restoring gut barrier via APOC1-JNK/P38 MAPK signal pathway based on proteomic analysis论文。

采用UPLC/MS-MS分析法,对中药复方HGD进行化学成分鉴定。HGD正离子和负离子模式下的总离子色谱图(TIC)如图1B–C所示,HGD中的100种成分被鉴定并列在补充表1中。在负离子模式下检测到36个组分,在正离子模式下发现64个组分。每种化合物在HGD中的相对比例如图1D中的饼图所示。生物碱、苯丙素、氨基酸衍生物和酚类化合物是主要化合物,它们的比例分别为55.24%、24.76%、5.42%和5.32%。
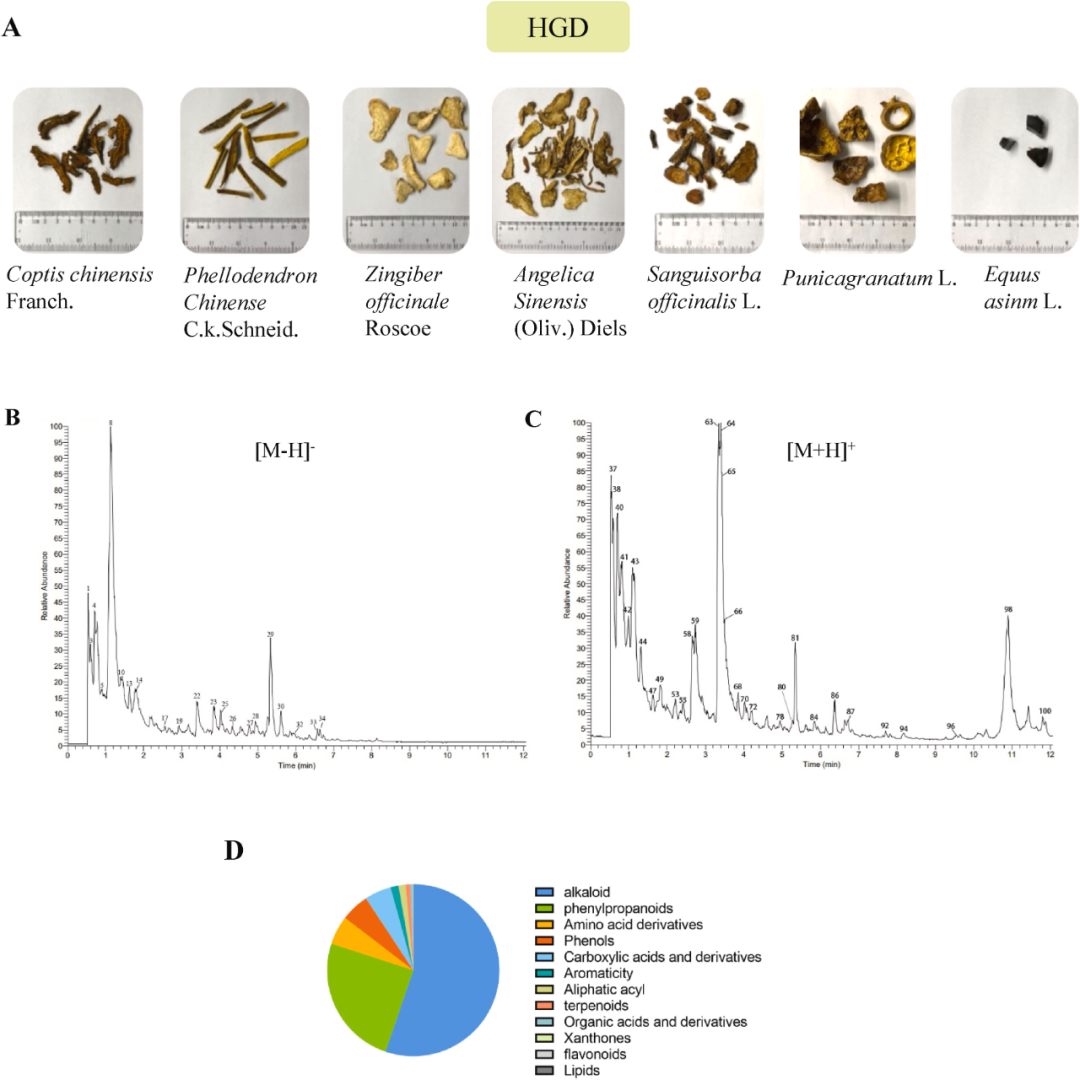
图1 应用UPLC/MS-MS对HGD进行定性分析。(A)HGD中药物的组成。(B)HGD负离子模式下的总离子色谱图。(C)HGD正离子模式下的总离子色谱图。(D)HGD成分类型的比例图。
DSS刺激7天后,出现了一系列结肠炎相关症状,如严重的体重减轻、腹泻、便血、结肠缩短伴病理改变、脾肿大和胸腺萎缩。上述症状在HGD治疗7天后得到改善,特别是中剂量(HGD-M)和高剂量(HGD-H)组获得了与美沙拉嗪类似的效果。HGD-M、HGD-H和美沙拉嗪显著减轻了体重减轻(P<0.0001,P<0.01,P<0.05),降低了DAI评分(P<0.01,P<0.01,<0.05),延长了结肠(P<0.05,P<0.01,P<0.001),减少了脾脏指数(P<0.01,P=0.001)和增加了胸腺指数(P<0.0001)(图2B–F)。
炎症性细胞因子风暴是结肠炎过程中常见的事件,细胞因子的波动可能影响炎症性结肠炎的进展。因此,细胞因子反映了UC进展过程中的炎症状态。我们的ELISA结果显示,与对照组相比,模型组小鼠的IL-6和IL-1β水平在模型组中明显上调(图2I–J),与IL-6和IL-11β的mRNA水平相似(图2G–H)。HGD-M和HGD-H显著降低IL-6(P<0.05)和IL-1β(P<0.05)的mRNA水平以及IL-6(P<0.01,P<0.05)和IL-2β(P<0.01)的蛋白水平。


图2 HGD减轻DSS诱导的结肠炎小鼠。(A)UC小鼠模型的建立及药物治疗。(B)小鼠体重的变化。(C)DAI得分。(D)宏观结肠和长度测量。(E)胸腺指数。(F)脾脏指数。(G)IL-6 mRNA在结肠组织中的表达。(H)IL-1β mRNA在结肠组织中的表达。(I)血清IL-6水平。(J)结肠组织中IL-1β水平。每组n=6。Low,低剂量的HGD(5g/kg);Medium,中等剂量的HGD(10 g/kg);High,高剂量的HGD(20 g/kg)。与对照组比较#P<0.05、##P<0.01、###P<0.0001,与模型组比较,*P<0.05,**P<0.01,***P<0.001,***<0.0001。
3. HGD改善了结肠组织结构,修复了结肠黏膜组织
H&E染色结果显示,模型组结肠上皮细胞和肠腺排列紊乱,隐窝形状也发生改变。大量炎性细胞浸润于结肠黏膜和黏膜下层,并伴有结肠肌层水肿。服用HGD后,这些变化得到缓解,在HGD-M、HGD-H组和美沙拉嗪组中尤为明显(图3A–B)。此外,HGD还以剂量依赖的方式恢复了结肠组织的病理变化。AB-PAS和PAS染色结果显示,与对照组相比,模型组结肠杯状细胞数量和糖蛋白含量减少,HGD治疗组和美沙拉嗪组恢复正常(图3C–F)。
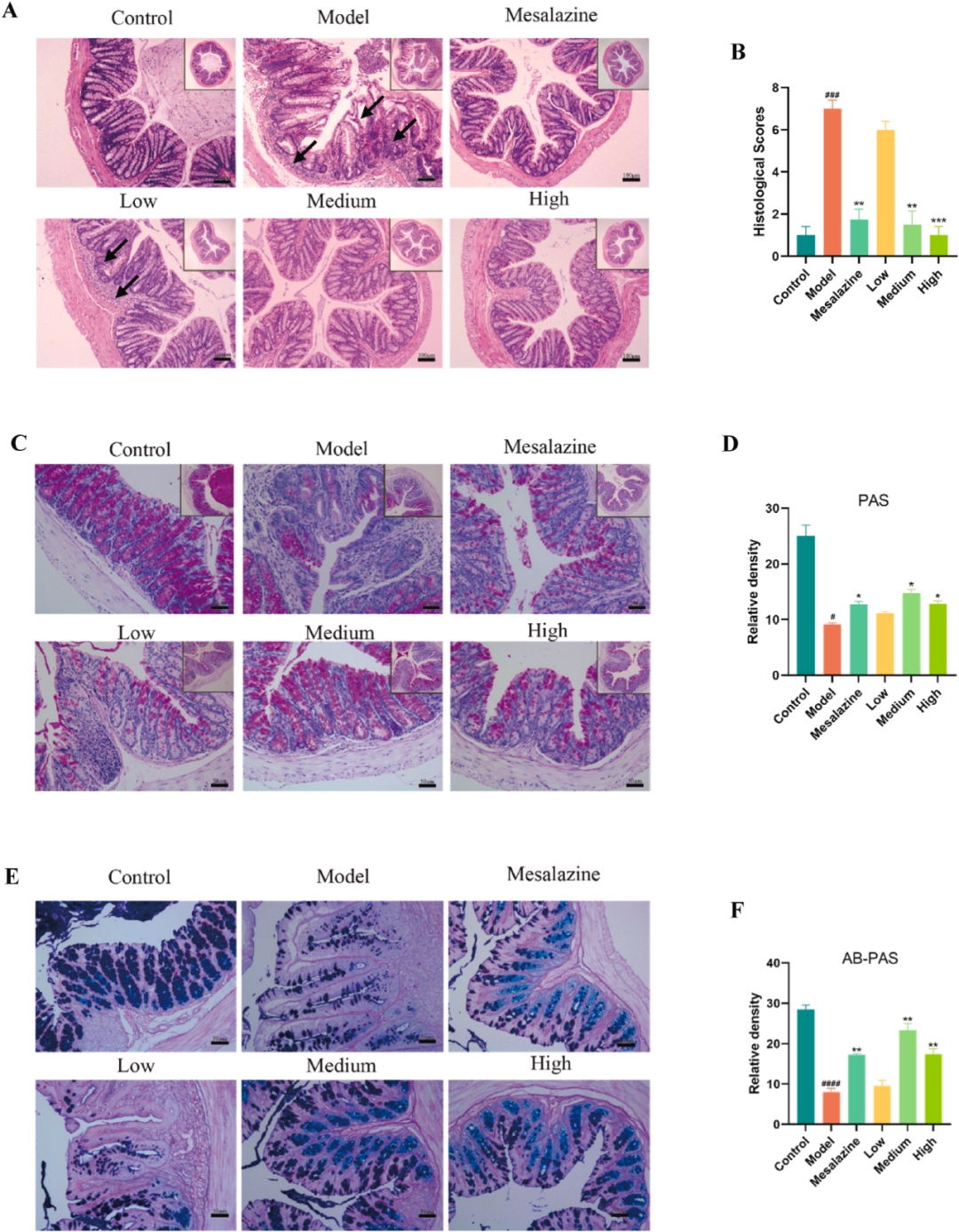
图3 HGD改善结肠组织结构,修复结肠粘膜组织。(A)结肠组织的H&E染色。图中的黑色箭头标记为隐窝消失和炎症细胞浸润的位置。(B)结肠组织H&E染色的组织学评分。(C)结肠组织PAS染色。(D)结肠组织PAS染色阳性区域的比例。(E)结肠组织的AB-PAS染色。(F)结肠组织AB-PAS染色阳性面积的比例。每组n=4。Low,低剂量的HGD(5g/kg);Medium,中等剂量的HGD(10 g/kg);High,高剂量的HGD(20 g/kg)。与空白组相比,##P<0.01、###P<0.001,与模型组相比,*P<0.05,**P<0.01,***P<0.001。
4. HGD恢复结肠炎小鼠的紧密连接蛋白和肠道屏障的完整性
紧密连接蛋白ZO-1、Occludin、Claudin-1的mRNA在模型组中下调,而在中剂量和高剂量的HGD中上调(图4E–G)。免疫荧光结果显示,与对照组相比,模型组紧密连接蛋白Occludin和Claudin-1的表达显著降低(P<0.001,P<0.01),HGD-M、HGD-H显著增加Occludin(P<0.05,P<0.001)和Claudiin-1的表达(P<0.01,图4A–D)。蛋白质印迹结果也显示出类似的趋势(图4H–J)。上述结果表明,HGD可维持紧密连接,降低肠道通透性,增强肠道屏障功能。


图4 HGD恢复了结肠炎小鼠的紧密连接蛋白和肠道屏障的完整性。(A)免疫荧光法检测Occludin在结肠中的表达。(B)免疫荧光法检测Claudin-1在结肠中的表达。(C)免疫荧光法检测Occludin阳性区域的相对密度。(D)免疫荧光中Claudin-1阳性区域的相对密度。(E)ZO-1。(F)Occludin的mRNA表达。(G)Claudin-1。(H)免疫印迹法检测Occludin和Claudin-1在结肠中的表达。每组n=4。(I)各组中Occludin的相对水平。(J)免疫印迹检测各组Claudin-1的相对水平。Low,低剂量的HGD(5g/kg);Medium,中等剂量的HGD(10 g/kg);High,高剂量的HGD(20 g/kg)。与对照组比较#P<0.05、##P<0.01、###P<0.001,与模型组比较,*P<0.05,**P<0.01,***P<0.001,***<0.0001。
为了分析HGD治疗UC的潜在机制,进行了网络药理学分析。利用TCMSP数据库筛选出155个受UPLC/MS-MS鉴定化合物影响的潜在靶点。利用Genecards数据库获得4800个UC疾病靶点。利用Venn图发现101个HGD和UC的共同靶点。(图5A)。Cytoscape用于构建HGD成分、HGD靶点和UC靶点之间的交互网络(图5B)。GO分析结果表明,HGD通过影响几个生物学过程、细胞成分和分子功能对UC产生治疗作用(图5D)。前三个生物学过程是脂多糖介导的信号通路、miRNA转录的积极调节和上皮细胞凋亡过程的调节,这表明肠上皮屏障的变化可能是HGD影响UC的关键过程。KEGG分析结果表明,该机制可能与丝裂原活化蛋白激酶(MAPK)信号通路和紧密连接有关(图5C),基于常见分子靶点的数量和P值。先前的一些研究表明,p38 MAPK信号通路可以下调紧密连接蛋白Occludin和Claudin-1。因此,我们从屏障修复和MAPK信号通路的角度探讨了HGD抗结肠炎活性的机制。
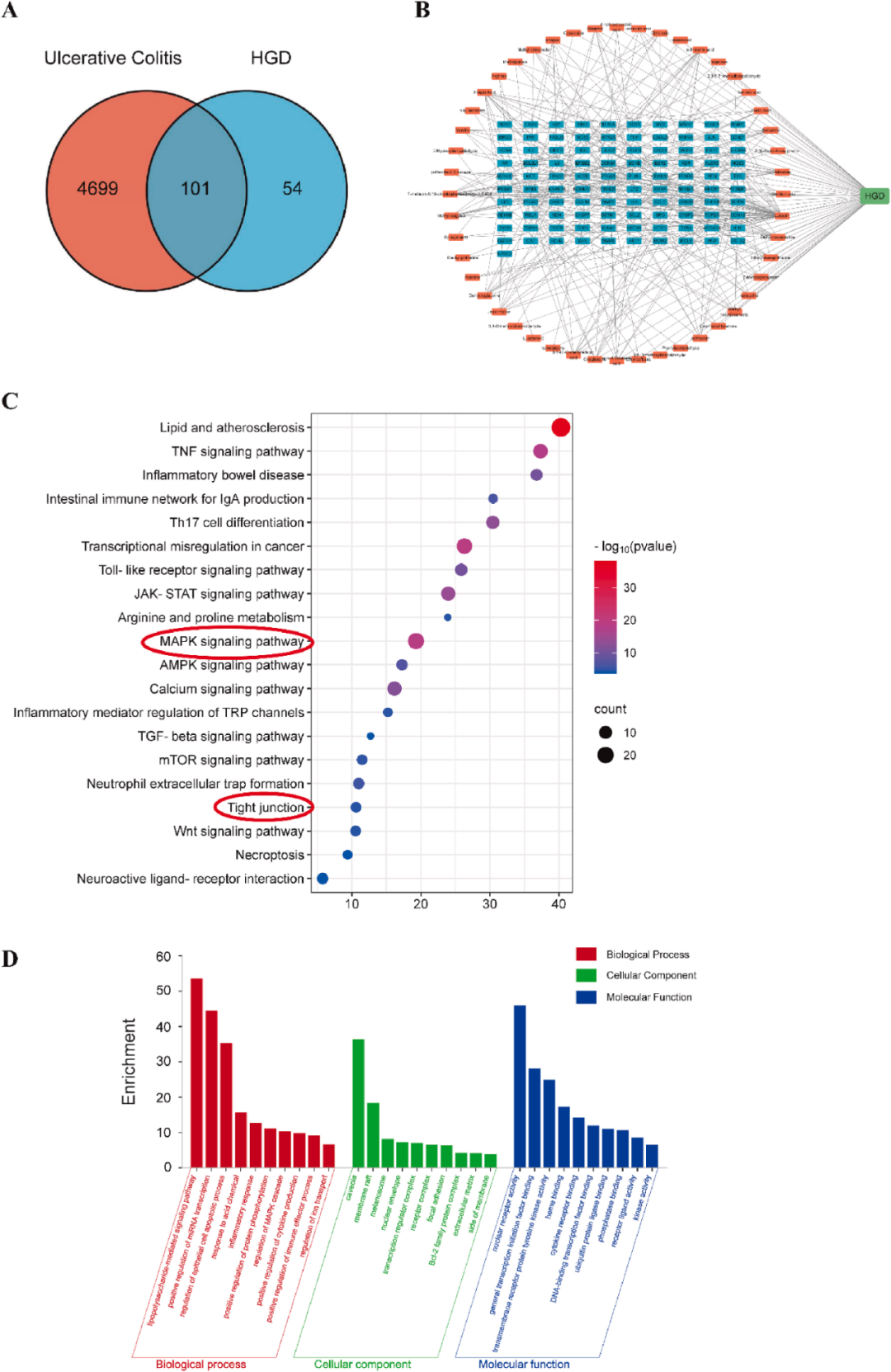
图5 HGD治疗结肠炎的网络药理学分析。(A) HGD和UC疾病靶点中潜在靶点的交叉点。(B)HGD成分、HGD靶点和UC靶点之间的作用网络。(C)HGD与UC共同靶点的KEGG分析。(D)HGD和UC共同靶点的GO分析。
6. 基于蛋白质组学分析表明,APOC1是HGD对结肠炎小鼠的潜在调控靶点
为了进一步探索HGD修复肠道屏障的潜在机制,在对照组、模型组和HGD治疗组中启动了蛋白质组学研究。我们收集了不同表达的蛋白质(DEPs),这些蛋白质在模型组中上调,但在HGD处理组中下调,反之亦然。在基于TMT的蛋白质组学分析的数据中,290个DEPs的表达在模型组中显著升高,并且在HGD处理后显著下调。26个DEPs的表达在模型组中显著下调,同时在HGD处理组中明显逆转(图6A)。以上交叉的不同表达的蛋白质(DEP)列于补充表2中。
经过生物信息学富集分析,DEP主要富集在葡聚糖代谢过程、能量储备代谢过程等多种生物过程中,以及IL-17信号通路、中性粒细胞胞外陷阱形成和糖酵解/糖异生等多种信号通路中(图6B-C)。其中,APOC1在模型组中显著上调(P<0.01),在HGD组中明显下调(P<0.01,图6D–E),引起了我们的注意。据报道,APOC1与MAPK信号通路和肠道炎症反应密切相关。因此,APOC1被筛选为HGD改善结肠炎小鼠的潜在靶点。
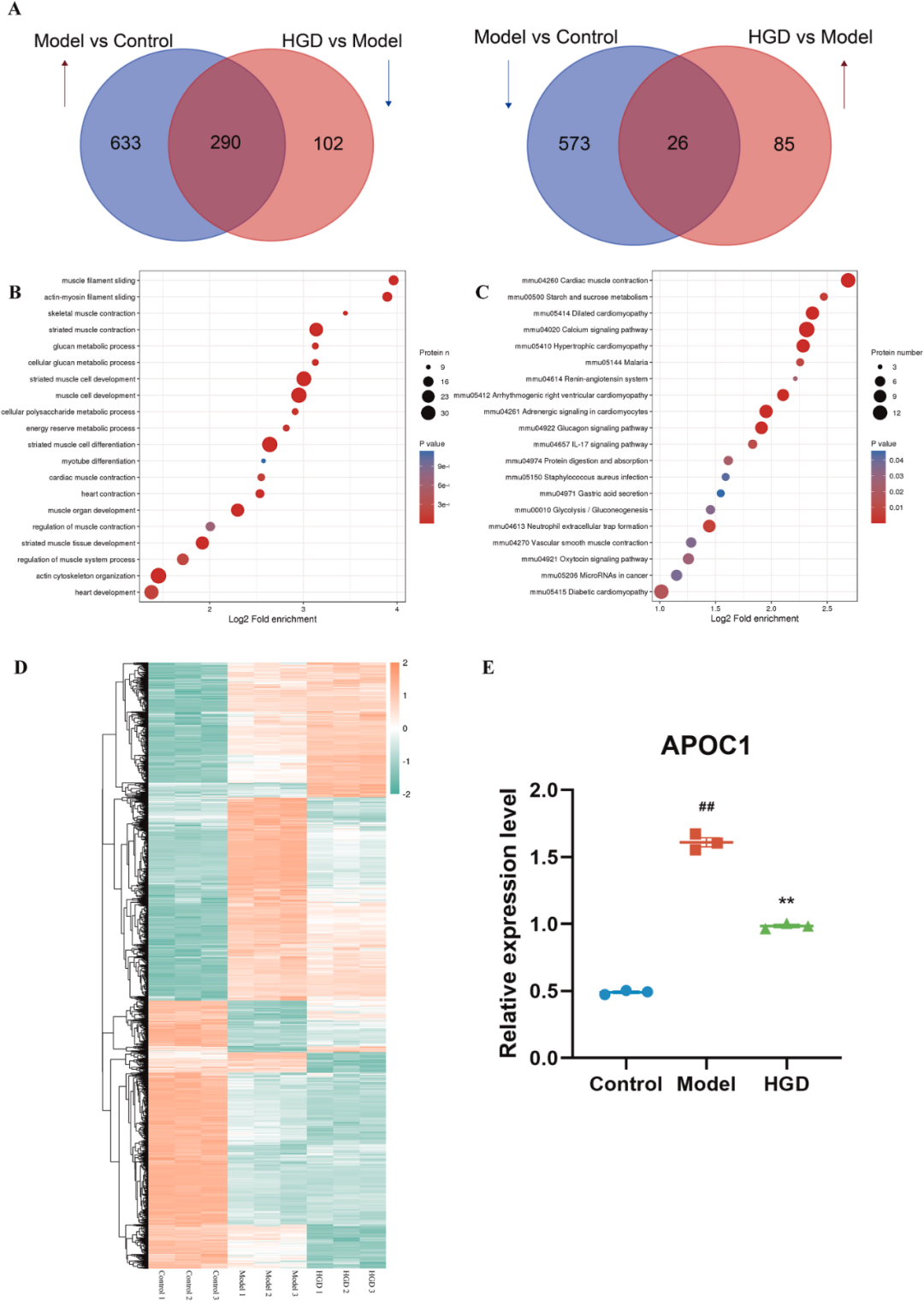
图6 基于蛋白质组学分析表明,APOC1是HGD针对结肠炎小鼠调节的潜在靶点。(A)DEP在模型组中上调,但在HGD组中下调,与模型组相反。(B)共同DEP的生物过程富集分析。(C)共同DEP的KEGG富集分析。(D)共同DEP的热图。(E)APOC1在小鼠结肠中的蛋白质组学表达。n=3。HGD,黄连干姜汤治疗组。与对照组比较##P<0.01,与模型组比较**P<0.01。
7. HGD通过抑制APOC1-JNK/ P38 MAPK信号通路恢复肠道屏障
结合网络药理学和蛋白质组学的结果,我们认为HGD通过影响APOC1-JNK/P38MAPK信号通路来改善肠道屏障和减轻结肠炎的机制。为了验证这一假设,使用蛋白质印迹检测APOC1和相关下游分子在MAPK信号通路中的表达。与对照组相比,模型组p-p38-MAPK(p<0.01)、p-JNK(p<0.05)和APOC1(p<0.05)均显著升高,Occludin(p<0.01)和Claudin-1(p<0.001)降低。HGD治疗后,P-P38-MAPK(P<0.01)、P-JNK(P<0.05)和APOC1(P<0.05)显著降低,Occludin(P<0.01)和Claudin-1(P<0.01)增加(图7A–F),表明HGD抑制APOC1和下游MAPK信号,紧密连接通路。总之,HGD可能通过抑制APOC1-JNK/P38MAPK信号通路来增强紧密连接并恢复肠道屏障功能。
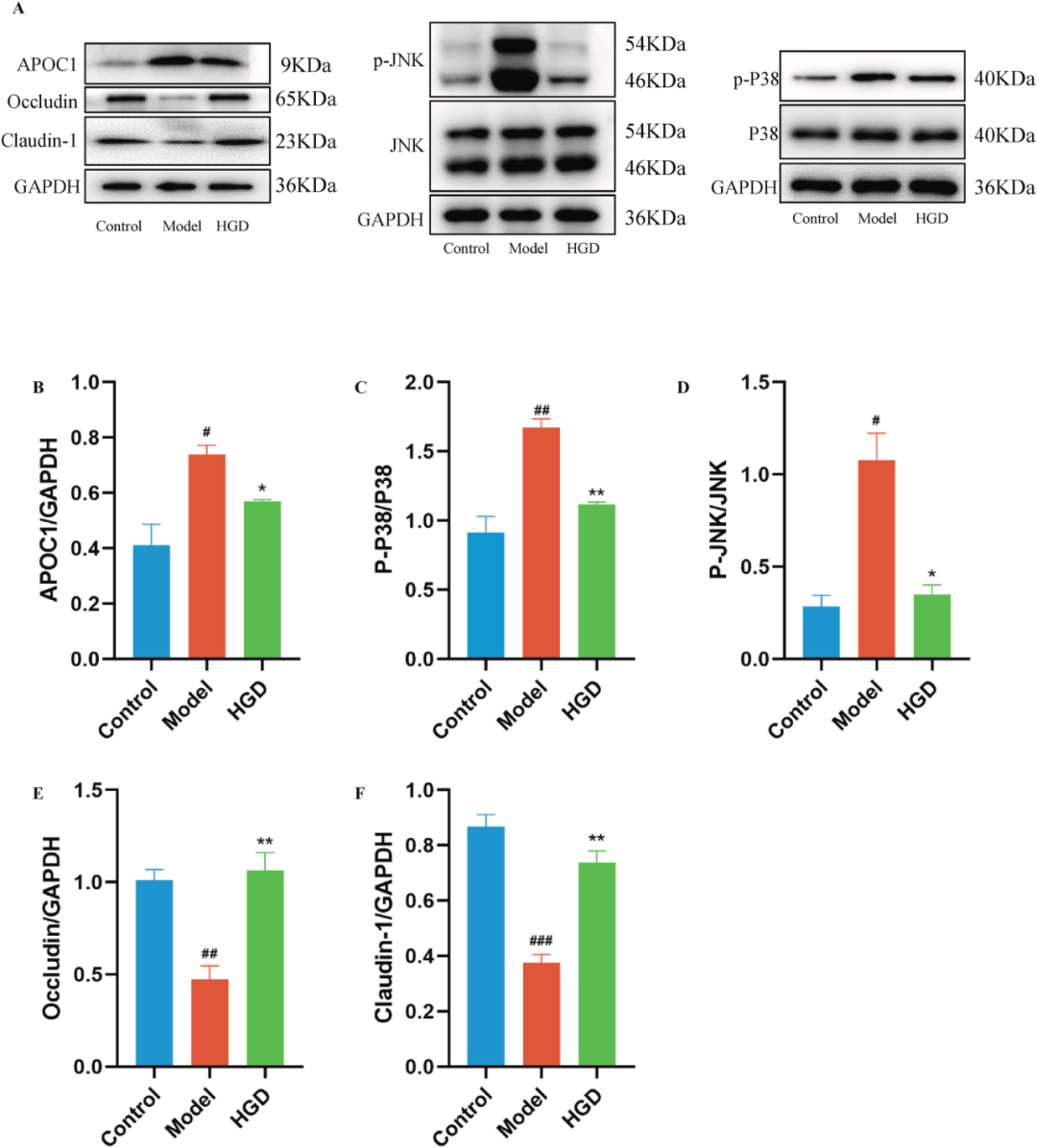
图7 HGD通过抑制APOC1/P38MAPK信号通路恢复肠道屏障。(A)免疫印迹法检测APOC1、p-JNK、JNK、p-P38、P38、Occludin和Claudin-1在结肠中的表达。(B)APOC1。(C)p-P38。(D)p-JNK的统计分析。(E)Occludin的统计分析。(F) Claudin-1的统计分析。每组n=4。HGD、黄连干姜汤治疗组。与对照组比较#P<0.05、##P<0.01、###P<0.001,与模型组比较*P<0.05、**P<0.01。
UC作为一种慢性肠道疾病,由于反复发作,降低了患者的日常生活质量,增加了社会负担。UC的临床表现为腹泻、粪便带血和粘液、腹痛以及关节损伤和皮肤黏膜病变等几种并发症。HGD在临床上已用于治疗腹痛、腹泻,唐《备急千金要方》有记载。现代药理学研究发现,HGD减轻了结肠炎相关症状并减轻了炎症。
化学成分分析是中药药理作用和机制作用的基础,因此采用UPLC-MS/MS对HGD的化学性质进行了分析。结果表明,HGD的主要成分类型为生物碱、苯丙素和酚类。此外,HGD的主要化合物为6-姜烯酚、黄连素、表小甓碱,3-羟基苯甲酸和没食子酸。据报道,6-姜烯酚通过减少促炎细胞因子TNF-α、IL-6、IL-1β,增强抗氧化因子Nrf-2和HO-1的表达,减轻结肠炎并加速结肠炎伤口修复。黄连素可以通过恢复肠道屏障、减少肠道神经胶质细胞的驻留和免疫细胞的过度激活来改善UC的严重程度。没食子酸可以调节代谢和细菌特征,包括恢复肠道微生物群稳态,增加碳水化合物代谢和胆汁酸代谢,降低氨基酸代谢,从而改善溃疡性结肠炎。因此,6-姜烯酚、黄连素和没食子酸可能是HGD改善结肠炎的主要物质基础。
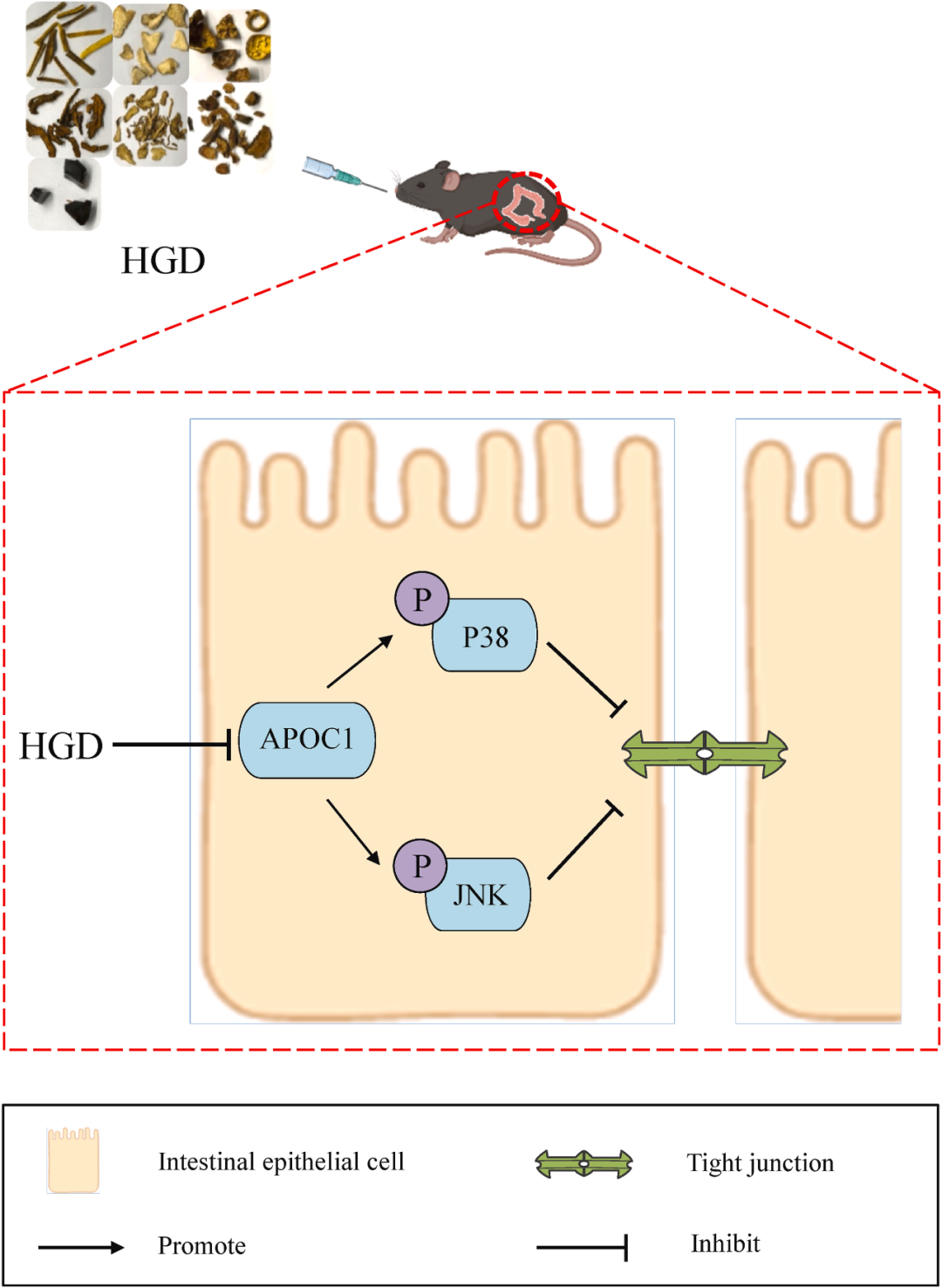
图8 HGD预防结肠炎机制的示意图。HGD可抑制APOC1-JNK/P38MAPK通路,恢复紧密连接,从而保护肠道屏障功能,改善结肠炎。
为了评价HGD的治疗效果,用3%DSS建立小鼠结肠炎模型,持续7天,并用HGD治疗。我们的研究发现,HGD可以减轻体重减轻,增加DAI,胸腺萎缩,脾肿大,缩短结肠。HGD还降低了结肠炎症状态,包括炎症细胞因子IL-6和IL-1β的下降。以上结果表明,HGD可以缓解结肠炎相关症状。
肠道屏障是抵御细菌、病毒等外部致病菌的第一道防线。当肠道屏障受损时,肠道通透性增加,导致微生物群从肠道内腔泄漏到肠道固有层。侵袭性致病抗原诱导炎症反应,并进一步破坏结肠屏障,形成恶性循环。我们的结果表明,HGD修复了受损的结肠组织,并恢复了紧密连接。具体而言,通过H&E、PAS、AB-PAS染色,HGD改善了结肠腺和绒毛的排列,减少了炎症细胞在固有层中的浸入,恢复了杯状细胞的结构和数量。此外,HGD通过免疫荧光和蛋白质印迹增强结肠紧密连接蛋白Occludin和Claudin-1的表达。
为了研究HGD在修复紧密连接和肠道屏障中的潜在机制,基于UC和UPLC/MS-MS从HGD中鉴定的成分之间的共同靶点进行了网络药理学分析。KEGG富集结果表明,MAPK信号通路和紧密连接可能主要与HGD的抗结肠炎作用有关。MAPK通路由细胞外信号调节激酶(ERK)1/2、c-Jun N末端激酶(JNK)、P38 MAPK(P38)组成,被细胞外信号如生长和分化因子激活。P38 MAPK(P38丝裂原活化蛋白激酶)信号通路参与炎症、细胞凋亡和细胞分化。JNKs(c-Jun N-末端激酶)也是MAPKs的一员,根据现有研究,MAPKs也参与UC的进展。P38 MAPK抑制剂降低了LPS诱导的紧密连接蛋白ZO-1、Occludin和Claudin-1表达的抑制作用。此外,JNK的敲除保护上皮屏障功能免受损伤。因此,P38MAPK和JNK参与了肠道屏障完整性的负调控,并参与了UC的发病机制。JNK/P38MAPK紧密连接信号通路可能介导结肠炎小鼠HGD的屏障保护。
蛋白质组学将有助于确认靶向治疗。进一步进行蛋白质组学研究,以探索HGD影响的MAPK紧密连接信号的上游分子靶点。基于TMT的定量蛋白质组学筛选了HGD治疗结肠炎小鼠和恢复肠上皮屏障的优选靶点。在不同表达的蛋白质中,APOC1在模型组明显升高,而在HGD组明显降低,表明APOC1可能是HGD介导的靶点。
载脂蛋白C1(APOC1)是参与脂质转运和代谢的一种载脂蛋白。根据目前的研究,APOC1可能与多种癌症进展有关,并作为评估癌症患者预后的生物标志物。先前的研究发现,在APOC1+/+小鼠中,发生了一些结肠炎相关事件。例如,结肠的宏观和组织病理学异常改变,血清IL-10水平降低,而炎性细胞因子IL-12p40、IL-6和TNF-α增加。全基因组基因分析发现,一些与肠道屏障和宿主防御相关的基因,如抗微生物肽,被下调。这些发现表明APOC1与结肠炎的进展有关。此外,Ren等人发现敲低APOC1降低了大肠癌癌症细胞中p38的磷酸化,而不影响总p38,这表明APOC1与MAPK信号通路呈正相关。APOC1还被报道通过调节JNK/MAPK途径加速癌症的进展。我们的研究指出,HGD显著降低APOC1的表达,并下调P38 MAPK和JNK信号通路的磷酸化。Occludin和Claudin-1的表达水平也通过给予HGD而逆转。这些结果表明,HGD通过抑制APOC1-JNK/P38 MAPK途径恢复了肠道屏障稳态(图8)。本研究不仅证实了中药复方治疗结肠炎的安全性和有效性,而且为临床应用生长激素治疗结肠炎提供了科学依据。
总之,HGD减轻了DSS诱导的结肠炎相关症状,并在中剂量和高剂量下恢复了肠道屏障稳态。HGD的潜在机制可能是抑制APOC1-JNK/P38MAPK通路。特别是,HGD抑制APOC1和JNK/P38MAPK的下游磷酸化,维持紧密连接的完整性,从而保护肠道屏障功能和完整性。
https://doi.org/10.1016/j.jep.2023.116994














