病理干货 | 胃癌靶点介绍
时间:2024-01-26 19:30:51 热度:37.1℃ 作者:网络
我国是胃癌发病大国,2020年新确诊的胃癌患者数量接近48万,死亡患者数量超过37万。大部分患者初始确诊已处于中晚期,治疗方式非常有限。HER2扩增/高表达在胃癌中的发生率为12%-20%左右【1】,也同样面临耐药的问题。占大多数的HER2阴性的晚期患者正处于无靶药可用的境地。所以胃癌患者急需要新的靶向药物来延长生存期。目前胃癌晚期研究热点靶点包括Claudin 18.2、FGFR2、MET、HER2等【2】,相信随着研究的深入,这些靶点的突破性进展将会为胃癌患者的治疗打开一个全新的局面。
01 靶点一. MET基因扩增
MET基因全称间质-上皮细胞转化因子(mesenchymal-epithelial transition factor),编码的蛋白为c-MET蛋白,其在调节肿瘤形成、生长、维持和侵袭中起重要作用。4%-10%的胃癌中可以检测到MET基因扩增,MET扩增在弥漫性胃癌中发生率为15%。具有MET扩增的胃癌具有低分化、腹膜转移以及癌性淋巴管炎的临床特点,故相较于无MET扩增/过表达的患者,MET扩增/过表达的胃癌患者总生存期更短,预后更差【3】。根据一项对1589例胃癌样本的研究,在HER2阳性的患者中有22%的患者呈现MET扩增阳性,这部分两个RTK同时异常的患者预后更差。
赛沃替尼(Savolitinib)为一种特异性靶向MET蛋白的酪氨酸激酶抑制剂(TKI),其选择性抑制MET激酶的磷酸化发挥抗肿瘤的作用。赛沃替尼已于2021年6月在中国获得批准上市,用于治疗MET 14外显子跳跃突变的晚期非小细胞肺癌。赛沃替尼在PDX小鼠模型中表现出对胃癌的剂量依赖性抑制能力,与化疗联合时疗效更为显著,I期临床试验观察到在MET扩增患者(拷贝数9.7-18.4)中实现了35.7%的ORR,64.3%的DCR,而在联合多西他赛后线治疗MET扩增胃癌时,持续缓解达297天。在The VIKTORY Umbrella Trial【4】研究中,MET扩增的胃癌患者选择赛沃替尼单药方案,患者的中位无进展生存期为5.7个月,超过了对照组的3.8个月,中位总生存期为9.8个月,也明显超过了对照组的6.8个月。其中18例病灶可评估的MET扩增患者接受了赛沃替尼单药方案治疗后整体缓解率为55.6%。除了赛沃替尼,小分子激酶抑制剂AMG337和卡马替尼等治疗MET扩增/过表达的胃癌研究中也有不错的表现【5】。
02 靶点二. FGFR2基因扩增
FGFR2成纤维细胞生长因子受体2,与FGF配体结合后激活受体酪氨酸激酶,可激活RAS-MAPK和PI3K-AKT通路(图1)。FGFR变异包括突变、融合和扩增。肺癌、肝癌、肝内胆管癌、乳腺癌、胃癌、子宫癌及尿路上皮癌等实体瘤中广泛存在FGFR变异,并且不同癌种的FGFR突变类型及频率也存在差异,在胃癌中常见FGFR2扩增和过表达。5%~10%的胃食管腺癌患者存在FGFR2b扩增和过表达,HER2扩增/表达阴性的胃癌中FGFR2b阳性比例则高达30%。
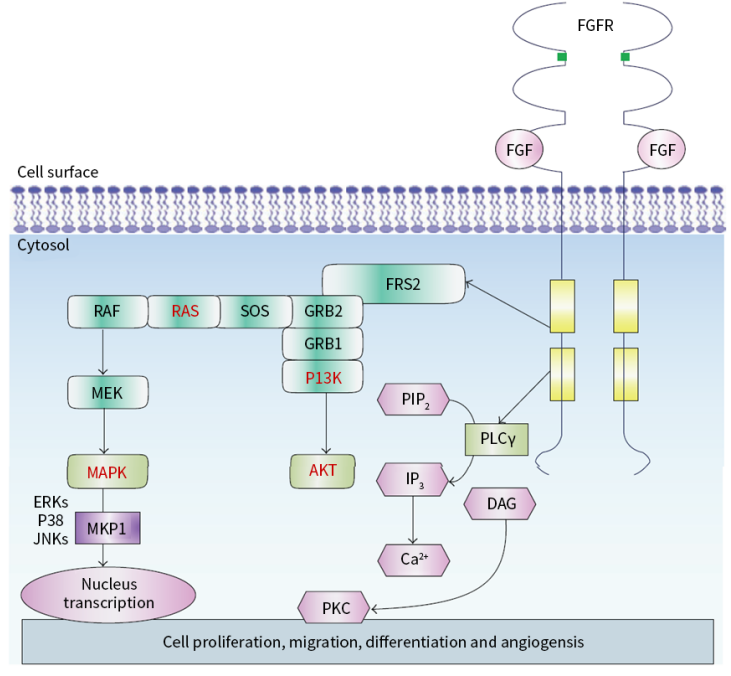
▲图1 FGFR介导的信号通路图
全球针对FGFR2抑制剂的开发,当前主要有3个品种,分别为安进公司与再鼎开发的单抗药物Bemarituzumab(最高临床II期)、Russian Pharmaceutical Technologies公司的Alofanib(最高临床I期)、Relay Therapeutics公司开发的RLY-4008(最高临床I期)。FGFR2b单抗Bemarituzumab在晚期胃癌中的II期研究数据发表在柳叶刀杂志【6】,结果显示:Bemarituzumab组的中位PFS为9.5个月,安慰剂组的中位PFS为7.4个月,风险比(HR)=0.68。研究还分析了 FGFR2b蛋白不同表达程度对药物疗效的影响,结果显示阳性表达比例越高药物的疗效越好,≥10%肿瘤细胞存在FGFR2b过表达的亚组,Bemarituzumab与安慰剂组的PFS分别为14.1个月和7.3个月。FDA已经授予Bemarituzumab突破性疗法称号,用于联合改良的FOLFOX6方案(mFOLFOX6),一线治疗FGFR2b阳性、HER2阴性的局部晚期或转移性胃及胃食管交界处癌患者。
03 靶点三. HER2
原癌基因人表皮生长因子受体2(HER2),即C-erbB-2 基因,编码相对分子质量为 185kD 的跨膜受体蛋白。目前靶向HER2的药物主要有单克隆抗体、小分子络氨酸酶抑制剂(TKI)、抗体偶联药物(ADC)和新型抗体等。以HER2为靶点的靶向治疗手段是HER2阳性晚期胃癌的主要探索方向,但抗HER2一线治疗后疾病进展患者的疗效欠佳,曲妥珠单抗耐药后的治疗方案有限;单克隆抗体如帕妥珠单抗,小分子酪氨酸激酶抑制剂如拉帕替尼不能为HER2阳性晚期胃癌带来更多获益。所以对于HER2阳性的晚期患者的探索仍然是一个重要的研究方向。新型抗体偶联药物(ADC)兼备单抗药物的“靶向制导”作用和化疗药物的强效抗肿瘤效应,为HER2阳性晚期胃癌的治疗带来新的希望。
抗体偶联药物(antibody-drugconjugate,ADC)由抗体、连接子和细胞毒性药物三部分组成,当ADC进入体内后,特异性抗体部分可靶向识别肿瘤细胞表面抗原并与之结合,ADC整个被肿瘤细胞内吞后,进入溶酶体进行降解,从而释放小分子细胞毒性药物并发挥作用。
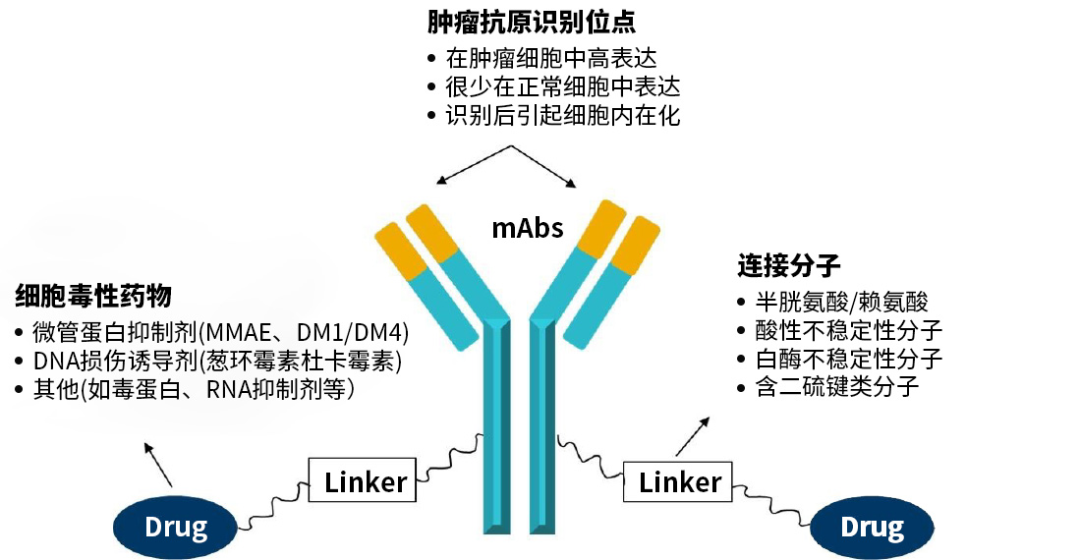
▲ 图2 抗体偶联药物
由阿斯利康和第一三共合作研发的HER-2抗体偶联药物(ADC)Fam-trastuzumab deruxtecan-nxki(DS-8201,T-DXd),商品名Enhertu,是由曲妥珠单抗和拓扑异构酶I抑制剂 exatecan衍生物组成。DESTINY Gastric-01【7】研究结果显示:对187例先前接受过2种或多种方案的HER-2阳性晚期胃癌或胃食管交界腺癌患者进行Enhertu或化疗(紫杉醇或伊立替康单药治疗),与化疗相比Enhertu显著延长生存期,Enhertu治疗组ORR从14.3%提高至51.3%,DOR从3.9个月延长至12.5个月,PFS从3.5个月延长至5.6个月,中位OS从8.4个月延长至12.5个月。2021年1月FDA批准Enhertu用于治疗既往接受过曲妥珠单抗治疗的局部晚期或转移性HER-2阳性胃或胃食管交界腺癌,Enhertu(DS-8201,T-DXd)是第一个被批准治疗HER-2阳性胃癌的抗体偶联药物(ADC)。
维迪西妥单抗是我国自主研发的ADC新药,其是由人源化抗HER2单克隆抗体Hertuzumab与微管蛋白抑制剂MMAE通过可裂解连接子偶联而成。在RC48-C008【8】研究中,维迪西妥单抗用于治疗至少接受过二线化疗失败的、HER-2过表达的局部晚期或转移性胃癌(包括胃食管交界部癌),研究结果显示实验组的客观缓解率ORR达24.8%,中位无进展生存期(PFS)和中位总生存期(OS)分别为4.1个月和7.9个月,具有出较好的疗效与安全性。基于此国家药品监督管理局(NMPA)批准维迪西妥单抗用于治疗至少接受过2种系统性化疗的HER-2阳性胃癌患者。
目前ADC已成为HER2阳性晚期胃癌后线治疗的新方案,更多的ADC药物正在临床实验中,如ARX788,期待这些ADC为HER2阳性胃癌治疗带来更多生存获益。
04 靶点四. VEGFR-2
血管内皮生长因子受体(vascular endothelial growth factor receptor,简称VEGFR)属于酪氨酸激酶受体超家族,包括 VEGFR-1、VEGFR-2和VEGFR-3。其中VEGFR-1主要在造血细胞发育过程中表达,VEGFR-3可促进淋巴管内皮细胞的生长,VEGFR-2主要在血管内皮细胞和造血干细胞中表达,VEGFR-2可介导VEGF调控的细胞信号转导通路,刺激血管内皮细胞增殖,导致血管生长,VEGFR-2可与多种VEGF配体(VEGF-A,C,D,E)结合,形成同源二聚体复合物,使其蛋白构象发生改变,络氨酸残基发生自磷酸化并将信号传导到下游。其中,主要的信号通路包括Ras/Raf/MAPK和PI3K/AKT,这些信号通路被激活后会导致激活转录因子、干扰细胞周期、促进细胞迁移、维持细胞增殖、抑制细胞凋亡,促进肿瘤发生和发展。另一方面,生长中的肿瘤细胞在缺氧状态下可激活HIF-1&alpha蛋白,诱导VEGF-A转录表达和分泌,VEGF-A与肿瘤细胞周边血管内皮细胞上的VEGFR-2结合,刺激血管生成反应,导致肿瘤生长。
RAINBOW研究【9】评估经过一线治疗进展的胃癌患者使用紫杉醇加雷莫西尤单抗与紫杉醇加安慰剂相比的安全性和有效性。紫杉醇加雷莫西尤单抗组对比紫杉醇联合安慰剂组中位OS时间为9.6 个月 vs 7.4个月,(HR=0.807,95% CI,0.678~0.962)。12个月的生存率比对照组更长。两组的中位PFS分别为4.4个月和2.86个月,而ORR则为28%及16%(P=0.0001)。在RAINBOW研究的基础上,RAINBOW-Asia研究【10】进一步探索了亚洲人群应用雷莫西尤单抗联合紫杉醇方案的疗效和安全性特征。结果显示:雷莫西尤单抗+紫杉醇组患者对比安慰剂+紫杉醇组患者的中位PFS分别为4.14个月和3.15个月(HR=0.765,p=0.0184),两组中位OS分别为8.71个月和7.92个月(HR=0.963,p=0.7426)。基于以上两个研究成果,2023年胃癌CSCO指南将雷莫西尤单抗联合紫杉醇作为二线治疗的首选(表1)。
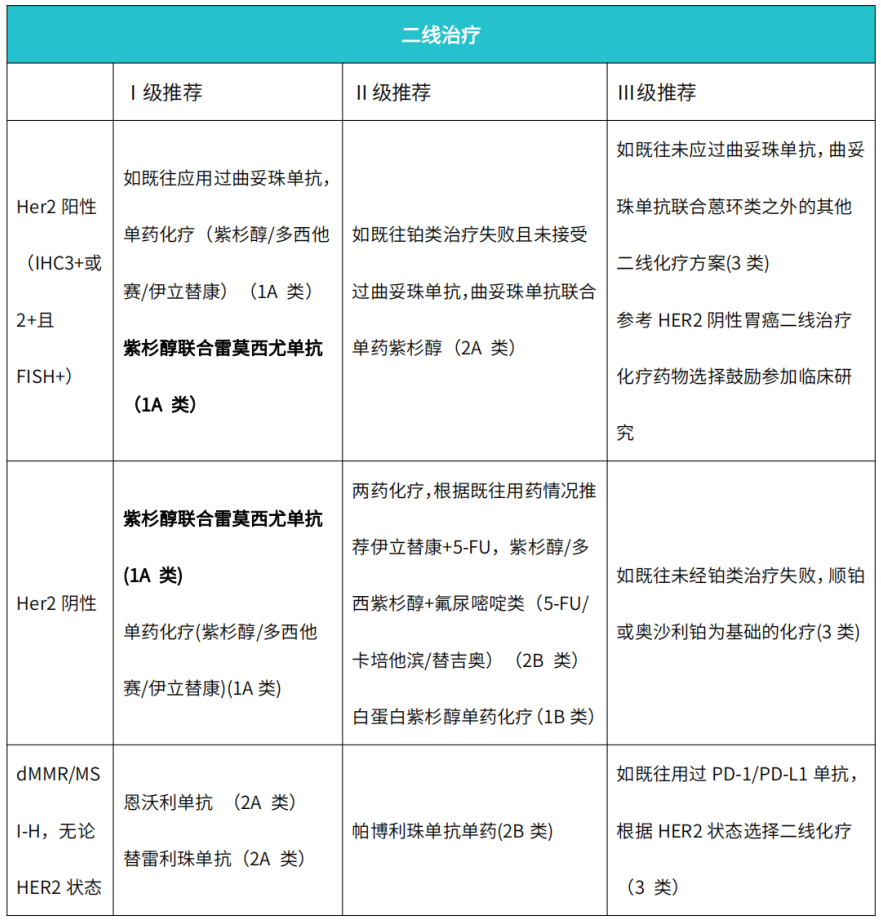
▲ 表1 2023 CSCO胃癌诊疗指南
随着对胃癌研究的不断深入,相信会发现越来越多的治疗靶点丰富胃癌的治疗方案,精准治疗是肿瘤治疗的发展趋势,也是最大化患者获益的重要基础。希望基于靶点的新药研发能取得更多成果,助力于延长患者生存期。
*本文(包括图片)仅供行业交流学习用,不作为医疗诊断依据。
参考文献
1. Bartley AN,Washington MK,Colasacco C,et al.HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma:Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol. 2017 Feb; 35(4):446-464.
2. CSCO胃癌诊疗指南2023版
3. Avan A,Maftouh M,Funel N,et al. Giovannetti E.2014;21(8):975-89. MET as a Potential Target for the Treatment of Upper Gastrointestinal Cancers: Characterization of Novel C-Met Inhibitors from Bench to Bedside. Curr Med Chem. DOI:10.2174/09298673113209990231
4. Lee J, Kim ST, Kim K, et al. Cancer Discov. 2019;9(10):1388-1405.Tumor Genomic Profiling Guides Patients with metastatic Gastric Cancer to Targeted Treatment: The VIKTORY Umbrella Trial. doi:10.1158/2159-8290.CD-19-044
5. Hong DS,et al., Phase 1 Study of AMG 337, a Highly Selective Small-Molecule MET Inhibitor, in Patients With Advanced Solid Tumors. Clin Cancer Res. 2018 Nov 13. pii: clincanres.1341.2018.
6. Lancet Oncol. 2022 Nov; 23(11): 1430-1440. doi: 10.1016/S1470-2045(22)00603-9.
7. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2–positive advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Final overall survival (OS) results from a randomized, multicenter, open-label, phase 2 study (DESTINY-Gastric01).2022 ASCO GI.
8. GONG JF,SHEN L,WANG wx,et al. Safely,pharmacokinetics and efficacy of RC48 - ADC in a phase I study in patients with HER2-overexpression advanced solid cancer[ J].J Clin Oncol, 2018, 36:e16059.
9. Wilke H, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014; 15: 1224-35
10. Rui-Hua Xu, et al. RAINBOW-Asia: A randomized, multicenter, double-blind, phase 3 study of ramucirumab plus paclitaxel versus placebo plus paclitaxel in the treatment of advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma following disease progression on first-line chemotherapy with platinum and fluoropyrimidine. 2021 ASCO GI. Abstract 199.


