Cell子刊:吴晨/林东昕发现警报蛋白通过重编程癌相关成纤维细胞影响食管癌的化疗耐药
时间:2024-05-27 06:00:17 热度:37.1℃ 作者:网络
化疗仍然是晚期食管癌的一线治疗方法。然而,由于难以捉摸的化学耐药性,只有有限的个体才能获得持久的益处。
2024年5月21日,中国医学科学院/北京协和医学院吴晨及林东昕共同通讯在Cell Reports Medicine 在线发表题为“Alarmin S100A8 imparts chemoresistance of esophageal cancer by reprogramming cancer-associated fibroblasts”的研究论文,该研究表明Alarmin S100A8通过重编程癌相关成纤维细胞影响食管癌的化疗耐药。该研究利用来自食管鳞状细胞癌的患者来源的异种移植物(PDXs)来研究临床前环境下的化疗耐药机制。观察到活化的癌症相关成纤维细胞(CAFs)在耐化疗PDXs的肿瘤微环境中富集。
在机制上,癌细胞来源的S100A8通过与CAF的CD147受体结合,诱导CAF极化并导致化疗耐药,从而触发细胞内RhoA-ROCK-MLC2-MRTF-A途径。在治疗上,阻断S100A8-CD147通路可以提高化疗效率。在预后方面,外周血中的S100A8水平可以作为化疗反应性的指标。总之,该研究全面了解了食管癌化疗耐药的分子机制,并强调了S100A8在食管癌临床治疗中的潜在价值。

食管鳞状细胞癌(ESCC)是消化系统中一种突出的致命性恶性肿瘤,其5年生存率仅为20%。以氟尿嘧啶(5-FU)/顺铂(CDDP)为基础的化疗是局部ESCC的标准治疗方法。然而,目前的治疗标准对ESCC患者的缓解作用有限。大多数患者最终因原发或获得性多药耐药而复发,而化疗耐药的潜在机制尚不完全清楚,这一事实加剧了这种情况。
难治性肿瘤微环境(TME)是临床上阻碍肿瘤有效治疗的关键问题之一。越来越多的进展表明,TME在驱动癌症异质性和治疗耐药性方面的重要性。在TME内,各种非恶性细胞与恶性细胞共存,主要包括癌相关成纤维细胞(CAFs)、内皮细胞、肿瘤浸润淋巴细胞和骨髓细胞。在所有类型的基质细胞中,CAFs是丰富且异质性的成分,支持多种关键的促癌功能。例如,CAFs具有重塑细胞外基质(ECM)的能力,产生阻碍药物传递和阻碍免疫细胞浸润的物理屏障。由于CAFs在肿瘤发展中发挥的肿瘤支持功能,因此对CAFs的调控在增强抗癌功效方面具有诱人的前景。然而,直接清除CAFs可能会促进癌细胞的扩散和侵袭,导致生存率下降。此外,针对CAFs的临床试验进展有限因此,必须开发创新策略,在不破坏肿瘤-基质结构的情况下将促肿瘤细胞重编程为静止状态,这将以安全有效的方式提高治疗效果。
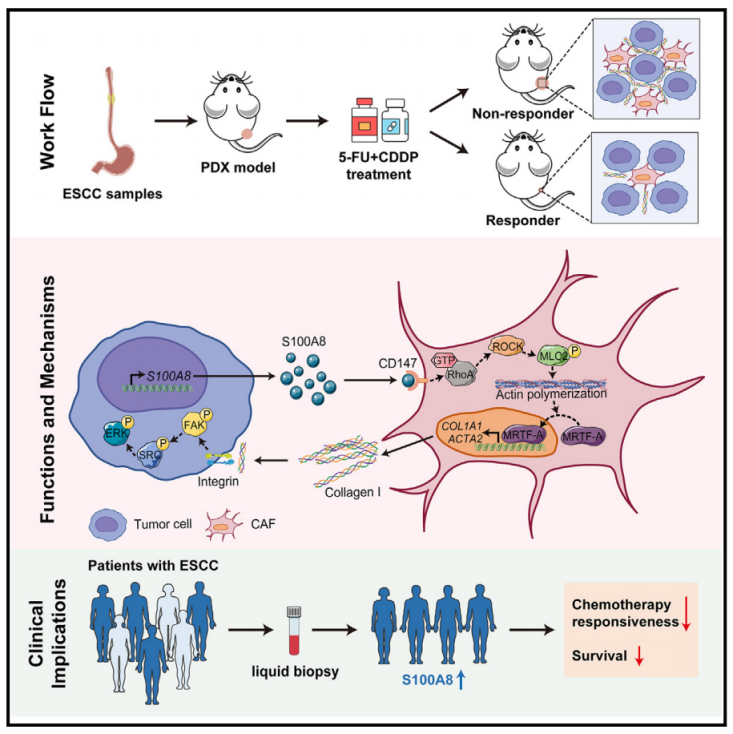
机理模式图(图源自Cell Reports Medicine )
设计针对CAFs的有效方法依赖于了解它们与癌细胞的相互作用。越来越多的证据表明,癌细胞与CAFs之间的共生相互作用在肿瘤发生中起着至关重要的作用。之前的研究表明,癌细胞分泌的CXCL1激活肌成纤维细胞CAFs (myCAFs),引发胶原沉积和ECM重塑。沉积的胶原支持ESCC细胞在电离辐射暴露后的存活,最终导致辐射抗性。此外,CAFs通常呈免疫抑制表型,从而促进ESCC的免疫逃避和肿瘤进展。这些发现扩大了人们对癌细胞-基质细胞相互作用如何促进癌症发展的理解,并提出了一些针对CAFs改善ESCC患者预后的策略。
利用保留癌细胞与基质细胞相互作用完整特征的临床前动物模型,对于研究CAF极化对ESCC治疗耐药的影响至关重要。患者源性异种移植(PDX)模型为理解ESCC的发病机制提供了一个复杂的平台。由于供体肿瘤和已建立的肿瘤异种移植物之间具有高度的组织学和病理学相关性,PDX可以模拟临床环境的遗传和组成多样性。
该研究利用成熟的PDX模型全面研究了ESCC化学耐药的机制。在无反应的PDX的TME中证实了myCAFs的富集,myCAFs是肿瘤相关ECM的主要来源。重要的是,癌细胞来源的警报蛋白S100A8触发myCAF积累并赋予化学耐药。人类ESCC样本的分析与PDX研究结果一致。该研究结果强调了警报蛋白S100A8作为一个有希望的靶点来规避ESCC化疗耐药,并作为预测化疗反应性的有价值的标记物。
原文链接:
https://doi.org/10.1016/j.xcrm.2024.101576

