【协和医学杂志】术前新型冠状病毒感染患者慢性术后疼痛发生率及其危险因素分析:一项双向队列研究
时间:2024-05-28 22:01:59 热度:37.1℃ 作者:网络
自2019年新型冠状病毒感染(COVID-19)疫情暴发以来,全球累计感染者已超7亿,严重影响了人类的身体健康和生命安全。除发热、咳嗽、胸闷等急性期症状外,部分感染者可于急性感染期后出现持续性症状,并影响全身多个器官,称为长新冠综合征[1-2],此类COVID-19相关症状具有严重程度不一、临床表现多样的特征,其中疼痛严重影响了患者的身体康复和生活质量[3-5]。越来越多的证据表明COVID-19可独立导致患者产生持续性疼痛,据估计其粗发生率为63.3%[4]。COVID-19相关疼痛的产生机制可能与病毒感染所致的器官损伤、持续性炎症、免疫抑制状态有关[6]。此外,有研究者发现严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)可影响血管紧张素转化酶2/肾素-血管紧张素系统(ACE2/RAS)通路活性从而改变患者的痛觉感知,并可促进脊髓后角神经元和小胶质细胞ACE2受体表达继而增强疼痛传导[7]。
慢性术后疼痛(CPSP)是一种特殊类型的疼痛,是造成手术患者术后功能恢复不良的重要原因,理论上术前SARS-CoV-2感染可增加CPSP发生风险,并对患者术后康复产生长期不良影响,但目前尚未见相关临床研究报道。本研究首次在术前COVID-19患者中探究CPSP发生现况,并进一步分析CPSP的危险因素,以期为优化围术期疼痛管理策略提供参考依据。
1 对象与方法
1.1 研究对象
本研究为双向队列研究,研究对象来源于一项已完成随访的前瞻性队列研究[8],样本大小基于原始队列可用数据。回顾性纳入2022年12月1日至2023年2月28日北京协和医院术前合并COVID-19且接受手术治疗的患者。
纳入标准:
(1)行外科手术治疗,麻醉方式为全身麻醉、椎管内麻醉和神经阻滞麻醉;
(2)术前依据鼻咽拭子核酸/抗原检测及临床表现,诊断为COVID-19。
排除标准:
(1)日间手术或门诊手术患者;
(2)行监护下麻醉管理手术;
(3)术后6个月随访时失访。
本研究已通过北京协和医院伦理审查委员会审批(审批号:IRB K3570),知情同意书豁免,并于美国临床试验注册平台(ClinicalTrials.gov)注册(注册号:NCT05677815)。
1.2 研究方法
1.2.1 研究流程
患者一般资料和临床数据提取自原始研究数据库。所有原始研究中的患者于术后6个月时由接受培训的专业人员通过电话进行随访,前瞻性收集患者术后疼痛相关信息。
1.2.2 COVID-19相关暴露因素定义
本研究主要探索COVID-19急性期相关暴露因素与CPSP的相关性。根据呼吸困难状况、有/无重症危险因素、肺炎严重程度和进展速度,将急性期COVID-19严重程度分为轻症、重症和危重症[9]。
长新冠综合征定义为患者于术后6个月随访时报告至少1项可归因于SARS-CoV-2感染的症状,包括:(1)注意力和/或记忆力受损;(2)淋巴结疼痛;(3)肌肉酸痛;(4)关节痛;(5)头痛;(6)精力减退;(7)体位性低血压;(8)疲劳。
1.2.3 混杂因素
基于已发表研究[10-11]及临床专业知识,本研究筛选的术后疼痛相关混杂因素包括:年龄、性别、体质量指数(BMI)、吸烟、合并症(高血压、糖尿病、冠心病、慢性肾功能不全、哮喘、慢性阻塞性肺疾病)、美国麻醉医师协会(ASA)体能分级、手术种类、手术时间、是/否急诊手术、麻醉方法、麻醉持续时间。
1.2.4 主要结局指标
本研究主要结局指标为CPSP发生情况,其定义为术后6个月时存在手术部位或手术相关区域疼痛。其中数字评定量表(NRS)≥4分为存在CPSP[3]。
1.3 检验效能估算
本研究拟纳入4117例行手术治疗的患者。假设双侧检验,检验水准α为0.05,分类暴露因素的暴露率为20%,在研究结局CPSP发生率为5.59%的情况下,此样本量可提供80%的统计学把握度以探测小于0.57或大于1.53的比值比(OR)。如潜在影响因素的暴露率更高,则能发现的暴露因素与结局指标的关联性将减弱。如分析指标为连续变量,假设该危险因素符合标准正态分布,此样本量可提供80%的把握度以探测小于0.82或大于1.21的OR值。
1.4 统计学处理
采用R 4.1.0软件进行数据整理和统计学分析。年龄、BMI、手术时间等正态分布计量资料以均数±标准差表示,组间比较采用t检验;性别、合并症、ASA体能分级等计数资料以频数(百分比)表示,组间比较采用卡方检验。以COVID-19相关因素为暴露指标,CPSP为结局指标建立多因素Logistic回归模型,分析二者的相关性。回归分析时,COVID-19病情按有序多分类变量纳入模型,长新冠综合征按照有/无,以二分类变量的形式纳入模型。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
本研究采用的原始研究手术队列数据库共包含4959例患者,其中725例于术后6个月随访时因未接电话或拒绝接受随访而被剔除,随访应答率为85.4%(4234/4959)。另有117例行监护下麻醉管理手术而被剔除,最终纳入4117例行全身麻醉、椎管内麻醉的患者。其平均年龄为(46.7±15.2)岁,男性占比28.0%(1152/4117)。主要结局指标CPSP发生率为5.59%(95% CI:4.88%~6.28%),患者临床资料见表1。
表1 4117例患者临床资料比较
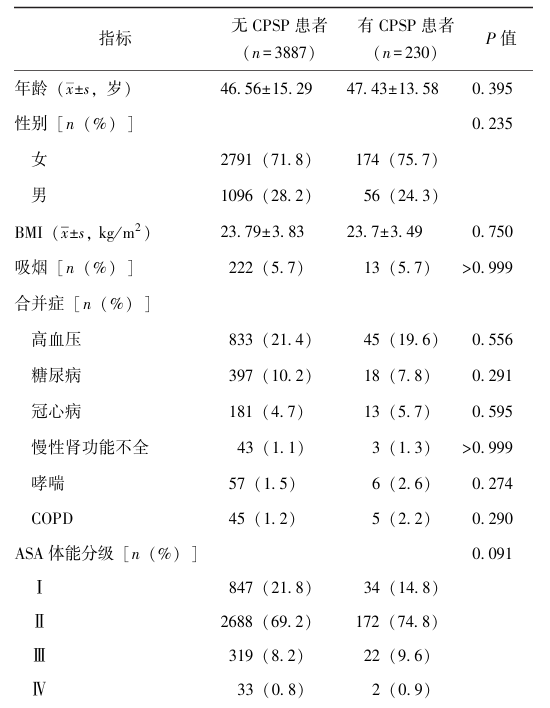
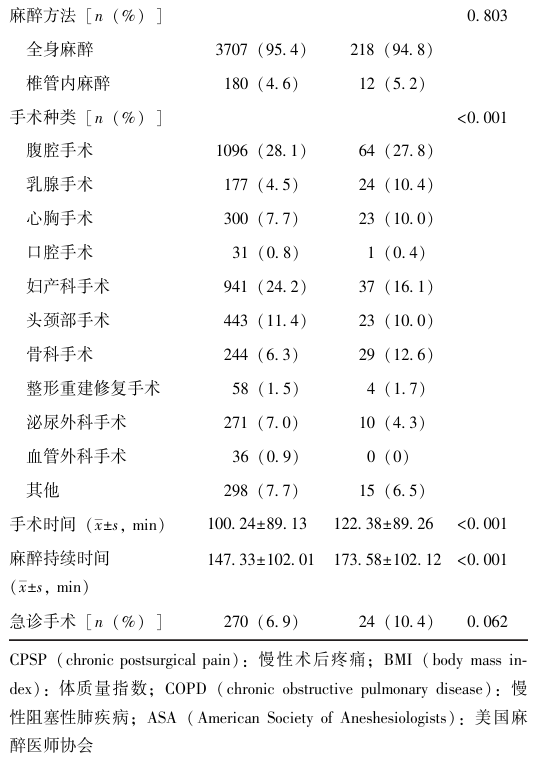
2.2 COVID-19相关暴露因素与CPSP的相关性
4117例患者中,急性期COVID-19严重程度为轻症4002例,重症62例,危重症53例。急性期COVID-19症状发生率由高至低依次为发热(89.0%)、咳嗽(59.8%)、咽痛(37.3%)、疲劳(35.0%)、肌肉酸痛(34.3%)、消化道症状(6.4%)、呼吸困难(6.2%)、嗅觉味觉丧失(3.6%)、头痛(2.9%)、心悸(0.4%)。术后6个月时有长新冠综合征1296例(31.53%)。其中按发生率由高至低依次为记忆力受损(18.5%)、精力减退(7.8%)、关节痛(6.8%)、体位性低血压(4.7%)、头痛(4.5%)、淋巴结疼痛(2.1%)、疲劳(1.7%)、肌肉酸痛(0.4%)。COVID-19相关暴露因素在有CPSP者与无CPSP者患者中的分布情况见表2。
表2 有/无CPSP患者COVID-19相关暴露因素分布情况[n(%)]
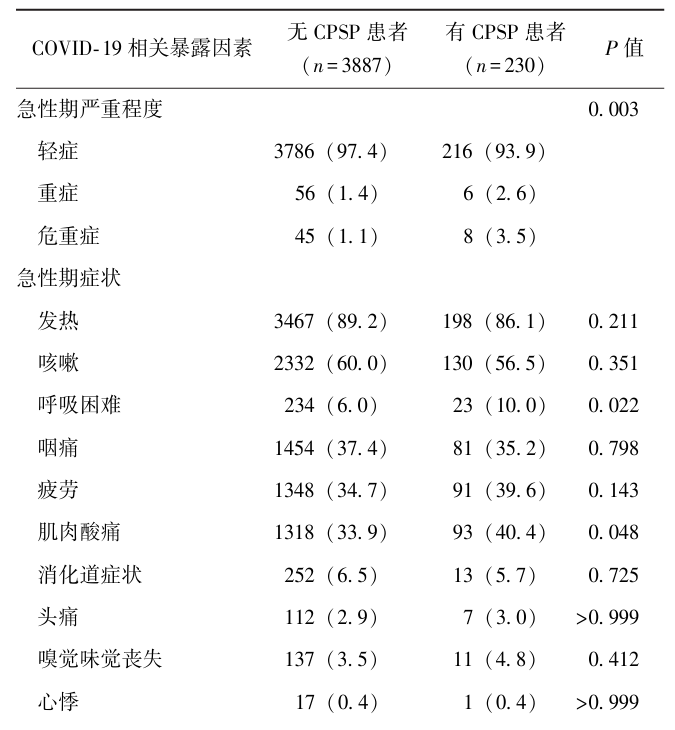
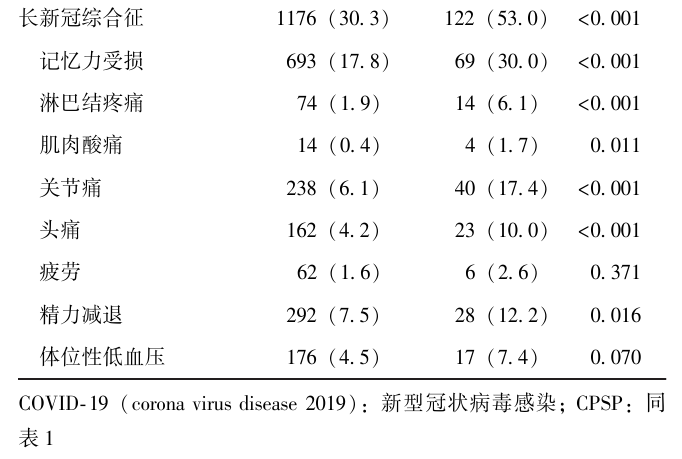
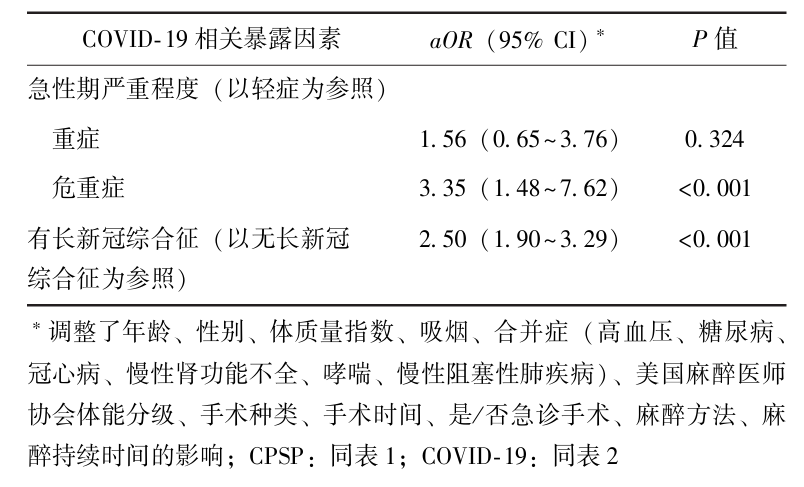
多因素Logistic回归校正年龄、性别、合并症、ASA体能分级、麻醉方法、手术种类等混杂因素后发现,急性期危重症COVID-19(aOR=3.35, 95% CI: 1.48~7.62, P<0.01)、有术后长新冠综合征(aOR=2.50, 95% CI:1.90~3.29, P<0.001)与CPSP相关,见表3。
表3 CPSP发生风险的多因素Logistic回归分析结果
3 讨论
CPSP可影响患者身体机能康复,而COVID-19是持续性疼痛的重要促进因素,本研究基于一项已完成随访的队列研究,首次探究了COVID-19相关暴露因素对行手术治疗患者CPSP的影响,结果显示校正年龄、性别、合并症等混杂因素后,急性期危重症COVID-19(aOR=3.35, 95% CI: 1.48~7.62, P<0.001)、有术后长新冠综合征(aOR=2.50, 95% CI:1.90~3.29, P<0.001)与CPSP相关。
COVID-19疫情波及范围广,影响着数十亿人群的生命安全和心理健康,给全球公共卫生系统造成了巨大挑战。2023年5月5日,世界卫生组织宣告COVID-19不再构成国际关注的突发公共卫生事件,预示着COVID-19疫情全球大流行的结束。
在后疫情时代,COVID-19对人类的影响并未停止,长新冠综合征日渐引起人们的关注。大量研究表明,COVID-19患者在相关临床表现消失后,影像学改变和生化检查异常可长期持续[12];新发慢性疼痛在COVID-19康复人群中广泛存在[3-4],此种疼痛产生机制可能与病毒感染本身存在关联性,抑或与感染引发的其他疾病对器官或组织造成的特定损害相关。研究提示,COVID-19急性期有头痛症状者后续发生神经病理性疼痛的风险升高4.9倍[4];在非手术人群中,约1/6的COVID-19患者发生COVID-19相关疼痛[4]。
基于2021年全国健康访谈数据的横断面调查研究显示,急性期感染症状更严重的COVID-19患者疼痛相关长新冠症状发生率更高,提示COVID-19病情与慢性疼痛具有一定相关性[13]。既往报道显示,CPSP在截肢术、剖宫产术、胆囊切除术、疝气修补术、子宫切除术、乳腺切除术、髋关节置换术、开胸术等大手术人群中的发生率为3%~85%[14-15]。本研究4117例术前感染SARS-CoV-2患者中,CPSP发生率为5.59%(95% CI:4.88%~6.28%),考虑到本研究纳入对象手术种类较广泛,故CPSP发生率基本符合既往报道。
探寻CPSP的危险因素,有助于优化围术期管理策略,提高镇痛效果。本研究多因素Logistic回归分析校正ASA体能分级、麻醉方法、手术种类等可能影响慢性疼痛发生风险的混杂因素后发现,术前危重症COVID-19是CPSP的独立危险因素,提示术前COVID-19急性期感染症状更严重者CPSP的风险更高[16-17]。其机制可能与COVID-19潜在改变了急性疼痛向慢性疼痛转化的进程相关。目前有证据提示,SARS-CoV-2可直接攻击多种组织类型,包括神经、脊髓和大脑,并导致相关脑病及结构变化[18-19]。有研究者认为,SARS-CoV-2可通过ACE2 受体介导的相关途径直接进入肌肉骨骼和神经细胞,通过引发相应区域炎症反应继而诱导疼痛产生[20-21]。
此外,SARS-CoV-2感染后疼痛个体存在神经性疼痛的特征[22],进一步提示该病毒可影响围术期切口疼痛由急性疼痛向慢性疼痛的转化。因此,COVID-19急性期症状较重者可能诱发更强烈的炎症反应,同时对疼痛转化进程的干扰更加显著,故而发生CPSP的风险增高。
长新冠综合征是SARS-CoV-2对机体产生长期影响的重要表现,目前有观点认为多种长新冠综合征与肌痛性脑脊髓炎/慢性疲劳综合征的表现相似,推测COVID-19可导致机体线粒体功能障碍[21]、氧化应激和抗氧化剂减少[23]。荟萃分析显示,感染Omicron毒株的COVID-19患者出现长新冠综合征的比例相对较低,仅为Delta毒株感染者的24%~50%[24-25]。文献报道,急性感染期症状较重(尤其是需转入ICU治疗)、基础合并症多、高龄、女性、经济社会地位低等可能为长新冠综合征的危险因素[26-28]。
我国疾病预防与控制中心发布的疫情数据提示,该研究期间人群SARS-CoV-2感染毒株亚型主要为Omicron[29],故推测本队列主要由Omicron感染者组成。患者多数为轻症,随访显示术后6个月存在长新冠综合征的比例为31.53%,与既往文献报道的长新冠综合征发生率基本相符[30]。目前长新冠综合征与CPSP的相关性尚未阐明。
本研究发现,疼痛类、非疼痛类长新冠综合征发生率在有/无CPSP患者中的分布存在差异,提示长新冠综合征可能与CPSP具有一定相关性;多因素Logistic回归分析校正混杂因素的影响后发现,二者的相关性仍存在,有长新冠综合征者发生CPSP的风险增高,提示应加强具有长新冠综合征人群的术后随访,以助力早期识别并管理CPSP。
CPSP是一个受多方面因素影响的复杂过程[31],包括个体易感性、心理因素、手术创伤及术后急性疼痛水平等,而COVID-19除可导致器质性改变外,亦可引起心理障碍[30,32],一方面提示COVID-19可通过多种途径影响CPSP,另一方面COVID-19患者可表现为不同形式/程度的长新冠综合征,体现了病毒与不同个体基因免疫状态相互作用的结果。
此外,越来越多的研究者认为慢性疼痛为长新冠综合征的一部分,因此长新冠综合征与CPSP的因果关系尚需进一步论证。
本研究基于一项队列研究的随访数据,首次在手术患者中探究了COVID-19相关暴露因素与CPSP的相关性,研究中纳入了多种类型手术患者,人群代表性较好,结果可信度高。本研究亦存在诸多不足:(1)焦虑、抑郁及围术期急性疼痛等相关基线资料缺失;(2)未涵盖患者术后服用药物等信息;(3)CPSP为患者自行评估,可能存在一定主观性。
综上,急性期危重症COVID-19患者及术后存在长新冠综合征者发生CPSP的风险增高,提示重症SARS-CoV-2感染可能对CPSP的发生产生一定影响,其机制可能与SARS-CoV-2参与CPSP形成机制的调控相关。鉴于COVID-19具有较高的重复感染率,明确COVID-19暴露因素与CPSP的相关性可辅助临床医生更好地判断患者CPSP发生风险,并予以个体化监测与干预。
参考文献
[1]COVID-19 rapid guideline: managing the long-term effects of COVID-19[M]. London: National Institute for Health and Care Excellence (NICE), 2020.
[2]Soriano J B, Murthy S, Marshall J C, et al. A clinical case definition of post-COVID-19 condition by a Delphi consensus[J]. Lancet Infect Dis, 2022, 22(4): e102-e107.
[3]Soares F H C, Kubota G T, Fernandes A M, et al. Prevalence and characteristics of new-onset pain in COVID-19 survivours, a controlled study[J]. Eur J Pain, 2021, 25(6): 1342-1354.
[4]Zis P, Ioannou C, Artemiadis A, et al. Prevalence and determinants of chronic pain post-COVID; cross-pal study[J]. J Clin Med, 2022, 11(19): 5569.
[5]Kemp H I, Corner E, Colvin L A. Chronic pain after COVID-19: implications for rehabilitation[J]. Br J Anaesth, 2020, 125(4): 436-440.
[6]Oronsky B, Larson C, Hammond T C, et al. A review of persistent post-COVID syndrome (PPCS)[J]. Clin Rev Allergy Immunol, 2023, 64(1): 66-74.
[7]Su S, Cui H, Wang T, et al. Pain: a potential new label of COVID-19[J]. Brain Behav Immun, 2020, 87: 159-160.
[8]Che L, Yu J W, Bai X, et al. Association between post-COVID-19 status and perioperative morbidity and mortality: protocol for an ambispective cohort study[J]. BMJ Open, 2023, 13(9): e074337.
[9]北京协和医院新型冠状病毒感染诊疗多学科专家组. 北京协和医院成人新型冠状病毒感染实用诊疗建议 (2023)[J]. 协和医学杂志, 2023, 14(1): 50-59.
[10]Schug S A, Bruce J. Risk stratification for the development of chronic postsurgical pain[J]. Pain Rep, 2017, 2(6): e627.
[11]Fletcher D, Stamer U M, Pogatzki-Zahn E, et al. Chronic postsurgical pain in Europe: an observational study[J]. Eur J Anaesthesiol, 2015, 32(10): 725-734.
[12]Mandal S, Barnett J, Brill S E, et al. ‘Long-COVID’: a cross-pal study of persisting symptoms, biomarker and imaging abnormalities following hospitalisation for COVID-19[J]. Thorax, 2021, 76(4): 396-398.
[13]Romeiser J L, Morley C P, Singh S M. COVID-19 symptom load as a risk factor for chronic pain: a national cross-pal study[J]. PLoS One, 2023, 18(6): e0287554.
[14]Van Driel M E C, Van Dijk J F M, Baart S J, et al. Development and validation of a multivariable prediction model for early prediction of chronic postsurgical pain in adults: a prospective cohort study[J]. Br J Anaesth, 2022, 129(3): 407-415.
[15]Richebé P, Capdevila X, Rivat C. Persistent postsurgical pain: pathophysiology and preventative pharmacologic considerations[J]. Anesthesiology, 2018, 129(3): 590-607.
[16]Monje M, Iwasaki A. The neurobiology of long COVID[J]. Neuron, 2022, 110(21): 3484-3496.
[17]Koc H C, Xiao J, Liu W W, et al. Long COVID and its Management[J]. Int J Biol Sci, 2022, 18(12): 4768-4780.
[18]Helms J, Kremer S, Merdji H, et al. Neurologic features in severe SARS-CoV-2 infection[J]. N Engl J Med, 2020, 382(23): 2268-2270.
[19]Iadecola C, Anrather J, Kamel H. Effects of COVID-19 on the nervous system[J]. Cell, 2020, 183(1): 16-27.e1.
[20]Fernández-De-Las-Peñas C, Navarro-Santana M, Plaza-Manzano G, et al. Time course prevalence of post-COVID pain symptoms of musculoskeletal origin in patients who had survived severe acute respiratory syndrome coronavirus 2 infection: a systematic review and meta-analysis[J]. Pain, 2022, 163(7): 1220-1231.
[21]Jackson C B, Farzan M, Chen B, et al. Mechanisms of SARS-CoV-2 entry into cells[J]. Nat Rev Mol Cell Biol, 2022, 23(1): 3-20.
[22]Fernández-De-Las-Peñas C, Nijs J, Neblett R, et al. Phenotyping post-COVID pain as a nociceptive, neuropathic, or nociplastic pain condition[J]. Biomedicines, 2022, 10(10): 2562.
[23]Pierce J D, Shen Q H, Cintron S A, et al. Post-COVID-19 syndrome[J]. Nurs Res, 2022, 71(2): 164-174.
[24]王晴, 钱捷, 黄蔷如, 等. 新型冠状病毒再感染的流行病学特征概述[J]. 中华医学杂志, 2023, 103(12): 934-938.
[25]孙泽宇, 柴佳彤, 许建成. 新冠病毒变异株 “奥密克戎” 的研究进展[J]. 病毒学报, 2023, 39(2): 517-527.
[26]Raman B, Bluemke D A, Lüscher T F, et al. Long COVID: post-acute sequelae of COVID-19 with a cardiovascular focus[J]. Eur Heart J, 2022, 43(11): 1157-1172.
[27]Thompson E J, Williams D M, Walker A J, et al. Long COVID burden and risk factors in 10 UK longitudinal studies and electronic health records[J]. Nat Commun, 2022, 13(1): 3528.
[28]Sudre C H, Murray B, Varsavsky T, et al. Attributes and predictors of long COVID[J]. Nat Med, 2021, 27(4): 626-631.
[29]Du Z W, Wang Y C, Bai Y, et al. Estimate of COVID-19 deaths, China, December 2022-February 2023[J]. Emerg Infect Dis, 2023, 29(10): 2121-2124.
[30]Cai J P, Lin K, Zhang H C, et al. A one-year follow-up study of systematic impact of long COVID symptoms among patients post SARS-CoV-2 omicron variants infection in Shanghai, China[J]. Emerg Microbes Infect, 2023, 12(2): 2220578.
[31]申乐, 黄宇光. 术后疼痛管理的发展与变革[J]. 中国科学: 生命科学, 2021, 51(8): 957-962.
[32]Al-Aly Z, Xie Y, Bowe B. High-dimensional characteriza-tion of post-acute sequelae of COVID-19[J]. Nature, 2021, 594(7862): 259-264.


