哈医大AFM:工程化掺杂策略实现自给自足的活性氧产生以增强肿瘤的铁死亡/铜死亡敏感性
时间:2024-06-17 12:00:32 热度:37.1℃ 作者:网络
铁死亡和铜死亡是程序性细胞死亡的新兴模式,并已越来越多地用于消除肿瘤细胞。然而,由于固有的抗氧化剂和质膜修复系统以及低效的铜离子输送,将铁死亡/铜死亡转化为有效的治疗依然具有挑战性。
在本研究中,哈尔滨医科大学Rui Xie、杭州医学院Shaoshan Hu、哈尔滨工程大学杨飘萍教授和丁鹤副教授等人开发了一种工程掺杂方法,用Cu2+掺杂的ZIF-8包裹ZnO2,并用转铁蛋白(Tf)修饰表面。由此而得的ZnO2@Cu/ZIF-8-Tf纳米系统中,Tf可特异性结合转铁蛋白受体(TFRC)进行靶向和聚集。在肿瘤微环境中,Cu2+/Fe3+从纳米系统中释放出来,并与谷胱甘肽(GSH)反应产生Cu+/Fe2+。Cu+的过量积累干扰了三羧酸循环,并诱导铜死亡的发生。此外,额外的Fe2+导致铁过载并增强铁死亡现象。ZnO2则可以提供过氧化氢以介导活性氧(ROS)的过量产生。此外,GSH的耗竭使谷胱甘肽过氧化物酶4(GPX4)失活并抑制系统Xc−-GSH-GPX4途径,而ROS的扩增触发了脂质过氧化和脂质代谢的重新编程,导致抗氧化和膜修复系统出现故障。相关工作以“Engineered-Doping Strategy for Self-Sufficient Reactive Oxygen Species Blossom to Amplify Ferroptosis/Cuproptosis Sensibilization in Hepatocellular Carcinoma Treatment”为题发表在Advanced Functional Materials。

【文章要点】
为了将级联增强的铁死亡和铜死亡结合治疗肝细胞癌(HCC),作者精心设计了名为ZnO2@Cu/ZIF-8-Tf的纳米系统,合成路线如图1所示。作者首先制备了具有单分散球形结构的聚乙烯吡咯烷酮包覆ZnO2纳米粒子。由于吡咯烷酮环(C=O)与ZIF-8的金属离子(Zn2+)之间的弱相互作用以及PVP与有机配体(2-甲基咪唑)之间的非极性相互作用,ZnO2成功地被封装在ZIF-8内,并通过ZIF-8骨架中的离子交换同时掺杂芬顿型离子(Cu2+)。随后,作者再使用holo-Tf对ZnO2@Cu/ZIF-8纳米结构进行表面修饰形成ZnO2@Cu/ZIF-8-Tf。由于存在相反电荷,ZnO2@Cu/ZIF-8-Tf的Tf可相互吸引引入Fe3+,并赋予纳米系统优越的靶向HCC细胞的能力。TFRC在肿瘤细胞膜表面的高表达介导了ZnO2@Cu/ZIF-8-Tf的内吞作用,使该纳米系统能够在HCC细胞中积累。
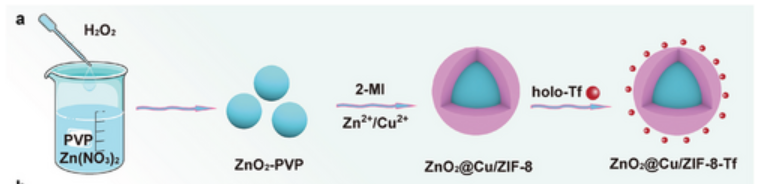
图1 ZnO2@Cu/ZIF-8-Tf
ZnO2@Cu/ZIF-8-Tf纳米系统在TME中发挥多种作用(图2):i)holo-Tf(Fe3+)在酸性条件下进行变构活性,释放Fe3+,通过STEAP3将其还原为Fe2+。细胞中Fe2+含量的增加导致铁过载并增强铁死亡。ii)在弱酸性TME中,ZnO2@Cu/ZIF-8开始降解,释放出Cu2+并暴露出核心ZnO2纳米球。Cu2+的引入导致细胞内Cu2+的积累,过量的Cu2+离子被转移到线粒体,在那里它们被FDX1还原为Cu+。Cu+直接与二氢硫代酰胺S-乙酰转移酶(DLAT)结合,诱导其低聚并干扰Fe-S簇蛋白,从而引发铜死亡。iii)肿瘤细胞中丰富的GSH也可以将Cu2+还原为Cu+,Cu+和Fe2+与H2O2一起反应产生大量•OH,放大内源性ROS的产生。iv)核心ZnO2纳米球在富含H+的TME中也可过度产生H2O2以补充消耗的H2O2。因此,内源性ROS被持续扩增。(v) 随着GSH的耗竭,抗氧化系统被破坏,处于氧化应激下的肿瘤细胞对ROS更敏感。此外,随着谷胱甘肽的耗竭,谷胱甘肽过氧化物酶4(GPX4)的活性受到抑制。LPO产物不能及时清除,积累的LPO产物使系统Xc−-GSH-GPX4信号通路失活,并重新编程脂质代谢。最终,铁死亡在多个水平上被激活,并诱导强烈的铁死亡增强作用,以实现HCC中铁死亡/铜死亡协同抗癌活性。
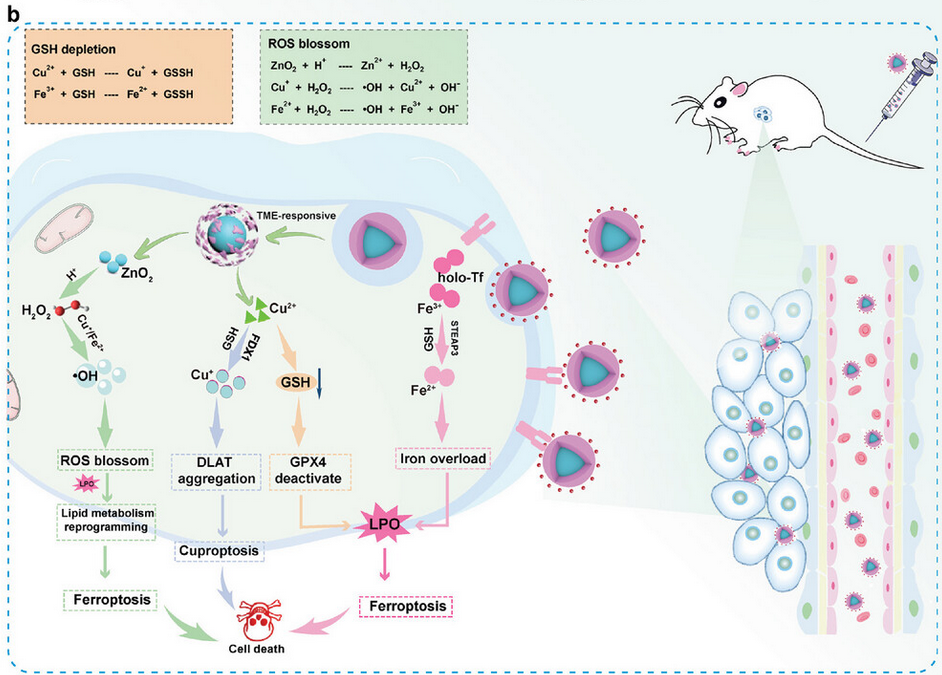
图2 抗肿瘤治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202405383


