彭智教授:2024ASCO胃癌免疫研究新进展
时间:2024-07-14 19:00:19 热度:37.1℃ 作者:网络
编者按:2024年6月11日,第14届CGOG大会成功开幕,在会议上,北京大学肿瘤医院彭智教授分享了2024ASCO胃癌免疫研究的最新进展,为我们提供了一个全面而深入的视角,让我们对胃癌免疫治疗的现状和未来发展趋势有了更加清晰的认识。
胃癌围手术期免疫治疗进展
KEYNOTE-858
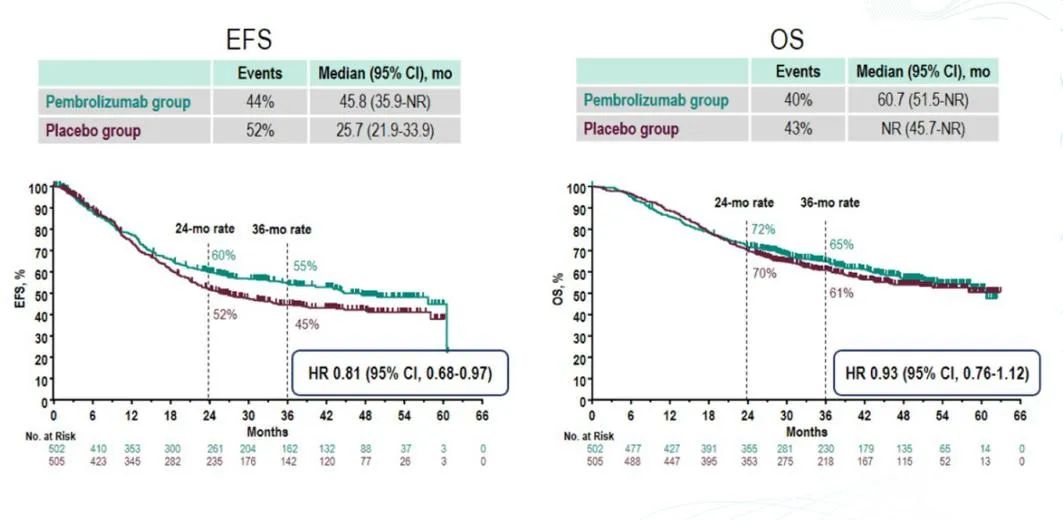
在胃癌的新辅助治疗中,免疫治疗扮演的角色和疗效一直是研究和临床实践中的热点话题。尽管已有一些Ⅱ期研究提供了初步见解,但对585研究的深入分析有助于我们更好地理解免疫治疗的潜在价值。
邓婷教授之前提到的一个关键观点是,如果患者通过化疗达到了病理完全缓解(PCR),其复发概率非常低。化疗联合免疫治疗的效果也与PCR的达成密切相关。如果未能达到PCR,患者的生存预后较差,无论是否加入免疫治疗。
进一步分析显示,化疗联合免疫治疗在MPR方面可能略优于单纯化疗,这可能为生存获益提供了一线希望。然而,即使MPR率的提高带来了一些差异,OS方面的差异并未显著增加。一个可能的解释是,即使在没有达到MPR的患者中,单纯化疗组的长期生存可能更好。这提示我们,免疫治疗在胃癌治疗中最有效的患者群体可能与其他肿瘤类型不同。高度微卫星不稳定性(MSI-H)的患者本身就有良好的预后,即使不使用任何治疗,复发率也只有20%。因此,尽管免疫治疗可能将PCR和MPR的比例提高,但这部分患者本身预后就很好,可能不需要达到PCR也能获得良好的生存结果,这可能是OS差异较小的原因之一。
在胃癌中,PD-L1表达水平较高的患者也有一个有趣的现象,其预后同样良好,这在CLASSIC研究中也得到了体现。因此,尽管免疫治疗可能增加了一部分患者的PCR和MPR,但由于这些患者本身预后就很好,远期生存的差异可能较小。
总体而言,免疫治疗在胃癌新辅助治疗中的作用仍需进一步研究。虽然近期疗效有所提高,但长期生存获益的比例相对较低。此外,选择受益于免疫治疗的患者群体也是一个挑战,因为免疫治疗效果好的一部分患者类型,如MSI-H或EB病毒感染,或PD-L1高表达的患者,其复发率本身就很低。未来的研究可能会提供更多关于OS的见解,帮助我们更好地理解免疫治疗在胃癌新辅助治疗中的地位,并指导临床实践。
晚期胃癌一线免疫治疗进展
RCTS研究

这项方案结合了RC48、PD-1抑制剂以及口服药物S-1,作为一线治疗HER2阳性晚期胃癌的探索性Ⅱ期临床研究。从近期疗效来看,我们观察到客观缓解率(ORR)有显著提升。因为随访时间还不够长,尽管生存数据尚未成熟,但已有迹象表明这种联合疗法的潜力。
在以往的研究中,我们已经发表了关于RC48联合PD-1抑制剂单抗在二线及更后线治疗中的积极疗效。基于这些发现,我们现在正在一线治疗中开展安全性准入试验,其中包括化疗联合替雷丽珠单抗和RC48的方案。
胃癌末线免疫治疗进展
LM-108与抗PD-1抗体联合用于胃癌患者的疗效和安全性:Ⅰ期/Ⅱ期研究结果
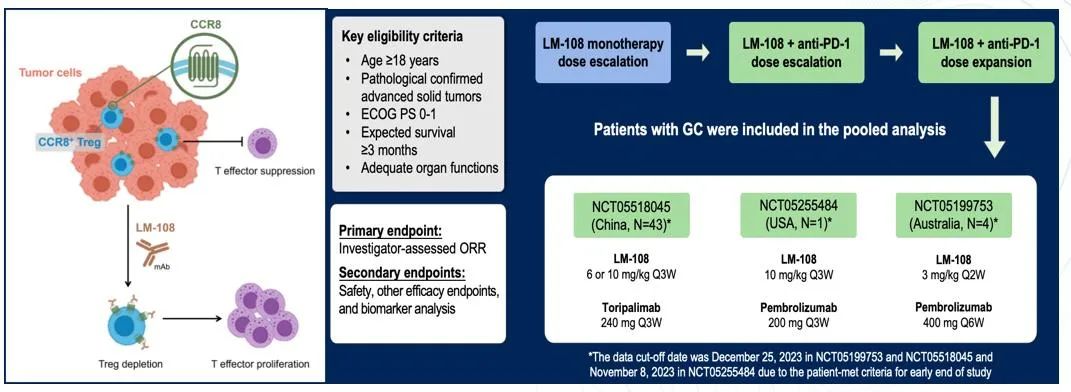
LM-108是一种新型Fc优化的抗CCR8单克隆抗体,能够有选择性地耗竭肿瘤中的调节性T细胞(Tregs)。研究已初步验证了LM-108与抗PD-1抗体(如Pembrolizumab或Nivolumab)联合使用的疗效,展现了这一组合作为新型免疫治疗方案在胃癌患者中的潜力。
在这项研究中,我们观察到化疗加免疫治疗的胃癌患者,其客观缓解率(ORR)达到了36.1%,疾病控制率(DCR)高达72.2%。尽管样本量较小,但与目前标准的二线治疗方案相比,ORR率相对更高。
在二线治疗中,ORR率甚至更高,达到了63.6%。这一发现表明,在一线治疗中使用化疗加免疫治疗后,我们需要考虑如何选择更有效的二线药物。目前,紫杉醇联合雷莫西尤单抗是标准的二线治疗,但考虑到一线治疗的进展,我们需要重新评估二线治疗的策略。
从生存随访数据来看,中位PFS为6.5个月,6个月的PFS率为53%,6个月的持续缓解率(DOR)为87.5%。这些数据为我们提供了关于该治疗方案疗效的初步见解。
在治疗相关的不良事件(TRAE)方面,观察到的主要是与免疫治疗相关的3-4级不良事件,这些不良事件可控,且符合我们对免疫治疗安全性的预期。
Ⅰb/Ⅱ期AK109-201研究
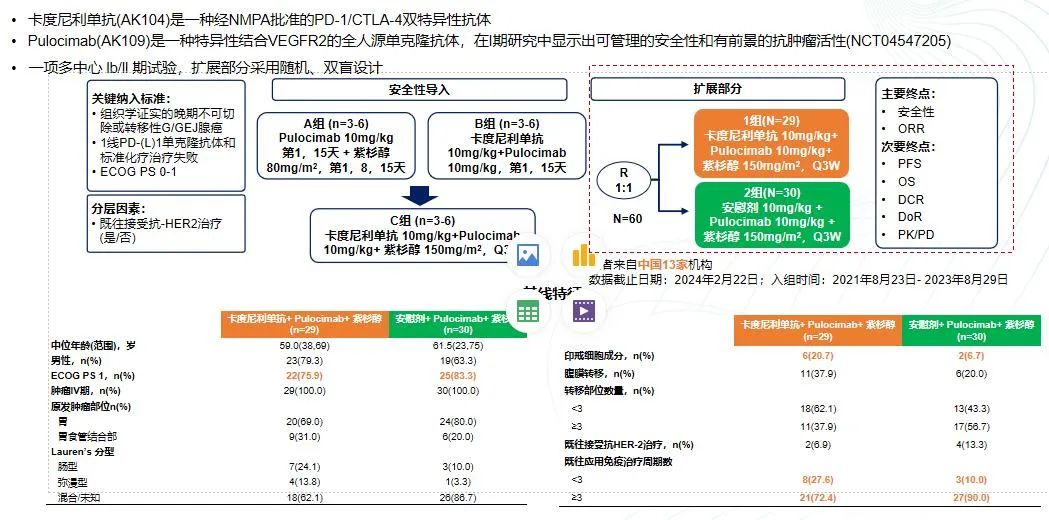
这是一项评估卡度尼利单抗(AK104)联合Pulocimab(AK109)和紫杉醇作为二线治疗方案,针对免疫化疗失败的晚期胃或胃食管结合部腺癌的Ib/II期随机双盲研究。研究共纳入59例患者。
主要终点分析显示,紫杉醇结合抗血管生成单克隆抗体Pulocimab和AK104的治疗方案取得了48%的客观缓解率(ORR)和96%的疾病控制率(DCR),中位无进展生存期(PFS)达到6.8个月。与对照组(紫杉醇加抗VEGFR2单克隆抗体)相比,显示出更好的疗效。
在安全性方面,该治疗方案并未出现特别难以控制的不良事件。基于这项研究的积极结果,目前已启动III期临床研究。
此外,II期研究中还包括了生物标志物的探索。在III期研究中,将继续评估Pulocimab联合AK104和紫杉醇的疗效,并与现有治疗方案进行对比。目前,III期研究的患者入组工作已经开始。
胃癌免疫治疗生物标志物探索
超灵敏ctDNA动力学预测pembrolizumab 治疗的胃食管癌的治疗反应
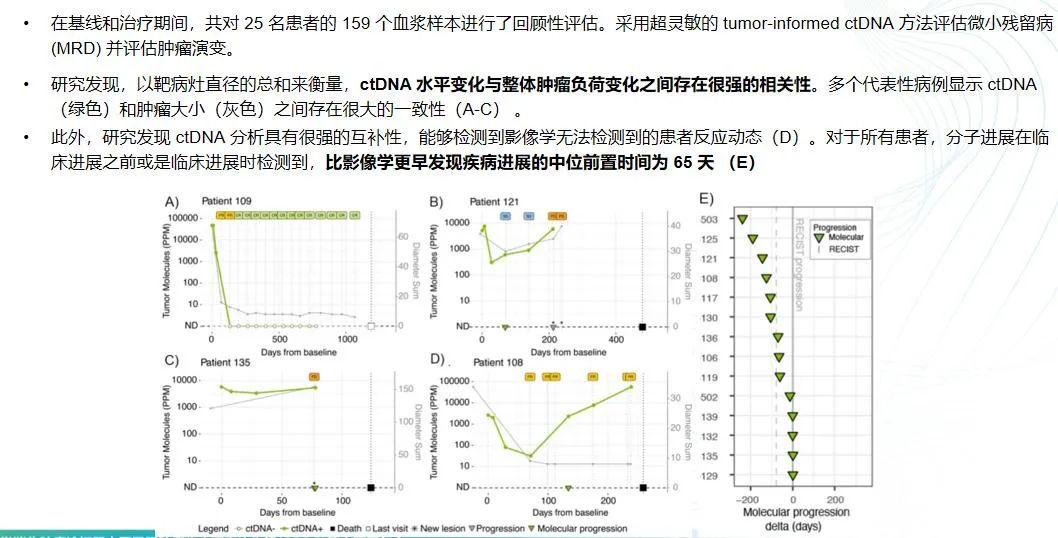
在胃癌治疗领域,除了传统的影像学和肿瘤标志物检测,ctDNA作为一种新兴的生物标志物,其在胃癌治疗中的应用逐渐受到关注。ctDNA的变化与免疫治疗的相关性正在被越来越多的研究所证实。通过动态监测ctDNA,我们可以更精准地反映治疗效果。
使用基于人工智能的数字病理学预测免疫检查点抑制剂治疗在晚期胃食管癌中的结果
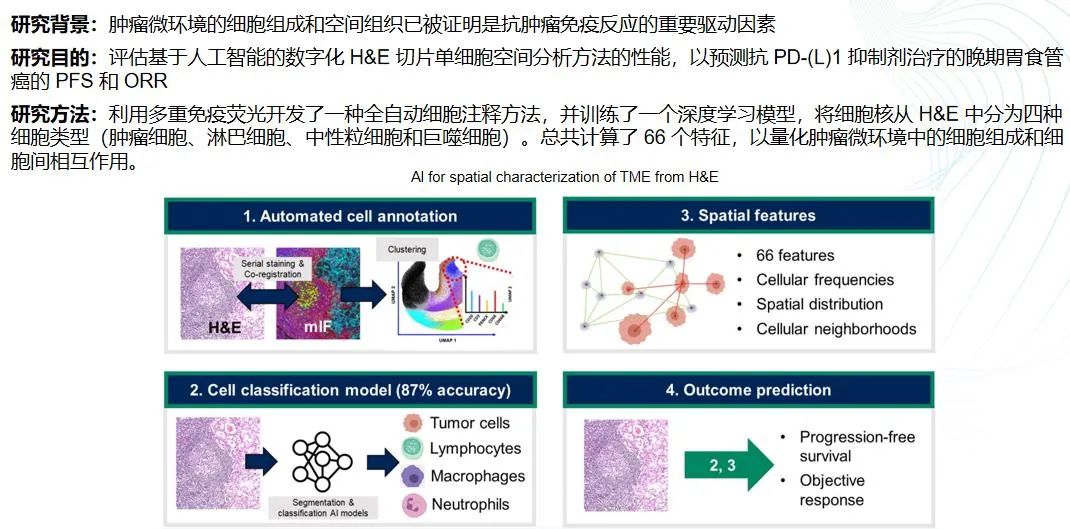
AI技术也在肿瘤治疗中展现出巨大潜力。AI在肺癌研究中的应用,提示了AI在药物研发和影像评估中的重要性。AI辅助的数字病理学,通过分析肿瘤组织的切片,能够揭示肿瘤微环境中的不同标志物,这对于预测免疫治疗的疗效至关重要。
目前,虽然AI在临床实践中的应用还有一段距离,但它为我们提供了深入了解每个肿瘤微环境特点的机会。例如,通过使用多重免疫荧光技术和全自动细胞分析方法,结合机器学习建立模型,我们可以预测哪些患者能从免疫治疗中获益。这将是未来发展的重要方向。
总结
在胃癌的新辅助治疗中,疗效的提升,如病理完全缓解(PCR)和主要病理缓解(MPR),已经开始显现。然而,从大型研究如KEYNOTE 585研究中观察到的长期获益仍然需要更多数据来验证。目前,我们还在等待几项大型Ⅲ期研究的结果,这些结果将指导我们未来的临床实践是否会发生变化。
对于一线治疗,化疗联合免疫疗法已成为标准治疗方案。但我们也看到了在一线治疗中加入其他药物,如抗血管生成药物、针对CLDN 18.2的药物以及抗VEGFR2单克隆抗体的潜力,这些都有可能在未来进一步提升患者的长期获益或生存率。
在后线治疗中,我们一直在探索,在一线治疗中使用了化疗加免疫疗法后,后续应如何继续使用免疫治疗?目前,我们至少看到了一线希望,有部分患者能够从新的治疗方法中获益,例如针对CCR8的单克隆抗体和针对CTLA-4的双特异性抗体。这些治疗方法的大型Ⅲ期研究目前正在进行中。
虽然细胞免疫治疗目前在临床上的应用可能还相对遥远,但作为肿瘤医生,我们认为这将是未来的一个重要发展方向。在疗效评估方面,我们越来越多地结合使用AI技术和ctDNA检测等工具,以便在临床实践中更好地筛选那些最有可能从免疫治疗中获益的患者。


