Nature:父亲肠道微生物会影响后代健康?「eG学术观察」
时间:2024-07-15 20:01:56 热度:37.1℃ 作者:网络
导读
肠道微生物(包括细菌、真菌、病毒等微生物群落)在宿主与环境的相互作用中起着关键作用,影响着人体的稳态和代谢网络。然而,尽管肠道微生物对人体生理和疾病相关反应具有深远的影响,但肠道微生物对生殖细胞的影响及其在后代中的跨代传递(父母的某些特征通过遗传或非遗传方式影响子代)机制尚未得到充分研究。
近期欧洲分子生物学实验室(EMBL)Jamie A. Hackett教授课题组相关成果以“Paternal microbiome perturbations impact offspring fitness”为题在Nature发表文章,该研究提出了“肠-生殖轴”的新概念,探索了在雄性小鼠中父代肠道微生物如何影响子代健康,并主要揭示肠道微生物扰动如何通过父代传递影响子代的适应性,特别是低出生体重、严重生长受限和早产死亡率等表型,并探讨其潜在的分子机制。
“肠-生殖轴”艺术效果图
图源:Joana Carvalho/Isabel Romero Calvo/EMBL
这个概念的重要性在于它揭示了环境因素(如饮食、抗生素使用)可能通过改变肠道微生物组来影响生殖细胞,进而影响下一代。研究还发现这种影响是可逆的,恢复正常肠道微生物后,对后代的负面影响也随之消失。这为理解环境、微生物组和遗传之间的复杂关系提供了新的视角。值得注意的是,研究主要聚焦于肠道微生物失调对直接子代(F1代)的影响。虽然在孙代(F2代)中未发现明显的遗传变异,但对更远代际的潜在效应还需进一步探索。

小百科1:什么是“肠-生殖轴”?
“肠-生殖轴”(gut-germline axis)是本研究提出的新概念,描述了肠道微生物组与生殖细胞系统之间的直接联系。这个名称由两部分组成:
1. “肠”指的是肠道及其微生物群落(微生物组)。
2.“生殖”特指生殖细胞系统,包括产生精子的细胞。
研究发现,父代小鼠的肠道微生物组变化会影响其生殖细胞,特别是:改变睾丸的大小、代谢物组成和激素水平,尤其是导致瘦素(leptin)水平的显著降低;影响精子中的小RNA含量。
这些变化可能通过精子传递给后代,影响胚胎发育和子代健康。研究者使用"轴"这个词来强调肠道和生殖系统之间存在一个功能性的连接通路。
该研究采用SPF级雄性C57BL/6J小鼠作为父系模型,通过给予非吸收性抗生素(nABX)诱导肠道微生物失调。nABX处理组小鼠饮用含有新霉素、杆菌肽和匹马霉素的饮用水6周,随后撤除抗生素,观察肠道微生物恢复情况及子代表型变化。对照组小鼠饮用普通饮用水。随后,研究人员收集如下样本进行分析:
1. 收集父代及子代小鼠的粪便样本,用于16S rRNA测序分析肠道微生物结构;
2. 收集父代小鼠的睾丸、血浆及子代小鼠的胎盘、脑组织等样本,用于RNA测序、代谢组学、ELISA等分析;
3. 收集父代小鼠的精子样本,用于DNA甲基化测序、小RNA测序等分析。
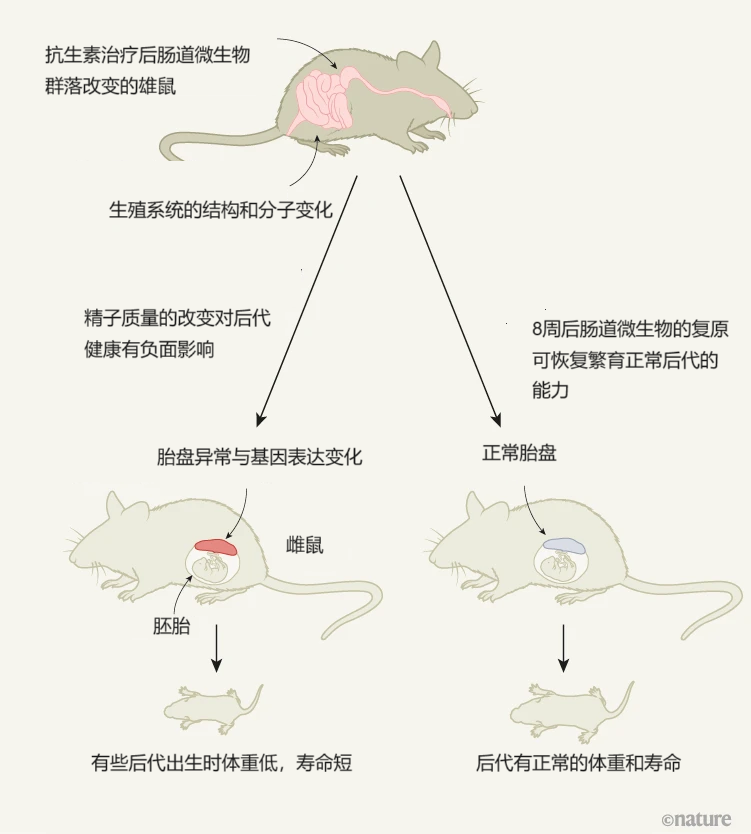
该图描述了雄性小鼠肠道微生物对后代健康的影响。Argaw-Denboba等人报告称,使用抗生素改变雄性小鼠肠道微生物群落的方式会影响健康精子的产生,从而对胚胎细胞发育成胎盘以及后代体重和寿命产生不利影响。这种现象背后的分子通路尚不完全清楚。肠道微生物恢复正常功能后,这种影响会逆转。
来源:Nature 629, 536-537 (2024)
肠道微生物失调对父代小鼠的影响
肠道微生物多样性显著减少:通过6周的非吸收性抗生素(nABX)处理,父代小鼠的肠道微生物多样性显著降低,表现为物种丰富度、丰度和多样性的下降。撤除抗生素后,这种减少逐渐恢复,8周后与对照组相当。
生殖系统功能受损:尽管nABX处理对父代小鼠的体重、生育力和生存率无显著影响,但睾丸重量显著减轻,精子计数下降,睾丸组织中出现异常小管,包括空泡形成和生殖细胞部分缺失,表明肠道微生物失调损害了父代小鼠的生殖系统功能。
激素水平变化:父代小鼠体内和睾丸中的瘦素(leptin)水平显著降低,这进一步支持了肠道微生物失调对生殖系统的内分泌调节产生了影响。
肠道微生物失调对子代小鼠的影响
低出生体重和生长受限:nABX处理父代小鼠的子代出生体重显著降低,且在整个生长过程中体重持续低于对照组,表现为低体重和严重生长受限(severe growth restriction,SGR)。撤除抗生素后恢复肠道微生物的父代小鼠的子代体重和生长轨迹恢复正常。
早产死亡率增加:nABX处理的父代小鼠的子代早产死亡率显著增加,特别是在SGR子代中。这种增加的死亡率与SGR表型高度相关,表明肠道微生物失调增加了子代的疾病易感性和死亡率。
代谢网络受影响:SGR子代脑组织转录组分析显示,差异表达基因主要富集在代谢途径和脂质代谢相关通路上,这表明肠道微生物失调通过重塑子代的代谢网络来影响其适应性。
肠道微生物失调的跨代传递机制
非遗传传递:通过共居实验排除了肠道微生物直接传递给子代的可能性。即使在共居期间,母代小鼠的肠道微生物组成没有发生显著变化,子代表型也不受先前暴露于nABX父代小鼠环境的影响。此外,通过体外受精(in vitro fertilization,IVF)实验进一步证实,肠道微生物失调通过父系生殖细胞而非母系环境传递影响子代表型。
精子介导的传递:nABX处理父代小鼠的精子DNA甲基化和小RNA载荷发生显著变化。特别是,精子中miR-141和miR-200a等小RNA的表达上调,这些变化可能通过精子传递给子代,影响胚胎发育和子代适应性。此外,精子中的tRNA片段(如tRF-Gly-GCC)也发生变化,这些小分子RNA在胚胎发育和跨代效应中扮演重要角色。
胎盘功能障碍介导的跨代效应
胎盘发育受损:nABX处理父代小鼠的子代胎盘出现功能障碍,表现为胎盘重量减轻、血管化异常和梗死增加。这些变化与胎盘发育相关基因的下调有关,特别是与类固醇代谢和糖酵解途径相关的基因。值得注意的是,研究发现这些胎盘表现出了类似人类先兆子痫(pre-eclampsia)的特征。
胎盘标记物表达变化:E18.5胎盘中转录组分析显示,多个与胎盘发育和胎儿生长相关的基因表达下调,同时上调了一些与胎盘功能不全和早产相关的标记物,如PlGF和sFLT-1/PlGF比值。
结构变化:免疫荧光染色显示,nABX处理父代小鼠的子代胎盘中迷宫区减少,血管化受损,梗死增加,这些结构变化进一步支持了胎盘功能障碍在跨代效应中的作用。
小百科2:什么是“先兆子痫”?
先兆子痫是一种严重的妊娠并发症,通常发生在孕20周后。其主要特征包括高血压和蛋白尿,可能还伴有水肿。严重时可危及孕妇和胎儿的生命。
在这项小鼠研究中,研究者观察到父代肠道微生物失调可能导致子代胎盘出现一些类似先兆子痫的特征:
1. 胎盘生长因子(PlGF)水平降低
2. 可溶性血管内皮生长因子受体-1(sFlt-1)与PlGF的比值升高
3. 负责母胎物质交换的胎盘迷宫区缩小
4. 胎盘血管化异常
这些变化与人类先兆子痫患者的某些表现相似。虽然这项研究是在小鼠模型中进行的,但它为我们理解胎盘发育异常与先兆子痫之间的潜在联系提供了新的视角。这一发现也突出了父亲健康状况可能对妊娠结局产生影响,这一观点值得在人类中进行进一步研究。
跨代效应的可逆性
肠道微生物恢复后子代表型正常:研究发现,停止nABX处理约8周后(约一个精子发生周期),父代小鼠的肠道微生物逐渐恢复。与此同时,其子代的表型也恢复正常。这一时间点与肠道微生物恢复相吻合,表明肠道微生物失调引起的跨代效应是可逆的,且与精子发生周期和肠道微生物恢复时间相关。这一发现暗示,通过适时调节肠道微生物可能有助于预防不良妊娠结局。
总结与展望
综上所述,本研究揭示了肠道微生物失调通过父系生殖细胞影响子代健康的新机制,提出了“肠-生殖轴”的概念,并阐明了肠道微生物失调通过影响精子中的表观遗传信息和分子载荷,编程子代适应性的具体路径。这项研究为理解环境因素、微生物组和生殖健康三者之间的复杂关系提供了新的视角,揭示了父代环境因素通过生殖细胞影响F1代(子代)的机制。
然而,值得注意的是,尽管这项研究在小鼠模型中揭示了父代肠道微生物与子代健康之间的重要联系,但这些发现能否直接应用于人类还需要进一步研究。正如研究的主要作者Jamie Hackett教授所强调,在将小鼠模型的结果转化到人类时,需要考虑两者之间的内在差异。未来的研究应进一步探索这些效应在不同物种中的普遍性,以及潜在的分子机制和干预策略。
此外,该研究主要聚焦于父代肠道微生物失调对子一代的影响。虽然在F2代(孙代)中未发现明显的表型差异,但对更远代际的潜在影响仍需进一步探索。同时,研究中使用的小鼠数量相对较少,结果的稳健性和重复性还需更多的实验数据支持。
尽管如此,这项研究仍为理解肠道微生物在生殖健康和跨代传递中的作用提供了宝贵的新视角。它启示我们,环境因素可能通过改变微生物组而影响生殖细胞,进而影响后代健康。这一发现不仅具有重要的科学意义,也为预防不良妊娠结局和改善人类健康提供了新的思路。未来的研究可进一步探索肠道微生物与其他环境因素的交互作用,以及潜在的干预措施,以其全面理解和优化生殖健康。
引证本文
Argaw-Denboba, A., Schmidt, T.S.B., Di Giacomo, M. et al. Paternal microbiome perturbations impact offspring fitness. Nature 629, 652–659 (2024).
https://doi.org/10.1038/s41586-024-07336-w


