特别关注|非酒精性脂肪性肝病多组学研究现状
时间:2024-07-22 06:00:29 热度:37.1℃ 作者:网络
非酒精性脂肪性肝病(NAFLD)是与肥胖和代谢综合征密切相关的代谢应激性肝病,疾病谱包括单纯性脂肪肝、非酒精性脂肪性肝炎(NASH)及其相关肝硬化和肝细胞癌(HCC)。单一组学数据仅能分析NAFLD与某种特征性生化指标之间的关联,但无法说明其中复杂的因果关系。随着基因组学、转录组学、表观组学、蛋白质组学及代谢组学等的不断发展,多组学大数据整合分析可以更深刻地解释NAFLD的致病机理及疾病的发生发展,为发现NAFLD潜在治疗靶点、个性化医疗提供理论依据。近年来,越来越多的组学技术应用于NAFLD的研究探索中(图1),本文主要综述与NAFLD相关的多组学研究进展,以期为NAFLD的预防和治疗提供更丰富的理论依据与新的策略。
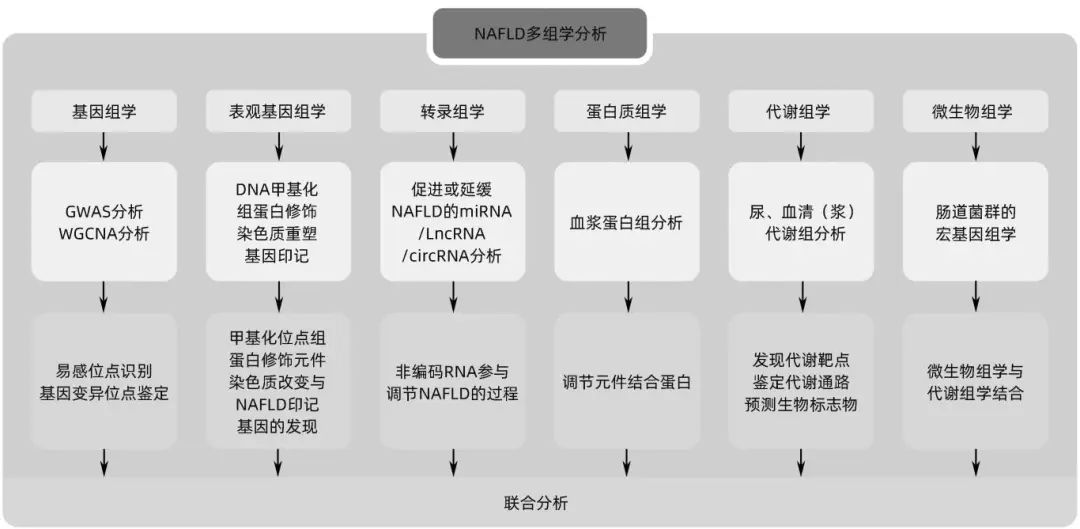
图1 NAFLD多组学研究
1NAFLD基因组学研究
基因组学研究是实现个体化医疗的基础和前提,对新药发现有直接推动作用。高通量测序和寡核苷酸阵列的出现实现了一系列全基因组关联分析(GWAS)和权重基因共表达网络分析(WGCNA)研究,这些研究突出了未知基因在NAFLD谱中的病理生物学作用,确定了NAFLD潜在易感位点,有利于对NAFLD潜在的致病、遗传原因的分析,能够进一步明确对NAFLD分子遗传基础的认识。
1.1 基于WGCNA的NAFLD基因组学研究
WGCNA是一种用于分析基因共表达网络的统计技术,被广泛应用于研究表型性状与基因关联分析中。Zeng等利用进行基因本体联合会数据库(GO)和京都基因和基因组数据库(KEGG)分析,检索出15个与NAFLD通路和氧化磷酸化有关的基因,其中泛醌氧化还原酶亚基A9(NDUFA9)和泛醌细胞色素C还原酶核心蛋白Ⅶ(UQCRQ)可能是NAFLD的诊断标志物。通过GEO数据集鉴定NAFLD的纤维化差异表达基因发现,核仁和纺锤体相关蛋白1(NUSAP1)可能是预防NAFLD进展为肝癌的潜在治疗靶点。Dai等从NAFLD和AMI数据集的差异表达基因及其之间的共同基因中,筛选出前10位的枢纽基因。筛选枢纽基因的临床应用集中于疾病预测、诊断、治疗及预后,是探索NAFLD潜在分子机制的重要内容,为NAFLD的机制研究提供更为精确的思路。
1.2 基于GWAS的NAFLD基因组学研究
在GWAS研究中,愈多证据表明基因位点与NAFLD存在关联性和易感性。Handelman等从甘油三酯、低密度脂蛋白和高密度脂蛋白GWAS中鉴定了58个富集通路发现胆汁酸受体抗体法尼脂X受体(NR1H4)基因变异对肝脂肪变性有一定的保护作用。Chen等对一项来自FinnGen Biobank的NAFLD GWAS数据进行孟德尔随机化研究,预测甘油三酯、IL-1β和IL-17与NAFLD发病风险增加呈正相关。基因对NAFLD易感性的发现提升了对NAFLD病因学的认识。Ghodsian等对4组健康人群进行GWAS分析,确定了5个NAFLD的潜在易感位点。此外,基于全基因组的分析还确定了与NAFLD遗传相关的候选基因,主要涉及脂滴组装、脂质重塑、脂蛋白堆积和分泌、线粒体氧化还原状态和新生脂肪生成等过程。近年来,GWAS研究成为基因组学的重点,通过对NAFLD相关基因组学分析,可获得一系列与NAFLD相关的基因以辅助临床病因诊断。
2NAFLD的表观基因组学研究
表观基因组学是研究表观遗传机制的全基因组变化,包括DNA甲基化、组蛋白修饰、染色质重塑、基因印记和非编码RNA表达。这些修饰通过调节基因的表达,影响细胞功能和特性,从而影响个体健康。表观基因组学在医学领域具有重要意义,可为早期诊断和治疗提供新的思路和方法,对NAFLD相关研究有重要的促进作用。
2.1 DNA甲基化
DNA甲基化即在DNA甲基化转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶5号碳位共价键结合一个甲基基团,能够在不改变DNA序列的前提下,改变遗传表现。大量研究表明,DNA甲基化与NAFLD密切相关。Nano等分析了循环白细胞中的DNA甲基化位点水平,发现溶质载体家族7成员11(SLC7A11)内含子区(cg06690548)的DNA甲基化与肝脂肪变性风险降低显著相关。通过比较NAFLD组和健康组的DNA甲基化,发现酰基辅酶A合成酶长链家族成员4(ACSL4)和脑型肉碱棕榈酰转移酶1C抗体(CPT1C)的低甲基化位点与NAFLD风险增加显著相关,其可能是NAFLD的潜在生物标志物。一项外周血DNA甲基化与肝脂肪积累相关的GWAS研究发现22个与肝脂肪有关的CpG,观察到LINC00649上特定CpG位点的低甲基化与NAFLD风险显著相关。因此,了解DNA甲基化与其他表观遗传修饰之间的复杂相互作用是非常重要的。此外,DNA甲基化修饰机制与肝星状细胞的激活有关,在慢性肝病发展成肝硬化过程中发挥重要作用。其可能成为NAFLD的治疗靶点和分子工具,有望在个性化医疗方面取得巨大进展。
2.2 组蛋白修饰
组蛋白修饰可通过改变染色质的结构和状态,影响基因表达,而调控组蛋白修饰可能改善NAFLD。Assante等对永生化人肝细胞(IHH细胞)行ChIP-seq和RNA-seq分析发现,组蛋白高乙酰化可增加DNA损伤,从而引发NAFLD癌变。此外,组蛋白乙酰转移酶的表观遗传调控参与NAFLD的进展。HepG2细胞相关实验发现,黑桑果实提取物对肝脏的保护作用可能与抑制组蛋白乙酰化有关。异常组蛋白甲基化也与NAFLD的发展相关,组蛋白去甲基化酶是一个新的转录因子——碳水化合物响应元件结合蛋白(ChREBP)的转录共激活因子,其可促进特定基因启动子的组蛋白H3第9位赖氨酸二甲基化(H3K9me2)去甲基化,保护肝脏免受氧化应激和纤维生成的影响。
2.3 染色质重塑
染色质重塑复合体可以利用三磷酸腺苷水解的能量,通过移动、滑动、破坏或重组核小体,改变染色质的包装状态,从而调节基因表达。由于肝细胞表观遗传状态和染色质可及性改变,肝脏转录组重编程是NAFLD的一个基本特征。对小鼠和人原代肝细胞进行转录调控因子(MRG15)功能检测发现MRG15可以节律性调控表观染色质重塑和脂质合成,促进NAFLD小鼠模型肝脂肪变性。采用Cre/loxP技术制备肝细胞特异性多发性内分泌腺瘤致病因子1(MEN1)基因敲除小鼠,分析衰老和高脂饲料喂养小鼠的脂糖代谢表型与机制,可见肝细胞特异性MEN1缺失可诱导衰老小鼠肝脂肪变性,异常的雄激素受体信号可能破坏MEN1-沉默信息调节因子1(Sirt1)的相互作用,从而促进NAFLD的进展。
2.4 基因印记
基因印记是某些基因呈亲源依赖性的单等位基因表达,其另一等位基因不表达或表达极弱,仿佛这些基因的不同亲本来源的一对等位基因上带有某种可供识别的印记。基因印记允许基因以一种特定的方式表达,其变化可能影响肝脏代谢。通过生物化学和分子方法评估小鼠基因表达水平可发现,印记基因介导可发育性CdCl2暴露小鼠的NAFLD。利用IGN分析可发现,印记基因结合TGF-β1和Ⅵ型胶原α2启动子,在印记基因和NAFLD的病理生理机制之间形成直接途径。通过芯片分析和实时荧光定量PCR技术鉴定小鼠血清可发现,14q32.2母体印迹区域的一个miRNA簇是NAFLD候选miRNA的潜在靶点。
3NAFLD相关转录基因组学
转录组学可对所(非)编码RNA转录物定量评估并反映细胞转录活性。研究发现,核受体亚家族2F组成员6(NR2F6)通过转录激活CD36基因表达,促进脂肪酸摄取,诱导甘油三酯滞留,是肝脏甘油三酯稳态的重要调节因子,其上调可促进NAFLD的发生,这为肝脂肪变性提供了新的分子学基础。全球肝脏RNA谱已鉴定出535种长链非编码RNA(lncRNA)和760种mRNA在NAFLD中过表达。NAFLD转录组学将遗传信息与脂肪变性、炎症性和纤维化性蛋白质组谱连接起来,提供了疾病的病理和生理学见解,有助于更全面地了解与NAFLD相关基因的调控机制以及多种生物过程的运作方式。为了进一步验证转录基因组学的临床价值,可以考虑纳入肝组织和血液中lncRNA和环状RNA(circRNA)表达的队列研究。
3.1 促进NAFLD发展的非编码RNA
3.1.1 miRNA
miRNA是一类转录后水平调控基因表达、在多种生物过程中发挥重要作用的内源性非编码RNA。miRNA结合位点包含在封闭的环状核苷链上,与蛋白形成环状RNA-miR-mRNA轴或网络,与内源性RNA海绵状机制竞争,发挥抑制或促进相关靶基因表达的作用,参与NAFLD的进展。在肝脏学领域,血浆miRNA作为肝脏疾病诊断和监测的一种新工具,维持肝脏甘油三酯稳态并参与NAFLD的发病过程。例如miR-122上调,Sirt1下调,抑制AMP依赖的蛋白激酶[AMPK]通路则促进脂肪生成。通过下一代RNA测序分析Ⅲ级肥胖患者肝活检miRNA表达水平,可见miR-301a-3p和miR-34a-5p升高,miR-375降低,促进NAFLD进展为肝细胞癌。采用实时荧光定量PCR分析NAFLD患者miRNA水平发现,miR212-5p下调则促进脂质积累。血清miR-379通过干扰靶基因的表达,包括与胰岛素样生长因子1信号通路相关的基因,增加胆固醇脂毒性。在NAFLD患者和小鼠模型中,循环miR-21水平及其在肝脏中的表达水平升高。miRNA作为潜在治疗靶点,将为NAFLD的临床治疗提供新的思路和手段。
3.1.2 lncRNA
lncRNA是一类不被翻译成蛋白质且长度超过200个核苷酸的转录RNA分子,通过控制转录过程来调节蛋白质编码基因。lncRNA是一种新兴调控因子,可能成为NAFLD诊断和治疗靶点。小鼠和原代肝细胞的遗传研究发现,lncRHL激活lncRHL/异质核核糖核蛋白U(hnRNPU)/脑和肌肉芳烃受体核转位蛋白1(BMAL1)/微粒体甘油三酯转移蛋白(MTTP)轴,揭示肝内血浆脂质稳态的新分子机制。lncRNA与hnRNPU结合后转录激活BMAL1进而抑制肝细胞内极低密度脂蛋白的分泌。lncRNA NEAT1通过调节c-Jun氨基末端激酶(JNK)/胆固醇调节元件结合蛋白1c(SREBP-1c)轴,加重游离脂肪酸(FFA)诱导的肝细胞脂质积累,在肾癌细胞中被舒尼替尼耐药性激活的lncRNA(IncARSR)水平在NAFLD患者的血清和肝脏中增加。lncRNA(MRAK 052686)与抗氧化因子——核因子E2相关因子2强相关,其下调可促进脂肪变性。上述证据表明,NAFLD的发生发展可能与lncRNA的异常表达有关。
3.1.3 circRNA
circRNA是一种与脂质代谢相关的非编码RNA,在5'端和3'端与线性非编码RNA相似但又不同,可能是一个治疗肝脏疾病的新靶点和开发途径。Li等采用实时定量PCR检测高脂饮食组小鼠和对照组小鼠的circRNA硬脂酰辅酶A去饱和酶1(circSCD1)水平,发现circSCD1的异常表达影响肝脂肪变性程度,并通过Janus激酶2/信号传导和转录激活因子5信号通路促进NAFLD的发生。生物信息建模研究发现,circRNA的基因组规模失调与肝脂肪变性有关。通过检测NAFLD小鼠和体外细胞的相关蛋白水平发现,circ_0057558可通过靶向miR-206调节Rho相关蛋白激酶1/AMPK信号传导促进NAFLD。因此,circRNA的失调与NAFLD密切相关。
3.2 延缓NAFLD发展的非编码RNA
3.2.1 miRNA
miR-21可能通过干扰脂肪酸摄取,改善肝脂肪变性。miR-33缺乏使肝新生脂肪酸合成增强,抑制miR-33可增加脂肪酸合成相关基因的表达,如乙酰辅酶A羧化酶(ACC)和脂肪酸合酶,持续抑制可能会导致中度肝脂肪变性和高甘油三酯血症。越来越多的证据表明,miRNA不仅在生理条件下维持肝脏甘油三酯稳态,还参与了NAFLD的发病机制。
3.2.2 lncRNA
通过建立NAFLD体内外模型及基因测序分析发现,脂肪肝相关lncRNA 2(FLRL2)过表达能够改善NAFLD的脂肪变性、生成、炎症和内质网应激。在高脂饮食诱导的小鼠模型中,lncRNA HCV调节蛋白1(lncHR 1)的过表达通过抑制SREBP-1c基因表达抑制脂肪酸合成酶,并降低油酸诱导的肝细胞甘油三酯和脂滴蓄积。lncRNA NR_002155.1的过表达被证实在体外抑制肝星状细胞增殖,在NAFLD进展中发挥抑制作用。在未来的研究中,探索lncRNA是否可以与其他生物分子结合,将加深lncRNA介导细胞稳态的理解。
3.2.3 circRNA
通过miRNA响应元件识别circRNA对miR-34a的影响,并通过双荧光素酶检测验证发现,上调circRNA_0046366可消除miR-34a依赖的对过氧化物酶体增殖物激活受体α(PPARα)的抑制,进而改善NAFLD的氧化应激、脂肪毒性和疾病严重程度。过表达circRNA_0001805可释放甘草酸,减少肝内脂质积累。下调circRNA_002581可显著降低NASH小鼠和细胞模型的脂滴积累。由此可见,circRNA通过参与肝脏中脂肪酸β氧化、脂质合成、胰岛素抵抗、星状细胞活化等发挥对NAFLD的调控作用,在单细胞水平上颇具潜力,有望成为治疗NAFLD的新治疗靶点。
4NAFLD的蛋白质组学研究
蛋白质组学可从多角度、多层面和蛋白质整体水平动态探索NAFLD的发病机制并发掘候选标志物。NAFLD动物模型研究发现,组蛋白脱乙酰酶6可加速叉头转录因子O1介导的自噬和脂肪生成,导致肝脂肪变性;肝脏高尔基体蛋白73上调可促进NAFLD的发展。Li等通过蛋白-蛋白互作网络分析发现,NAFLD患者中的水通道蛋白9、CD4和IL-17受体E表达明显降低,而BTB结构域和CNC同源物2和S100钙结合蛋白A9表达升高。血浆蛋白质组分析可以识别肝脏疾病的潜在生物标志物和药物靶点。多聚免疫球蛋白受体蛋白在血浆中的水平与NAFLD治疗靶点二肽基肽酶-4高度相关。通过蛋白质组学检测不同小鼠脂肪变性模型中的蛋白变化,发现一个与脂质代谢相关的差异变化蛋白——自噬相关蛋白3(ATG3)。ATG3在动物模型和NAFLD患者的肝脏高表达,可调控脂质代谢和线粒体活性,是一种与脂肪变性发生发展有关的新蛋白。SREBP是控制肝脏胆固醇和脂肪酸合成的主要转录因子。SREBP-1介导低密度脂蛋白代谢的最终调控步骤;SREBP-1a激活脂肪和胆固醇生成;SREBP-1c控制肝脂肪酸合成;SREBP-2是胆固醇合成和代谢的主要调节因子。因此,基于质谱的蛋白质组学技术在探索新的疾病机制和发现新的生物标志物方面同样具有巨大潜力。
5NAFLD的代谢组学研究
5.1 代谢组学在NAFLD中的应用
代谢组学是一种分析各种生物样品中内源性低分子量代谢物并监测多种代谢途径的整体方法。NAFLD是肝脏代谢紊乱的表现,代谢组学的应用具有重要价值。饱和鞘磷脂种类与非肥胖NAFLD的内脏脂肪显著相关,NAFLD伴随糖异生、乳酸生成和三羧酸循环增强,补充乙酸、丙酸可减少肝脂肪堆积和炎症,并抑制胆固醇合成,其机制与通过AMPK-ACC途径增加肝脂质氧化,降低肿瘤坏死因子表达和肝脂肪酸合成酶活性有关。血液样本研究表明,受试者血清S-腺苷高半胱氨酸、同型半胱氨酸和血浆蛋白C水平可能与NAFLD患病率呈正相关。血浆二十烷酸类是NAFLD患者肝纤维化的生物标志物,为NAFLD的及时发现与干预治疗提供了新策略。脂肪变性所特有的微生物代谢物随着脂肪变性的进展而升高。除了血液代谢分析外,探索NAFLD疾病分期与尿代谢组学之间的相关性和中间代谢物有助于发现新参数,确定NAFLD各阶段的代谢差异有助于NAFLD的有效性和特异性治疗发展(表1)。代谢组学数据和临床信息的整合有助于发现NAFLD个体分子特征,从而识别NAFLD风险患者,表型特异性代谢组学生物标志物的鉴定有望为NAFLD领域的个性化医疗做出重要贡献。

5.2 NAFLD的代谢靶点
随着代谢组学的不断发展,越来越多的NAFLD代谢靶点被发现(表2)。Sirt16使ACSL5去乙酰化,促进脂肪酸氧化,进而防止NAFLD发展。CD36是NAFLD的重要脂质代谢靶点。线粒体丙酮酸载体和法尼酯X受体激动剂可以改善NAFLD。

6NAFLD的微生物组学研究
肠-肝轴模式已在NAFLD的研究中逐步获得广泛认可,肠道菌群已成为探讨NAFLD的研究热点。NAFLD的发展往往伴随着肠道菌群调节,例如拟杆菌门减少、厚壁菌门和变形菌门增加均可促进NAFLD的发展。肠道微生物群靶向治疗NAFLD的临床疗效仍需通过大规模、有序的随机对照试验研究证实。将基因组尺度代谢模型应用于来自粪便样本的宏基因组学数据,可以预测在特定疾病或生理条件下产生哪些代谢物,这些预测可以通过粪便和血清代谢组学验证。因此,联合肠道菌群和代谢组学技术可以更全面地开展NAFLD机制探究。添加不同层次的组学数据可能会提高NAFLD-NASH生物标志物的敏感性和特异性。以微生物组为中心的精密疗法(工程菌、后生物技术和噬菌体)可能成为NAFLD的个体化治疗途径。
7小结与展望
目前,欧洲和美国肝病学会仅推荐维生素E和PPAR-γ配体(吡格列酮)用于NAFLD的治疗。近两年取得重要进展的胰高血糖素样肽-1受体激动剂、法尼酯X受体激动剂、甲状腺激素受体-β激动剂和PPAR配体可能在不久的将来成为NAFLD的治疗药物。然而,上述药物均存在一定的用药安全隐患、毒副作用明显、适用人群局限等弊端。基于此现状,启示研究者在发掘NAFLD代谢靶点的同时,需要更加注重靶点治疗存在的毒副作用,使研发药物更加安全有效。高通量测序技术是对传统测序的一次革命性改变,开启了多组学的新时代,可以描绘和记录基因组输出的不同层面。对正常小鼠和NAFLD小鼠肝脏进行高通量染色体构象捕获,可以揭示基因重组之间的互动关系、空间组织破坏以及基因调控,确定候选基因与NAFLD发病机制的相关性。建立基因敲除动物模型,联合蛋白质印迹测定、染色质免疫沉淀以及高通量测序技术,将使NAFLD相关研究更加深入。基于精准医学和个性化治疗理念,从不同组学角度出发寻找潜在的生物标志物和治疗靶点,从而制订个性化治疗方案。“多管齐下”的组学分析技术也可以为开发评估和诊断NAFLD的非侵入性工具提供重要思路和研究基础。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240626


