Nature:科学家找到结直肠癌肝转移的“帮凶”「eG学术观察」
时间:2024-08-11 06:00:42 热度:37.1℃ 作者:网络
导读
癌症转移是导致患者死亡的主要原因,但目前仍缺乏有效的预防和治疗方法。苏黎世联邦理工学院Andreas Moor教授团队近期在Nature期刊发表了题为“In vivo interaction screening reveals liver-derived constraints to metastasis”的论著,研究揭示了结直肠癌细胞如何在肝脏中定植,为开发抑制癌症转移的新疗法提供了重要线索。
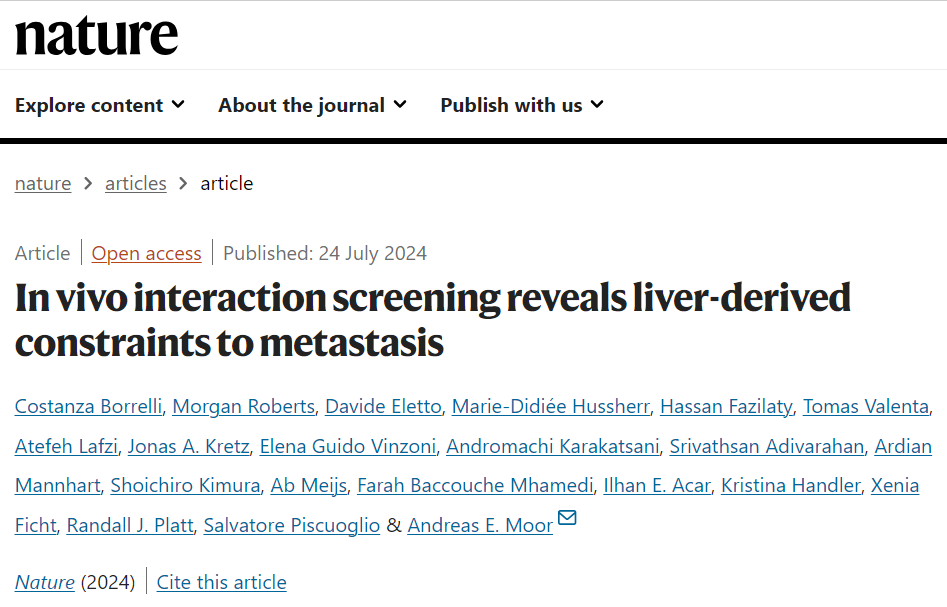
Moor教授团队的研究发现,肝细胞表面的Plexin B2蛋白与癌细胞表面的semaphorin蛋白相互作用,是癌细胞能够在肝脏中定植的关键。这种相互作用触发了KLF4转录因子的上调,促进癌细胞获得上皮特征,有利于它们在新环境中存活和生长。这一机制不仅适用于结直肠癌,还适用于黑色素瘤和胰腺癌。
图注:肿瘤细胞肝转移机制(a. CRISPR基因编辑技术构建“镶嵌肝”"模型研究播散性肿瘤细胞的定植微环境。sLP-mCherry荧光蛋白标记技术识别促进或抑制肝转移的肝细胞因子。b.肝细胞表面plexin B2蛋白是促进转移的关键因子。它与癌细胞表面的IV类semaphorin蛋白相互作用,激活细胞内RAC1信号通路,同时提高KLF4水平并降低ZEB1水平,使癌细胞获得上皮特征,增强其在肝脏中增殖和形成转移灶能力。)
图源:Nature 632, 262-264 (2024)
Moor教授表示:“如果能成功抑制Plexin B2和semaphorin之间的相互作用,我们可能就能阻止癌症在肝脏中形成新的肿瘤。这一发现强调了来自肝脏微环境的信号对癌细胞早期定植的重要性,为我们理解和潜在干预癌症转移提供了新的视角。”
结直肠癌为何易转移至肝脏
在研究发表后的采访中,Moor教授解释了结直肠癌易转移到肝脏的原因:“结直肠癌之所以容易转移到肝脏,与我们的血液流动方式有关。血液首先在肠道中富集营养,然后流向肝脏进行代谢。对结直肠癌细胞来说,肝脏常常是它们通过血液循环扩散后的停留之处。”
研究团队发现,肝脏细胞在决定癌细胞是否能在新位置定植方面起着重要作用。第一作者Costanza Borrelli博士解释道:“虽然科学界长期以来就知道,癌细胞就像植物种子在土壤中一样依赖于其环境,但具体涉及哪些分子机制一直未知。我们的研究首次揭示了这一关键机制。”
图注:肿瘤转移“种子与土壤”假说(种子只在肥沃的土壤中发芽,播散性肿瘤细胞(DTCs)只有在满足适当条件时才会在远处器官中形成转移。)
图源:苏黎世联邦理工学院
创新的“镶嵌肝”模型揭示关键转移因子
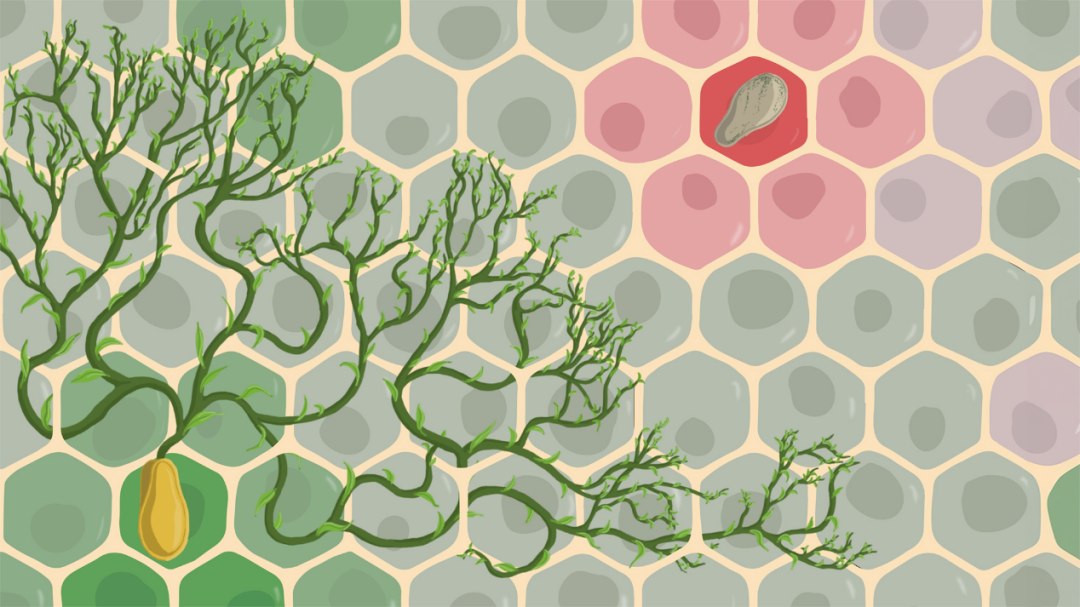
研究团队开发了一种创新的“镶嵌肝”(mosaic liver)模型来研究癌细胞如何在肝脏中定植。这个模型通过在肝脏中创造多个受扰动的环境来实现基因表达的多样性。
研究人员利用CRISPR激活系统在小鼠肝脏中实现这种基因表达的多样性。具体来说,他们首先创造了一种特殊的小鼠,其肝细胞能够响应CRISPR系统的信号。然后,通过尾静脉高压注射的方式,将含有sgRNA和转座酶的质粒导入小鼠肝脏。这些外源DNA能够稳定地整合到肝细胞的基因组中,使不同的肝细胞过表达不同的基因,形成了一个基因表达多样的“镶嵌肝”。
当研究人员将荧光标记的肿瘤细胞注入这种“镶嵌肝”后,他们可以观察哪些基因过表达的区域更容易吸引肿瘤细胞定植。通过分析转移灶近端和远端区域的肝细胞,研究人员能够识别出影响肿瘤细胞定植的关键基因
这种“镶嵌”方法让研究人员能够在一个活体动物模型中同时研究多个可能影响癌症转移的基因,大大提高了研究效率。最终,通过这种独特的实验设计,研究团队成功识别出Plexin B2是促进结直肠癌肝转移的关键因子。
图注:“镶嵌肝”筛选模型示意图。(CRISPR激活系统在肝细胞中创造基因表达多样性,形成“镶嵌肝”。当DTCs注入后,它们与不同基因表达的肝细胞相互作用。促进定植的基因会导致局部转移灶生长,相应的sgRNA在转移灶附近富集;而抑制定植的基因则不会促进生长,相应的sgRNA在转移灶附近减少。这种方法可以筛选出影响肿瘤定植的关键基因。)
图源:本篇论文
Plexin B2:肿瘤肝转移的关键推手
实验表明,肝细胞表面的Plexin B2蛋白显著促进结直肠癌、胰腺癌和黑色素瘤的肝转移。过表达Plexin B2小鼠可出现更多自发性肝转移,而敲除该基因肝转移受到抑制。研究还发现,Plexin B2主要影响癌细胞的初始定植,而非后续生长。
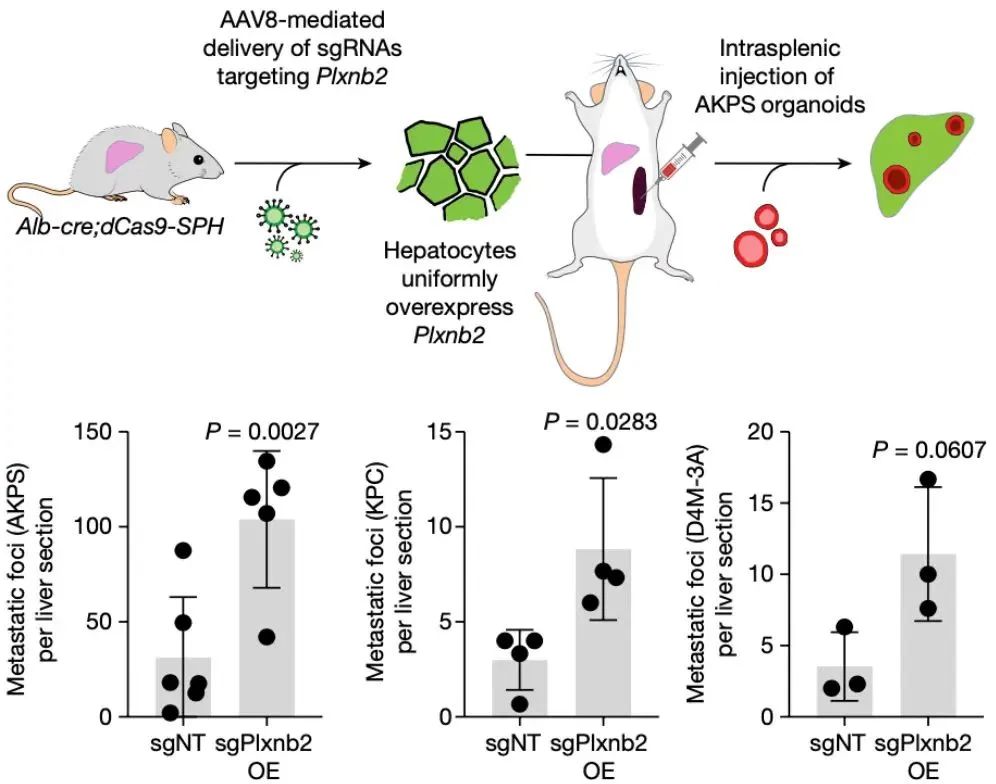
图注:过表达Plxnb2会促进肠癌(AKPS)、胰腺癌(KPC)和黑色素瘤(D4M-3A)转移
图源:本篇论文
Plexin B2促进癌细胞适应肝脏环境
研究发现,Plexin B2与癌细胞表面的IV类semaphorin蛋白相互作用,触发了一系列重要的细胞变化。这种相互作用导致KLF4转录因子的上调,促进癌细胞获得上皮特征。Moor教授解释道:“这一机制使癌细胞形成类似肠道褶皱的结构,有利于它们在肝脏中定植和建立新的肿瘤。”
研究还揭示了这一过程的时间顺序:Plexin B2和semaphorin的相互作用发生在促进生长的微环境形成之前,表明这是癌细胞适应新环境的早期关键步骤。这一发现不仅深化了我们对癌症转移机制的理解,也为开发早期干预策略提供了新的方向。
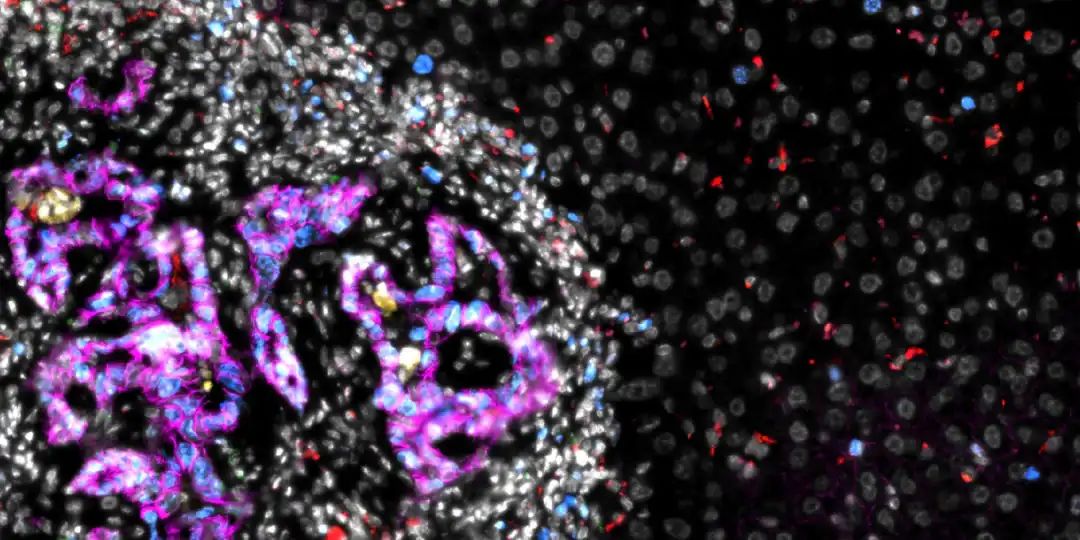
图注:结直肠癌肝转移(图像左半部分)。转移灶内的结直肠癌细胞(洋红色)被其他细胞(白色)包围
图源:苏黎世联邦理工学院
Semaphorin蛋白:转移风险的预警信号
研究发现,semaphorin蛋白在结直肠癌细胞中高表达。临床数据显示,肿瘤中semaphorin含量越高,结直肠癌转移到肝脏的风险越大。进一步研究表明,semaphorin的表达与癌细胞的特定基因活动和转移能力密切相关。
总结
Moor教授强调,这项研究对多种癌症都有重要意义。他指出:“癌细胞在新环境中会建立自己的生态系统。在这个过程的早期阶段,当癌细胞刚开始与周围环境建立联系时,可能是干预转移的最佳时机。”这一发现为开发预防癌症转移的新策略提供了重要方向。
引证本文
Borrelli, C., Roberts, M., Eletto, D. et al. In vivo interaction screening reveals liver-derived constraints to metastasis. Nature (2024).
https://doi.org/10.1038/s41586-024-07715-3
参考资料
1. Preventing cancer cells from colonising the liver,https://ethz.ch/en/news-and-events/eth-news/news/2024/07/preventing-cancer-cells-from-colonising-the-liver.html
2. Nature 632, 262-264 (2024)
doi: https://doi.org/10.1038/d41586-024-02235-6


