Science子刊:天津医科大学颜华/王晓虹/施福东/刘强合作揭示了新生血管性年龄相关性黄斑变性的潜在治疗靶点!
时间:2024-08-19 15:01:58 热度:37.1℃ 作者:网络
新生血管性年龄相关性黄斑变性(nvAMD)是老年人失明的主要原因。尽管已知nvAMD与局灶性炎症有关,但对控制这一过程的精确免疫成分的理解仍然有限。
2024年8月14日,天津医科大学颜华、王晓虹、施福东、刘强共同通讯在Science Translational Medicine在线发表题为”Natural killer cells promote neutrophil extracellular traps and restrain macular degeneration in mice“的研究论文,该研究表明自然杀伤细胞促进中性粒细胞胞外诱捕,抑制小鼠黄斑变性。
在这里,在nvAMD患者和小鼠模型中发现自然杀伤细胞(NK)是浸润脉络膜新生血管(CNV)病变血管周围间隙的重要淋巴细胞群。链接蛋白组学分析和单细胞RNA测序结合敲除研究表明,C-C趋化因子受体5 (CCR5)参与了小鼠CNV部位NK细胞的募集和外展。消耗NK细胞或抑制激活受体NK组2成员D (NKG2D)抑制中性粒细胞胞外陷阱的形成,增加血管渗漏,加剧病理性血管生成,表明NK细胞抑制了该小鼠模型的发病机制。年龄是AMD最强的危险因素,来自老年人类供体的NK细胞表现出较少的细胞毒性表型。老龄小鼠NK细胞在CNV小鼠模型中表现出受损的保护作用。此外,白细胞介素-2复合物介导的NK细胞扩增改善了小鼠CNV的形成。总的来说,该研究强调NK细胞是nvAMD患者的潜在治疗靶点。

年龄相关性黄斑变性(AMD)是全球导致老年人不可逆失明的主要原因(1),由于人口指数老龄化,患病率不断上升。AMD的特征是视网膜下间隙(早期)、视网膜色素上皮(RPE)和光感受器萎缩(“干”晚期)积累不溶性细胞外脂质聚积,以及脉络膜新生血管(CNV);“湿”后期)。约10%的干性AMD患者进展为湿性AMD,占视力丧失的90%。湿性AMD中,异常血管进入视网膜下间隙和神经视网膜,引起血管渗漏、水肿和出血,导致中心视力迅速丧失。十多年来,抗血管内皮生长因子(VEGF)药物已经彻底改变了nvAMD的治疗方法,并一直是一线治疗方法。然而,许多患者对抗VEGF治疗反应不完全,伴有持续的液体渗出、出血和进行性纤维化。此外,大约60%的患者在持续治疗1年后视力恢复不佳。因此,深入了解nvAMD的机制可能会产生新的治疗策略。
炎症是AMD进展的关键因素。在早期AMD中,含有免疫原修饰脂蛋白、补体蛋白和免疫球蛋白的蛋白在视网膜下空间积聚,引发不平衡的视网膜免疫反应,吸引免疫细胞,包括视网膜小胶质细胞和募集的巨噬细胞。吞噬细胞对玻璃膜疣的清除不足会引发血管生成反应,将疾病进展到晚期nvAMD。免疫细胞通过合成许多促血管生成因子和促进新生血管形成的细胞外基质降解酶,在调节血管生成中发挥关键作用。先前的研究已经证明髓系细胞,包括小胶质细胞、巨噬细胞和中性粒细胞在AMD病理中的作用。相比之下,淋巴细胞对AMD发展的影响尚不清楚。
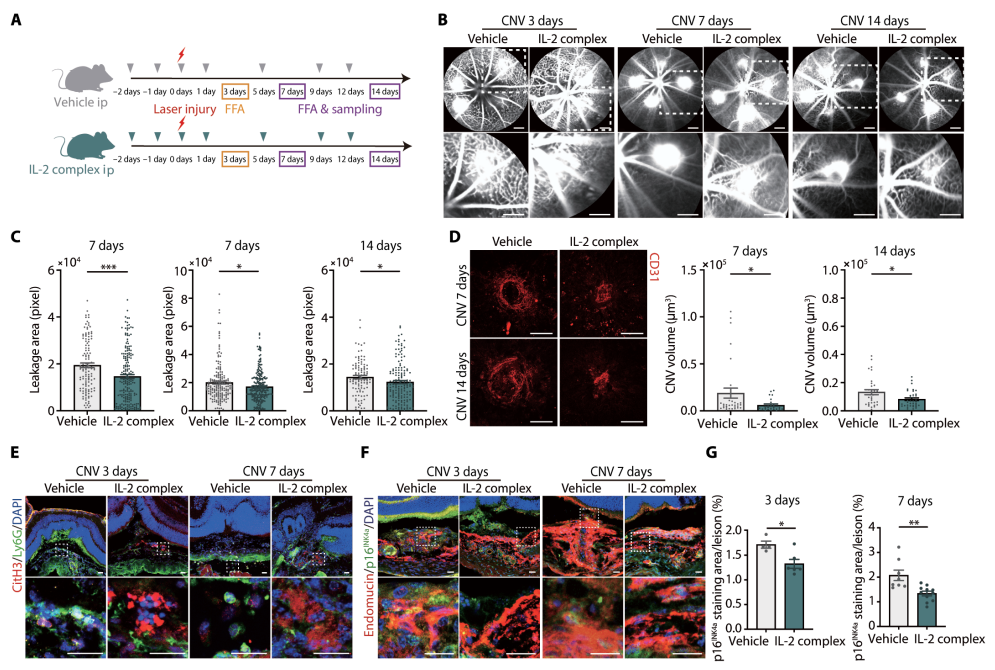
IL-2/IL-2单克隆抗体治疗性NK细胞扩增可改善小鼠血管渗漏和CNV形成
(图源自Science Translational Medicine)
自然杀伤细胞(NK)是先天淋巴样细胞,通过产生干扰素-γ (IFN-γ)来控制炎症反应的启动,并且可以在没有抗原呈递的情况下通过细胞毒活性消除靶细胞。NK细胞的活性取决于所接收的刺激和抑制信号的平衡。NK细胞对炎症信号反应迅速,是最早到达靶器官的细胞类型之一。然而,NK细胞的潜在参与及其对AMD的影响尚未确定。
利用AMD患者和小鼠模型的样本,作者表征了周围与AMD病变部位NK细胞的表型和功能,并研究了它们在AMD病理中的作用。从转化的角度来看,来自年轻生物体的NK细胞有助于病理性新生血管的消退,而来自衰老生物体的NK细胞则没有,这可能具有重要的临床意义。增加 NK 细胞活性对 CNV 产生积极影响,并减弱 nvAMD 中的新生血管形成。综上所述,这项研究解析了NK细胞在AMD中的作用及其机制,对NK细胞在CNV中的聚集、功能及相关机制进行了详细的阐述,并对于以NK细胞为靶点的nvAMD的治疗提出了新思路。
参考消息:
https://www.science.org/doi/10.1126/scitranslmed.adi6626


