【衡道丨干货】2024版CSCO胃肠间质瘤指南更新,国内外权威共识指南中的胃肠间质瘤的病理诊断有何异同?
时间:2024-08-25 06:05:21 热度:37.1℃ 作者:网络
一、病理检测的基本原则
(一)活检
内镜活检标本:核对临床送检标本数量、每块组织的大小,送检活检标本必须全部取材。将标本包于纱布或柔软的透水纸中,以免丢失,必要时加以染料标记;细针穿刺和空芯针穿刺活检标本;标明穿刺组织的数目、每块组织的大小,包括直径和长度,全部取材。
各类活检标本取出后立即固定,各类手术标本应在离体后30min内固定。室温下,采用10%甲醛溶液固定,固定液至少是标本体积的3倍。标本固定时间应为6~48h,以保证后续的免疫组织化学和分子生物学检测的可行性和准确性。其中活检标本:6~48h;手术标本:12~48h。对于直径≥2cm的肿瘤组织,必须每隔1cm予以切开,以便充分固定。
1、大体检查
Ⅰ级推荐:标本类型、部位、组织大小和数目
-
拍摄标本在新鲜状态下及固定以后的大体形态,包括外观和切面,标本下方放置标尺。
2、镜下检查
Ⅰ级推荐:组织学类型
-
组织学类型包括梭形细胞型、上皮样型、上皮样-梭形细胞混合型、去分化型。
3、免疫组化
Ⅰ级推荐:CD117、DOG-1、Ki67、SDHB、SDHA
-
SDHB缺失表达者(SDH缺陷型GIST)加做SDHA标记。
4、分子检测
Ⅰ级推荐:拟行靶向治疗、继发性耐药
5、危险度评估
Ⅰ级推荐:不评估
(二)手术标本
各类活检标本取出后立即固定,各类手术标本应在离体后30min内固定。室温下,采用10%甲醛溶液固定,固定液至少是标本体积的3倍。标本固定时间应为6~48h,以保证后续的免疫组织化学和分子生物学检测的可行性和准确性。其中活检标本:6~48h;手术标本:12~48h。对于直径≥2cm的肿瘤组织,必须每隔1cm予以切开,以便充分固定。
测量肿瘤3个径线(长径、纵径和横径)的大小,视不同质地和颜色予以充分取材,如有坏死,也包括坏死灶。若肿块最大径<2cm,全部取材;若肿块最大径≤5cm,应至少每1cm取材1块,必要时全部取材;若肿块最大径>5cm,应每1cm至少取材1块,如10cm的肿块至少取材10块。推荐取材组织块体积;不大于2cm×1.5cm×0.3cm。靶向治疗后的手术标本,需仔细观察原肿瘤部位的改变并进行记录,根据疑似病变大小常规进行充分取材,必要时全部取材。
取材剩余组织保存在标准固定液中,以备根据镜下观察诊断需求而随时补充取材,或以备在病理诊断报告签发后接到临床反馈信息时复查大体标本或补充取材。应始终保持充分的固定液量和甲醛浓度,避免标本干枯或因固定液量不足或浓度降低而致组织腐变。
剩余标本处理的时限:建议在病理诊断报告签发2周后,未接到临床反馈信息、未发生因外院会诊意见分歧而要求复审等情形后,由医院按相关规定处理。
1、大体检查
Ⅰ级推荐:标本类型、组织大小和数目、肿瘤有无破裂
-
肿瘤破裂情况:①肿瘤完整性受到破坏(破裂),合并或不合并肿瘤组织细胞溢出;②血性腹水;③肿瘤部位胃肠道穿孔;④分块切除肿瘤、肿瘤切开和肿瘤内解剖。文献认为以下4种情况不纳入GIST危险度分级的肿瘤破裂范畴:①肿瘤部位的黏膜缺损、肿瘤向胃肠道腔内破裂或造成消化道出血;②镜下肿瘤细胞的腹膜浸透或仅有医源性腹膜破损;③未发生并发症的经浆膜面空芯针或细针穿刺活检;④R1切除者。上述GIST肿瘤破裂或非破裂的临床情况,可以由自发性或医源性原因造成。
2、镜下检查
Ⅰ级推荐:组织学类型、核分裂象计数(5mm²)、切缘或假包膜情况
-
组织学类型包括梭形细胞型、上皮样型、上皮样-梭形细胞混合型、去分化型。
-
显微镜目镜为22mm时,5mm²相当于21个高倍(×40)视野。
3、免疫组化
Ⅰ级推荐:CD117、DOG-1、Ki67、SDHB、SDHA
Ⅱ级推荐:CD34
Ⅲ级推荐:PDGFRA
-
SDHB缺失表达者(SDH缺陷型GIST)加做SDHA标记。
4、分子检测
Ⅰ级推荐:拟行靶向治疗、继发性耐药
Ⅱ级推荐:低危GIST分子检测和野生型NGS
5、危险度评估
Ⅰ级推荐:CSCO胃肠间质瘤诊治共识GIST危险度分级2017修改版(NIH2008改良版)
Ⅱ级推荐:WHO预后分组/AFIP风险评估
Ⅲ级推荐:其他病理学特征、新鲜组织留取
-
不良生物学行为的病理学特征包括明显异型、浸润黏膜/肌层/神经/脂肪、肿瘤性坏死、围绕血管呈簇状生长。囊性变往往提示预后好,黏液变性意义未明。
-
对手术切除标本,有条件的单位(如建有生物样本库者),在获得患者知情同意后,在标本固定前留取不影响病理诊断的适量新鲜组织放入液氮中,然后再移置-80℃超低温冰箱,以备日后检测和研究之用。
与NCCN指南比较
组织切片显微镜检查的形态学诊断是GIST的诊断标准。建议使用几种辅助诊断技术支持GIST诊断,包括SDHB、CD117和DOG1的免疫组织化学(IHC)以及KIT和PDGFRA突变的分子遗传学检测,以及其他潜在的驱动基因(如BRAF、NF1、NTRK和FGFR融合)。
NCCN指南指出病理评估应包括以下特征的评估,所有这些都应在病理报告中有明确说明:
-
器官、部位和手术方法
-
初级诊断(使用标准化命名法,如WHO分类)
-
肿瘤深度:浅表/深部
-
肿瘤大小
-
组织学分级
-
坏死:有或无;镜下或大体;大致范围(百分比)
-
切除边缘:未受累;受累(边缘状态);闭合(边缘状态和所测距离)
-
淋巴结情况:部位;数量评估;阳性数量
-
辅助检测结果:检测类型(电子显微镜,免疫组化,分子遗传分析);操作位置
-
具有潜在临床价值其他肿瘤特征:有丝分裂率;是否存在血管浸润;肿瘤边缘特征(界限分明或浸润性);炎性浸润(类型和程度)
-
TNM分级
二、免疫组织化学检测
(一)经典型GIST
Ⅰ级推荐:CD117、DOG-1、Ki67
Ⅱ级推荐:CD34
Ⅲ级推荐:PDGFRA
(二)SDH缺陷型GIST
Ⅰ级推荐:CD117、DOG-1、SDHB、SDHA、Ki67
-
SDH缺陷型GIST多发生在胃,以无KIT/PDGFRA突变和SDHB缺失表达为特征,SDHA缺失表达提示SDHA突变。
(三)NF1相关性GIST
Ⅰ级推荐:CD117、DOG-1、Ki67
Ⅱ级推荐:Neurofibromin
-
在I型神经纤维瘤病中的发生率为7%,GIST发生于小肠,常为多结节性,瘤细胞表达CD117和DOG-1,但分子检测KIT/PDGFRA无突变。
-
Neurofibromin推荐抗体为clone NFC。
(四)BRAF突变型GIST
Ⅰ级推荐:CD117、DOG-1、Ki67
Ⅱ级推荐:BRAF
-
BRAF突变在GIST中发生率较低,推荐检测抗体为clone VE1。
(五)NTRK3重排GIST
Ⅰ级推荐:CD117、DOG-1、Ki67、pan-TRK
-
NTRK3重排在GIST中发生率很低,推荐检测抗体为clone EPR17341。
三、分子诊断适应人群
GIST分子诊断适应人群
Ⅰ级推荐:拟行靶向治疗、继发性耐药
-
包括:①原发可切除GIST术后评估为中-高危;②活检病理证实为GIST,不能手术;③活检病理证实为GIST,术前拟行靶向治疗;④复发性和转移性GIST1。
Ⅱ级推荐:低危GIST、疑难病例明确诊断、同时性或异时性多原发GIST、如一代测序检测为野生型GIST,可行二代基因测序(NGS)
-
包括SDH缺陷型、NF1相关型、BRAF突变型、KRAS突变型、PIK3A突变型、FGFR1重排、NTRK3重排和BRAF重排GIST。
Ⅲ级推荐:小GIST、微小GIST
-
不包括危险度评估为中危者(≤2cm,核分裂象6~10个/5mm²)与高危者(≤2cm,核分裂象>10个/5mm²)。
四、分子检测内容
(一)经典型GIST
Ⅰ级推荐:
1)Sanger测序;
2)外显子突变检测包括:
KIT:9,11,13,17
PDGFRA:12,14,18。
Ⅱ级推荐:二代基因测序(NGS)
-
NGS检测基因突变包括KIT、PDGFRA、SDHA、SDHB、SDHC、SDHD、BRAF、NF1、KRAS和PIK3CA,检测基因重排包括FGFR1、NTRK3和BRAF。其中,SDH亚单位和NF-1多为胚系变异,Carney三联征涉及SDHC表观突变(启动子甲基化),其他基因检测体系变异。
(二)继发耐药突变GIST
Ⅰ级推荐:增加KIT:14,18
Ⅱ级推荐:NGS
(三)野生型GIST
Ⅰ级推荐:NGS
Ⅲ级推荐:FISH
-
NTRK3和BRAF基因重排可采用FISH检测,或加做FISH用以验证NGS检测结果。
与NCCN指南比较
NCCN指南突变检测原则表示:
-
大约80%的GIST存在KIT受体酪氨酸激酶编码基因发生突变;另外5%-10%的GIST存在PDGFRA受体酪氨酸激酶编码相关基因发生突变。KIT和PDGFRA突变的存在和类型与预后明显相关性。
-
GIST中KIT和PDGFRA的突变导致具有结构性酪氨酸激酶活性的突变蛋白表达。如果将TKIs视为治疗计划的一部分,则应进行KIT和PDGFRA突变检测,因为KIT和PDGFRA基因的特定区域存在突变(或无突变)与特定TKI的缓解(或无缓解)相关。
-
KIT或PDGFRA的特定突变与肿瘤表型有一定的相关性,但突变与单个肿瘤的生物学潜力相关性不强。累积数据显示,KIT突变并不是高级别肿瘤中特有的,也可以在偶发小肿瘤以及具有惰性病程的肿瘤中发现。同样,PDGFRA的突变分析不能用于预测单个肿瘤的生物学行为。
-
基于肿瘤突变状态,GISTs对伊马替尼的反应率不同。KIT 9号外显子突变对于400mg反应率和无进展生存期(PFS)低于外显子11号肿瘤,但400mg BID剂量与更好的PFS有关。除D842V外,大多数PDGFRA突变与伊马替尼的应答相关。除阿伐普利尼之外,D842V与伊马替尼和大多数其他获批用于治疗GIST的TKIs应答均不相关。
-
转移灶的获得性耐药通常是KIT或PDGFRA中继发性伊马替尼耐药突变的结果。舒尼替尼适用于伊马替尼耐药肿瘤或伊马替尼不耐受的患者。瑞戈非尼适用于伊马替尼和舒尼替尼治疗期间疾病进展的患者。 瑞普替尼适用于之前接受过3种或更多激酶抑制剂治疗的患者,包括伊马替尼。在病情进展时,使用瑞普替尼150mgBID可能会获得额外的临床益处。强烈建议对伊马替尼、舒尼替尼、瑞戈非尼、瑞普替尼和阿帕替尼产生耐药突变的患者进行临床试验。
-
约10%-15%的GIST缺乏KIT或PDGFRA的突变。这些GIST绝大多数具有琥珀酸脱氢酶(SDH)复合物的功能失活,可以通过免疫组化(IHC)检测SDHB的缺失表达来证实。SDH复合物的失活可能是由突变或表观遗传沉默引起。少数缺乏SDH表达的GIST有替代驱动突变。
-
所有缺乏KIT或PDGFRA突变的GISTs应使用二代测序法(NGS)检测SDH缺陷和其他驱动基因突变。
1)此外,使用NGS测试替代驱动基因突变确定潜在靶向治疗(例如,BRAF、NF1、NTRK和FGFR的融合)。
2)优先考虑组织活检;在特定情况下,新方法(例如循环肿瘤DNA [ctDNA])可能适用。
3)如果完成的分子检测显示没有突变,考虑咨询进行检测的实验室或分子检测方面的专家(病理学家、医学遗传学家等),以确保所做的检测能够检出所有关注的分子异常。如果不能,需要重新进行检测以包括合适的检测项目。
-
伴有SDH突变的GIST通常发生在年轻个体的胃部,常发生转移,可能累及淋巴结,通常生长缓慢。SDH缺陷肿瘤可能从舒尼替尼或瑞戈非尼治疗中获益。建议所有SDH缺陷型GIST患者和携带NF1或SDH突变的GIST患者转诊至遗传咨询师进行胚系基因检测评估。SDH突变的患者有发生副神经节瘤的风险;建议在手术前进行24小时尿检。
-
与NF1(神经纤维瘤病1型)相关的GIST通常发生在小肠中,可能是多灶性的,并且往往具有惰性的生物学特性。应该对它们进行KIT和PDGFRA的经典突变检测,因为它们也可能包含这些突变。如果患者有NF1相关的GIST并且之前没有进行过评估,应该推荐他们进行遗传咨询。在没有KIT或PDGFRA突变的情况下,使用酪氨酸激酶抑制剂(TKI)治疗NF1相关的GIST的数据有限,可以考虑参与临床试验。
五、危险度评估与预后分组
原发性GIST危险度评估、预后分组和风险评估系统及TNM分期:
危险度评估和预后分组仅适用于术前未行靶向治疗经手术切除的原发性GIST。与其他恶性肿瘤不同,除SDH缺陷型GIST外,非SDH缺陷型GIST极少发生淋巴结转移。
Ⅰ级推荐:中国共识2017修改版即NIH 2008改良版
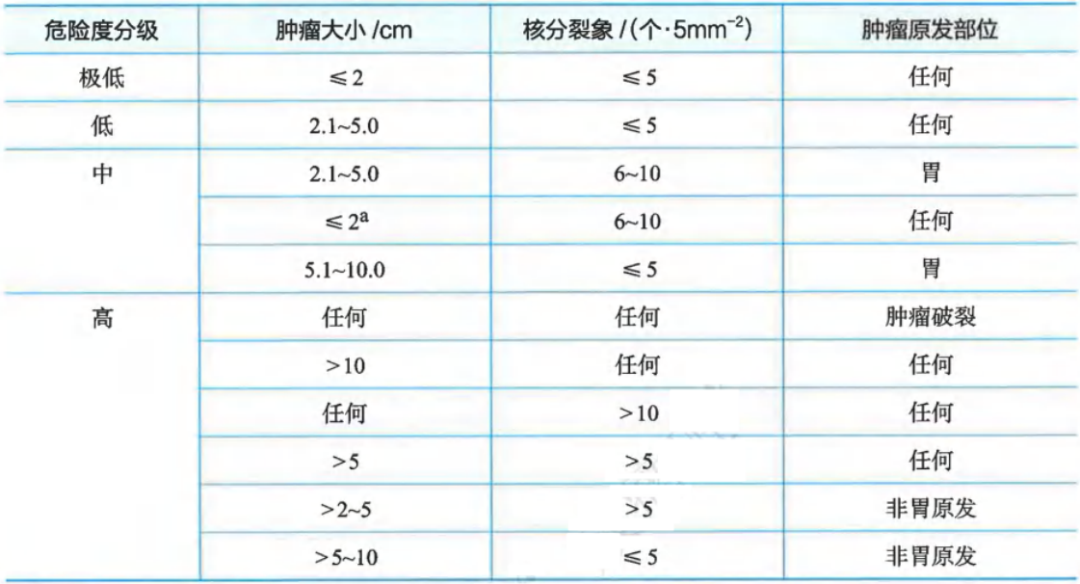
原发胃肠间质瘤危险度分级(CSCO胃肠间质瘤诊治共识GIST危险度分级2017修改版)
Ⅱ级推荐:WHO预后分组/AFIP风险评估
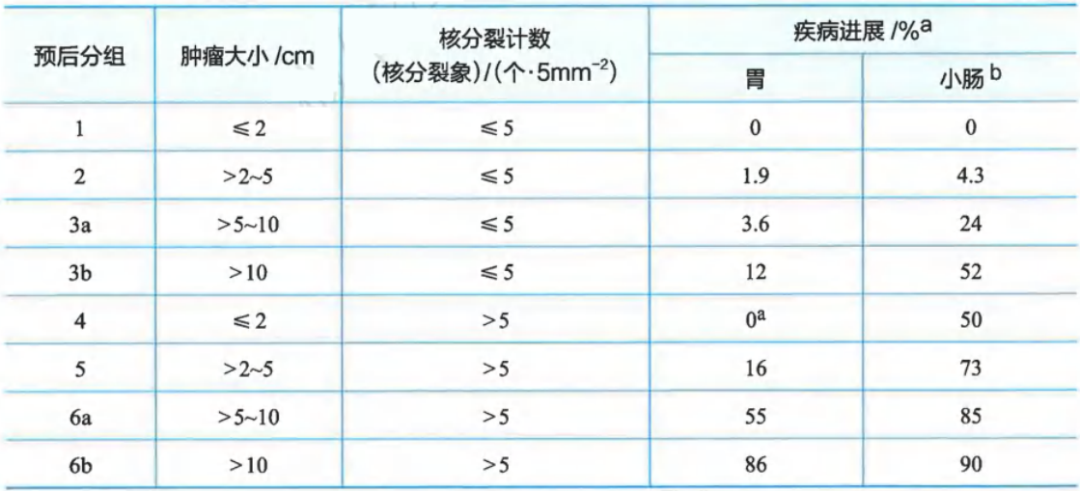
肿瘤大小和核分裂计数与胃肠间质瘤预后相关性(基于AFIP大系列随访研究)
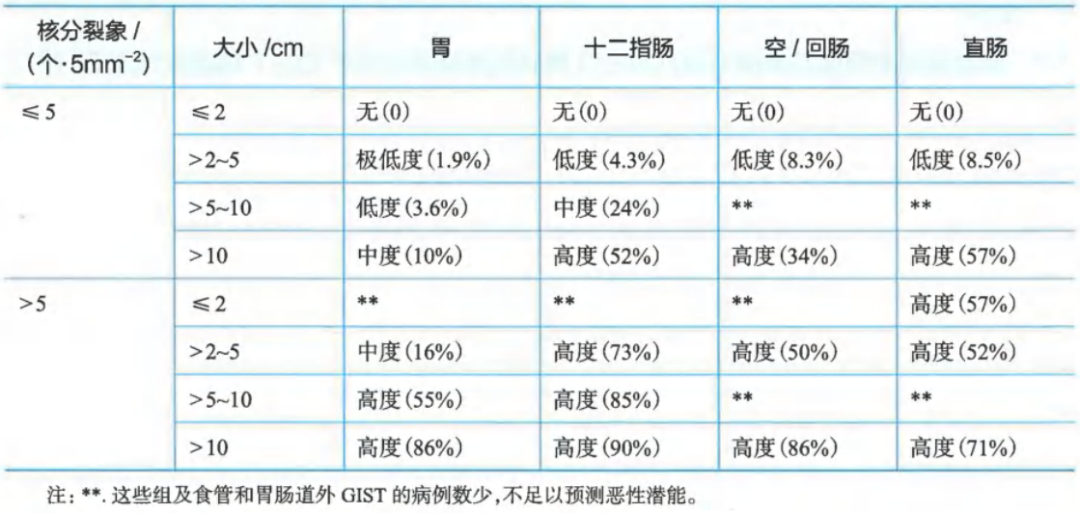
原发胃肠间质瘤疾病进展风险评价(AFIP)
Ⅲ级推荐:TNM分期

与NCCN指南比较
胃GIST:恶性潜能评估推荐指南
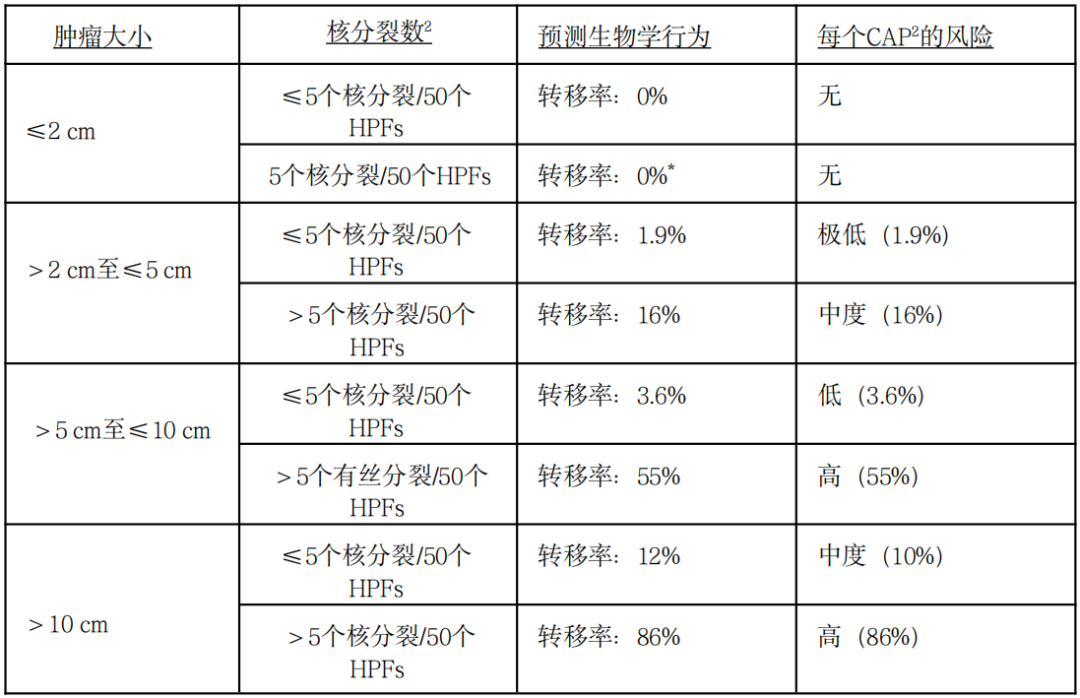
注:GIST:胃肠道间质瘤;HPFs:高倍视野;*基于少数几个肿瘤类别的预测值
非胃部GISTs:恶性潜能评估推荐指南
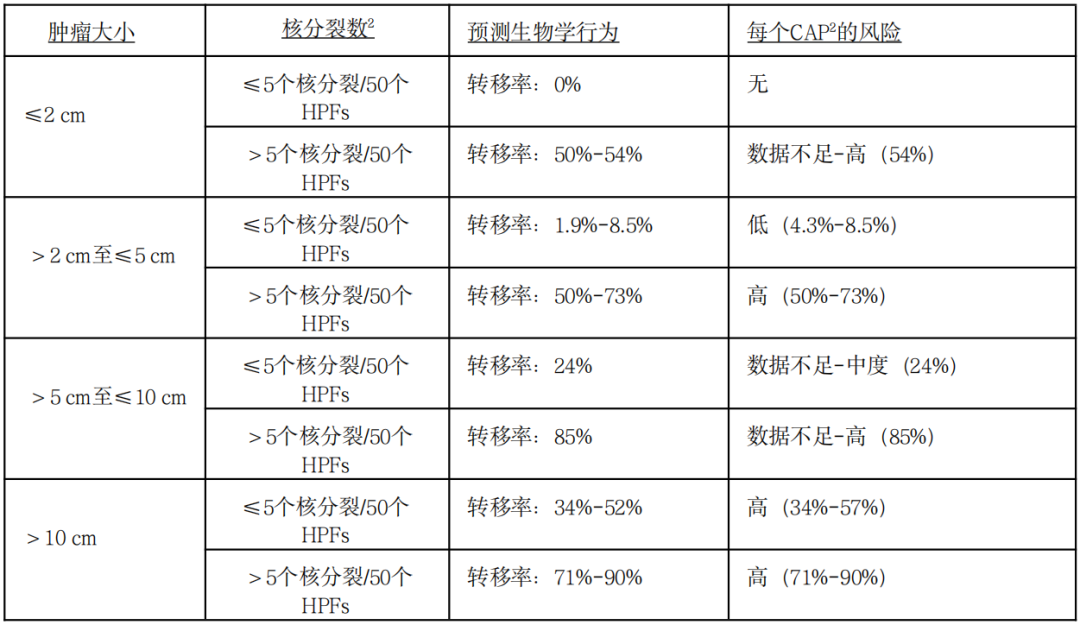
GISTs:胃肠道间质瘤;HPFs:高倍镜视野
-
这种预后评估最适用于KIT或PDGFRA阳性的GISTs,而SDH缺失的GISTs则更难预测。对于本表未列出的解剖学部位,如食道、肠系膜和腹膜,或在“数据不足”的情况下,最好使用空肠/回肠的风险标准。
-
风险评估是在事先没有接触过TKI治疗的情况下确定的。
六、GIST病理诊断流程
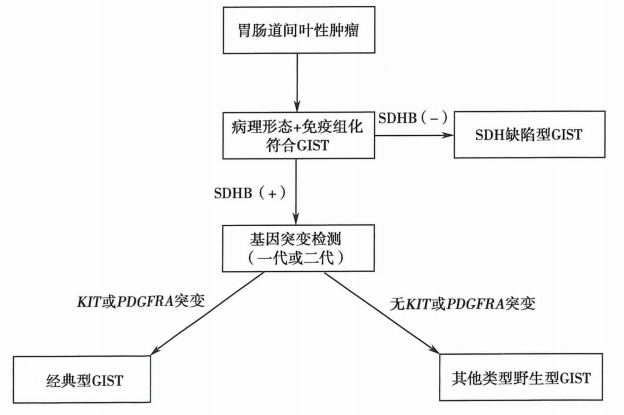
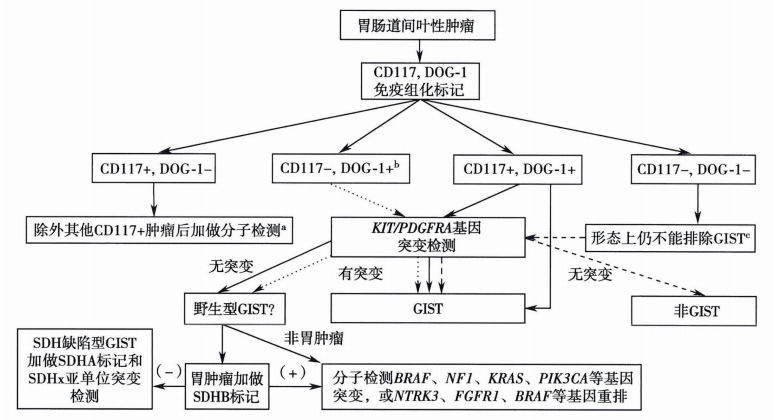
参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)胃肠间质瘤诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Gastrointestinal Stromal Tumors. Version 1.2024


