JEV:海军军医大学高旭等团队合作开发尿细胞外囊性前列腺癌风险评估的新方法
时间:2024-08-26 23:02:18 热度:37.1℃ 作者:网络
在通过液体活检进行高效肿瘤诊断的探索中,细胞外囊泡(EVs)已显示出作为潜在生物标志物来源的潜力。
2024年8月22日,海军军医大学高旭及哈佛医学院Liu Fei共同通讯在Journal of Extracellular Vesicles在线发表题为“UPCARE: Urinary Extracellular Vesicles-Derived Prostate Cancer Assessment for Risk Evaluation”的研究论文,该研究解决了在西方和中国人群中预测临床显著性前列腺癌(csPCa)的生物标志物功效的差距。
研究建立了基于尿细胞外囊泡的前列腺评分(EPS)模型,利用EXODUS技术从598例患者中分离EV,并纳入FOXA1, PCA3和KLK3的基因表达。研究结果显示,在234名患者中,EPS模型的诊断准确性超过了前列腺特异性抗原(PSA)测试,达到了0.730的曲线下面积(AUC),而PSA为0.659 (p = 0.018)。同样,在101名男性的验证队列中,EPS模型的AUC为0.749,明显优于PSA的0.577 (p < 0.001)。研究的模型显示,不必要的前列腺活检可能减少26%,csPCa病例的漏检率仅为3%,这表明其在中国人群中的有效性。

前列腺癌(PCa)是一种主要的实体肿瘤,是全球男性癌症相关死亡的第二大常见原因。在中国,前列腺癌新诊断的增加主要归因于人口老龄化,这给中国的医疗基础设施带来了重大挑战。有证据表明根治性手术或放射治疗在降低具有临床意义的前列腺癌患者的死亡风险方面非常有效。尽管取得了这些进展,使用前列腺特异性抗原(PSA)进行前列腺健康评估仍面临着严格的审查。PSA水平升高可能不仅表明前列腺癌,也反映了前列腺炎和前列腺增生等良性疾病,导致近60%的男性在筛查过程中进行了不必要的活组织检查。此外,前列腺活组织检查的侵入性带来了不良反应的风险,包括疼痛、感染、出血和泌尿系统问题,揭示了普遍基于PS筛查的实践缺点。这种做法有过度诊断和过度治疗的风险,造成不必要的患者痛苦和医疗费用。
最近的进展已经引入了各种新的前列腺癌筛查方法,旨在通过提供更精确的诊断和最大限度地减少不必要干预的可能性,从而超越传统的PSA检测。例如,基于血液的诊断包括FDA批准的前列腺健康指数(PHI)和4K评分测试。EPI分析尿细胞外囊泡(uEVs)中PCA3和ERG的RNA表达,显示出鉴别高级别PCa的显著潜力。这些进步揭示了前列腺癌检测的发展前景,强调了向更准确和更少侵入性诊断方法的转变。根据中国临床肿瘤学会(CSCO)发布的《前列腺癌诊疗指南2023》,对于PSA筛查结果异常的男性,应进一步进行PSA复检。对于那些仍然表现出异常的人,可以使用尿液检查、PHI、成像研究和风险计算器来进一步准确诊断。然而,需要采集血液样本,这可能成为一些患者的障碍。另一方面,基于尿液的诊断提供了一种非侵入性和方便的选择,在欧洲和美国特别流行。
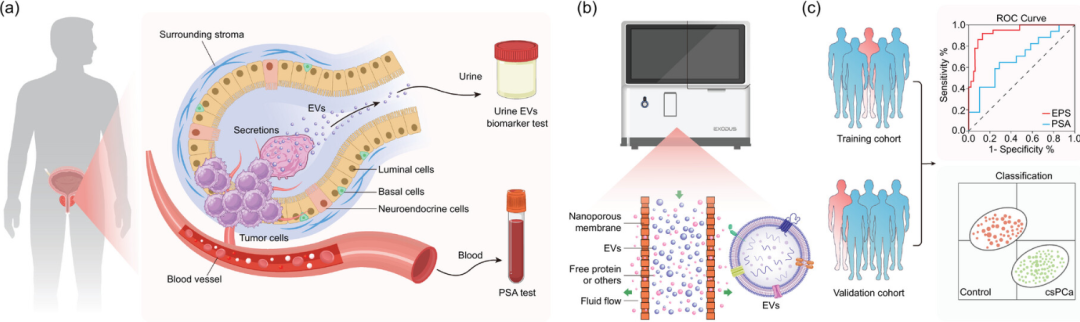
UPCARE工作流程概述(图源自Journal of Extracellular Vesicles)
细胞外囊泡(EVs)由细胞分泌,已成为癌症诊断中液体活检的重要生物标志物。尿源性EVs尤其值得注意,尤其是来自泌尿系统和前列腺肿瘤的EVs。这些囊泡中的RNA比直接从尿液或沉积物中提取的RNA稳定得多,通过提高生物标志物的敏感性和特异性,提高了前列腺癌的诊断准确性。著名的EPI检测(uEVs的一种)对欧美人群的高级别PCa预测有效;然而,其在中国人群中的疗效受到ERG基因表达较低的阻碍,这表明需要针对中国PCa患者定制uEV检测。研究提出了一种新颖的萃取方法——EXODUS,旨在有效地分离出高质量的uEV。该技术在净化各种生物液体(包括尿液、血浆、脑脊液和唾液)中的EVs方面表现出了卓越的效率。这些成功提取的完整EVs为诊断一系列疾病提供了坚实的基础。
研究集中在一个中国队列中,在接受前列腺活检之前收集参与者的尿液样本。利用EXODUS技术,研究成功地分离出了用于分析PCA特异性囊泡RNA的uEV。研究特别关注叉头盒A1 (FOXA1)基因,该基因在中国PCa人群中具有重要意义。此外,研究评估了前列腺癌抗原3 (PCA3)和钾likrein相关肽酶3 (KLK3)基因在csPCa中的表达。利用这些制定了细胞外囊泡前列腺评分(EPS),这是一个专门用于筛查中国人群中csPCa的诊断框架。EPS模型旨在减少对不必要的前列腺活检的需要,从而解决当代医疗实践中的一个关键问题。
参考消息:
https://isevjournals.onlinelibrary.wiley.com/doi/10.1002/jev2.12491

