云南大学王家强教授团队《AHM》:氯配位的铁基单原子纳米酶实现过氧化氢选择性催化分解及抗肿瘤特异性治疗
时间:2024-09-14 18:00:42 热度:37.1℃ 作者:网络
癌症是一大类严重威胁人类健康和生命的疾病,其中包括肺癌、肝癌和乳腺癌等。这类疾病的发病率和死亡率一直居高不下。化疗是最为传统的癌症治疗方法,然而它存在严重副作用,主要源于其非特异性,既能杀死癌细胞,也会对正常组织细胞造成伤害。癌细胞具有独特的肿瘤微环境(TME),与正常组织细胞相比,TME呈弱酸性且H₂O₂含量相对较高,这为利用纳米材料干扰H₂O₂开发抗肿瘤疗法提供了契机。具有过氧化物酶活性的纳米材料(纳米酶)能够催化细胞内的H₂O₂产生羟自由基(•OH),从而杀死癌细胞,可被视作一种抗肿瘤纳米药物。然而,TME中微量的 H₂O₂浓度(50-100 μM)以及肿瘤中涉及谷胱甘肽过氧化物酶 (GPX4)的自我保护性抗氧化应激平衡,限制了纳米酶的治疗效果。

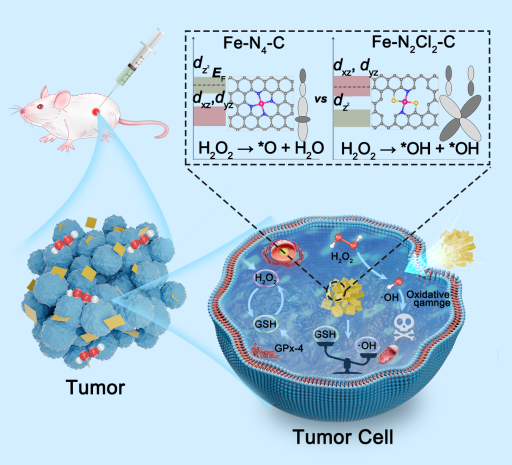
2024年9月2日,云南大学王家强教授团队在《Advanced Healthcare Materials》发表了题为“Atomically Engineered Chlorine Coordination of Iron in Active Centers for Selectively Catalytic H2O2 Decomposition toward Efficient Antitumor-Specific Therapy”的工作,并成功入选到该期刊的热门主题:肿瘤和癌症。该研究制备了以铁单原子与氯原子精确配位为活性中心的铁基单原子纳米酶(Fe-N2Cl2-C SAzyme)(图1)。过氧化物酶活检测表明,Fe-N2Cl2-C对H2O2的催化效率高达Kcat/Km = 2.19 × 106 mM-1 s-1,是HRP(1.32 × 103 mM-1 s-1)的1659倍,据我们所知,是目前已报道的单原子纳米酶中最高的。实验和密度泛函理论计算证实,大量•OH自由基的产生源于H2O2在 Fe-N2Cl2-C SAzyme表面的初始分解途径的高选择性,这也是其具有卓越的过氧化物酶性能的原因;我们发现,由于弱场Cl配体与 Fe 原子配位,Fe-N2Cl2-C SAzyme中的Fe 活性中心dz2轨道充满了d电子,而简并的dxz和dyz轨道则半充满,从而导致H2O2高选择性分解为•OH自由基。体外细胞实验表明,Fe-N2Cl2-C SAzyme 对各种类型的癌细胞具有突出的杀伤力,但对正常细胞的毒性却可以忽略不计,因为它能有效地将细胞内的H2O2分解为•OH,从而克服与细胞抗氧化平衡相关的自我保护机制,导致癌细胞死亡(图2)。此外,活体动物实验和组织学染色显示,Fe-N2Cl2-C SAzyme作为一种纳米药物,对抑制体内恶性实体瘤有很好的特异性治疗效果,即在不损伤正常组织的情况下有效地破坏实体瘤(图2)。本研究主要发现弱场配体可调控活性中心d轨道电子重排,实现对过氧化氢选择性分解生成羟基自由基用于高效肿瘤特异性治疗。
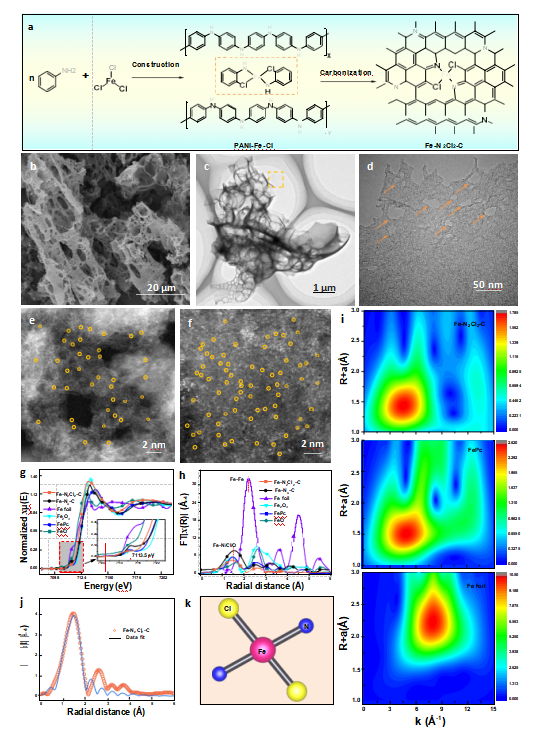
图 1. 基于 Fe 特征分子构建制备 Fe-N2Cl2-C SAzyme
(图源:W. Li, D. Chen, et al., Adv. Healthcare Mater. 2024, 2401267)
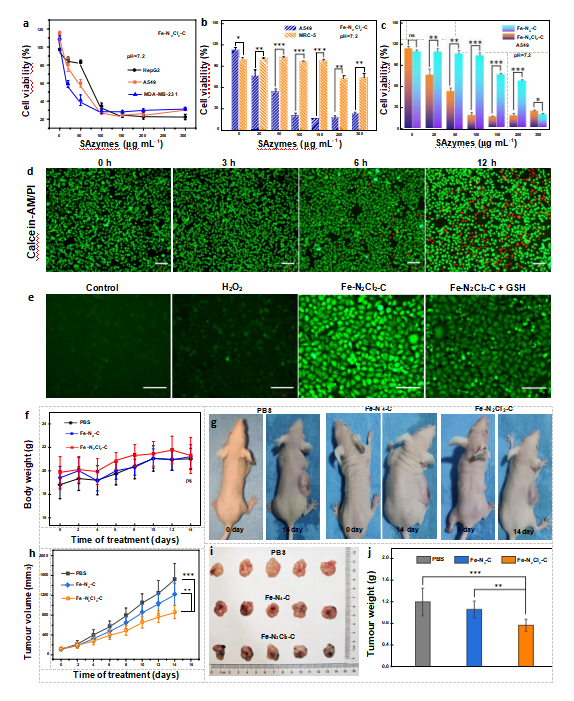
图 2. Fe-N2Cl2-C SAzyme 体外癌细胞毒性实验和抗肿瘤活体实验
(图源:W. Li, D. Chen, et al., Adv. Healthcare Mater. 2024, 2401267)
云南大学为该论文独立通讯单位,王家强教授为唯一通讯作者,团队李卫博士(现就职于昆明理工大学分析测试研究中心)和陈道梅副教授(云南大学材料于能源学院)为本论文的共同第一作者。本研究受到国家自然科学基金、云岭学者人才项目、云南省基础研究项目和云南省贵金属实验室科技计划项目等资助。
原文链接:
https://doi.org/10.1002/adhm.202401267


