约30%胃癌患者检出同源重组(HR)基因变异,能否预测一线铂类化疗疗效?
时间:2024-09-17 14:00:25 热度:37.1℃ 作者:网络
同源重组缺陷 (HRD) 是癌症的重要标志之一。它与对铂类化疗的较好反应有关。本研究探索了 HRD 胃癌 (GC) 的独特临床病理特征以及 HRD 在不可切除转移性 GC 一线铂类化疗中的临床意义。本研究纳入了 160 例 GC 患者。这些患者进行了肿瘤样本基因检测。HRD 被定义为 16 个 HR 基因 (BARD1、BLM、BRCA1、BRCA2、BRIP1、MRE11A、NBN、PALB2、PARP1、POLD1、RAD50、RAD51、RAD51C、RAD51D、WRN 和 XRCC2) 中的任何一个发生改变。比较了不可切除转移性GC中HRD组和非HRD组患者的临床病理特征和一线化疗治疗结果。47例患者(29.4%)被归入HRD组。该组患者中肉眼3型或4型肿瘤比例显著低于非HRD组,TMB高于非HRD组。在接受一线铂类化疗的患者中,HRD组治疗后缓解率更高,无进展生存期更长(中位8.0个月 vs. 3.0个月,P = 0.010),调整后的风险比为0.337(95%置信区间0.151–0.753)。对于未接受铂类化疗的患者,HRD状态与治疗结果无关。本研究表明,肉眼3型或4型肿瘤比例较低和TMB较高是HRD GC的独特特征。HRD 状态是不可切除转移性 GC 一线铂类化疗的潜在预测标志物。
研究背景
胃癌 (GC) 是全球第四大癌症相关死亡原因。多种抗癌药物全身治疗是不可切除转移性 GC 的标准治疗方法。最近,使用铂类药物联合适当的分子靶向药物和/或免疫检查点阻断疗法 (ICB) 的全身疗法使人表皮生长因子受体 2 (HER2) 阴性和 HER2 阳性 GC 的中位总生存期分别延长至 12.9-18.23 个月和 20.0 个月。因此,全球推荐包括顺铂和奥沙利铂在内的铂类药物作为不可切除转移性 GC 一线治疗的关键药物。
基因组不稳定性被认为是癌症的重要标志之一,与开发癌症疗法有关。同源重组 (HR) 通路由 BRCA1、BRCA2、PALB2 和 RAD51 等多个基因组成,是一种 DNA 双链断裂修复机制,可防止基因组不稳定。DNA 修复机制被认为与癌症治疗领域对放疗和抗癌药物的反应有关。铂类药物通过共价结合嘌呤 DNA 碱基产生链间交联 (ICL),从而导致细胞凋亡。HR 对 ICL 的修复至关重要,并导致对铂类药物的耐药性。HR 基因变异导致的 HR 缺陷 (HRD) 与铂类化疗在乳腺癌和卵巢癌中的较高疗效密切相关。最近细致的体外研究表明,铂类药物对突变特征分析显示 HRD 的 GC 细胞非常有效。然而,在不可切除转移性 GC 患者中,关于 HRD 状态与一线铂类化疗治疗结果之间相关性的临床数据很少。
利用肿瘤靶向测序的基因检测能够在单次检测中评估多个基因变异。在这个癌症基因组医学时代,在不可切除转移性 GC 中对 HR 基因的全面评估可能有助于发现 HRD 并优化全身治疗。本研究旨在利用我们之前研究中确定的 GC 基因图谱来描绘 HR 基因变异图谱和 HRD 的独特临床病理特征。此外,我们还探讨了肿瘤靶向测序评估的 HRD 结合一线铂类化疗对不可切除转移性 GC 的临床意义。
研究结果
纳入了 2009 年至 2019 年期间在新潟大学医齿科综合医院或新潟癌症中心医院接受 GC 抗癌治疗的 160 例患者。表 1 总结了患者的临床病理特征。男性 113 人,女性 47 人,中位年龄(范围)为 68 岁(27-87 岁)。159 例患者接受了根治性胃切除术和淋巴结清扫术。

表1
HR基因变异图谱与临床病理特征
在 160 例患者中,共检测到 16 个 HR 基因(BARD1、BLM、BRCA1、BRCA2、BRIP1、MRE11A、NBN、PALB2、PARP1、POLD1、RAD50、RAD51、RAD51C、RAD51D、WRN 和 XRCC2) 121 个变异。排除良性或可能良性的 ClinVar 变异和中性或可能中性的 OncoKB 变异后,对 85 个变异进行了分析。图 2a 显示了 160 例患者中 16 个 HR 基因的变异图谱。RAD50 是最常见的变异基因,在 12 例患者(7.5%)中发生变异。在 10 例患者(6.3%)和 8 例患者(5.0%)中分别检测到 BRCA2 和 BRCA1 变异。总体而言,47 例(29.4%)有 HR 基因变异的患者被归类为 HRD 组,其余 113 例患者被归类为非 HRD 组。两组间肿瘤位置 (P = 0.197) 或 Lauren 分类 (P = 0.290) 无显著差异 (图 2b)。就肉眼类型而言,HRD 组 3 型或 4 型肿瘤的比例显著低于非 HRD 组 (29.8% vs. 54.9%, P = 0.005) (图 2b)。两组间其他临床病理特征无显著差异。
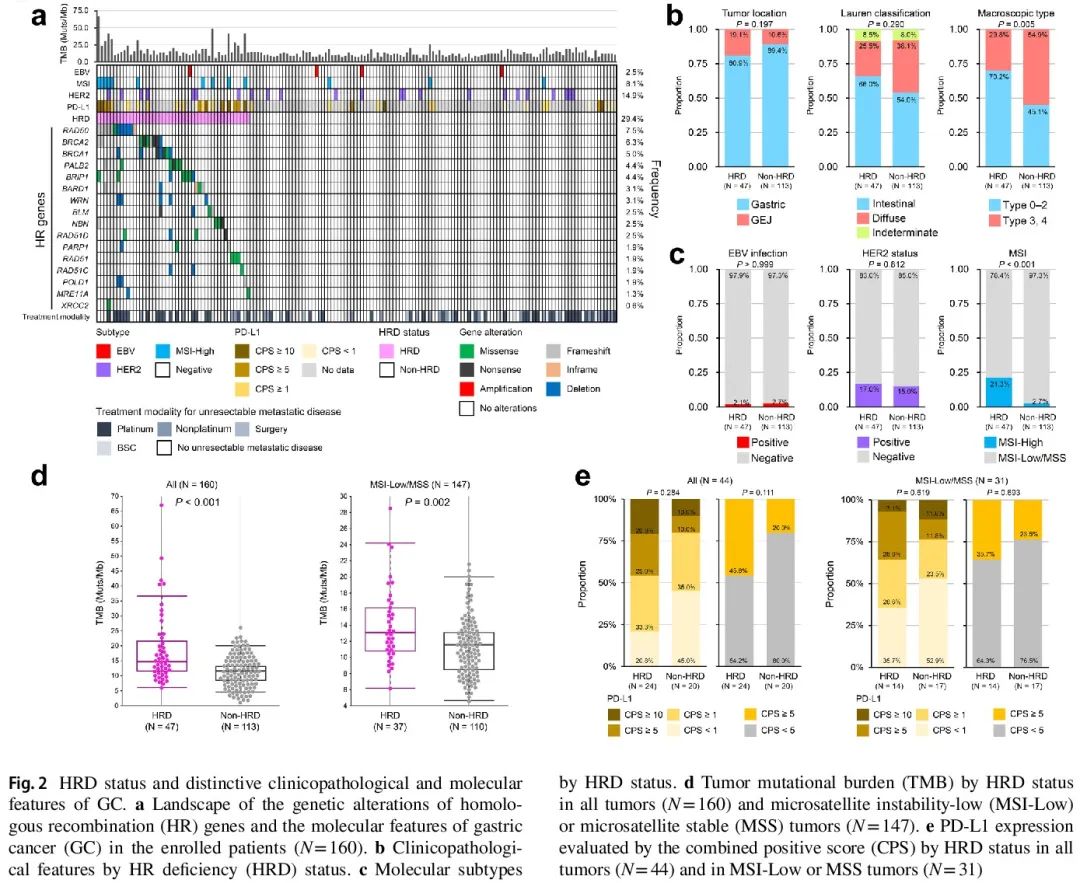
图2
基于HRD状态的分子特征
EBV 感染 (P > 0.999) 和 HER2 状态 (P = 0.812) 在 HRD 组和非 HRD 组之间无显著差异 (图 2c)。HRD 组中的MSI-H 肿瘤比例显著高于非 HRD 组 (21.3% vs. 2.7%, P < 0.001)。当我们研究两组之间的 TMB 和 PD-L1 表达差异时(图 2d 和 e),我们发现 HRD 组的 TMB 更高(中位 14.6 Muts/Mb vs. 11.5 Muts/Mb,P < 0.001)。即使在 MSI-L 或 MSS 亚组(N = 147)中,HRD 组的 TMB 也显著更高(中位 13.1 Muts/Mb vs. 11.5 Muts/Mb,P = 0.002)。在 160 例患者中,有 44 例评估了 PD-L1 表达。虽然 HRD 组的 PD-L1 表达往往高于非 HRD 组,但在整个患者群体或 MSI-L/MSS 亚组中差异并不显著(图 2e)。
基于HRD状态的一线化疗人口统计学分析
在 160 例患者中,89 例患有不可切除的转移性疾病(图 1)。71 例患者接受了一线化疗,其中 46 例接受铂类化疗(铂类治疗队列),25 例未接受铂类化疗(非铂类治疗队列)。关于转移性病变,铂类治疗队列中有 37 例患者、非铂类治疗队列中有 13 例患者具有 RECIST ver.1.1 定义的可测量病灶。在铂类治疗队列中,HRD 组中肉眼 3 型或 4 型肿瘤比例显著低于非 HRD 组(22.2% vs. 60.7%,P = 0.016)。HRD 组中接受铂类药物+氟尿嘧啶+紫杉烷治疗的患者比例显著低于非 HRD 组(0% vs. 2.8%,P = 0.015)。在任一队列中,两组在铂类药物的选择、靶向治疗的给药或其他治疗人口统计学方面均无显著差异。
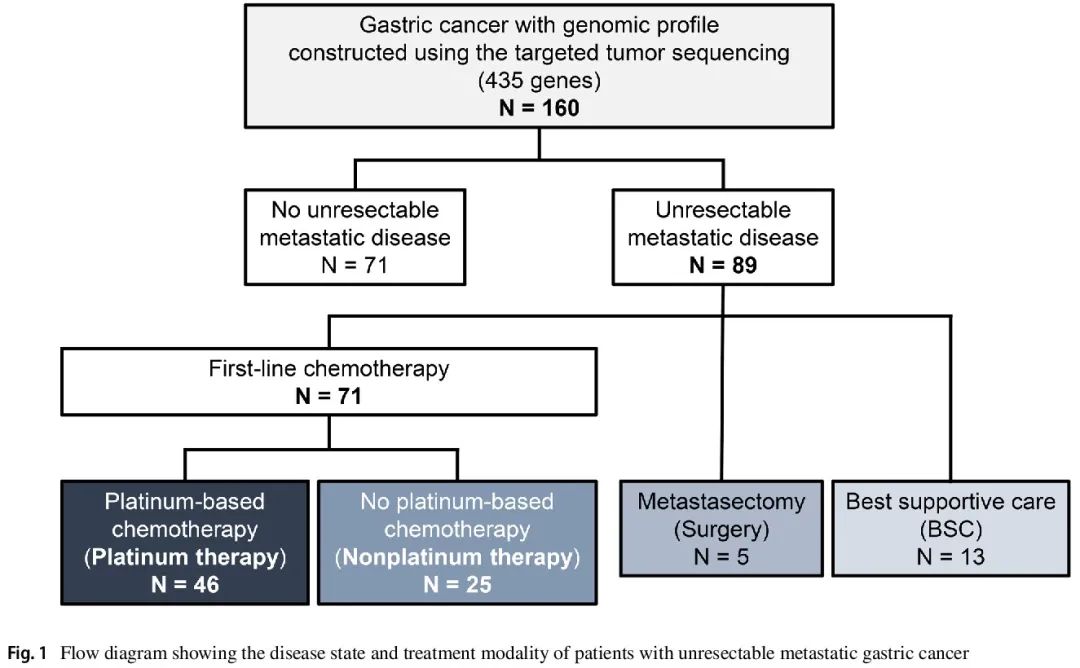
图1
基于HRD状态的对一线化疗的反应
我们评估了 71 例不可切除转移性 GC 患者对一线化疗的治疗反应(表 2)。在铂类治疗队列中,没有患者达到完全缓解 (CR)。HRD 组和非 HRD 组达到部分缓解 (PR) 的患者比例分别为 44.4% 和 14.3%。HRD 组 11.1% 的患者和非 HRD 组 46.4% 的患者确认为疾病进展 (PD)。铂类治疗队列中两组的最佳总体反应 (BOR) 特征不同(P = 0.032)。HRD 组的客观缓解 (OR)(44.4% vs. 14.3%,P=0.038)和疾病控制 (DC) 率(88.9% vs. 53.6%,P=0.022)显著高于非 HRD 组。另一方面,非铂类治疗队列中 HRD 组和非 HRD 组的 BOR、OR 或 DC 率没有显著差异。瀑布图分别显示了铂类治疗(N=37)和非铂类治疗队列(N=13)中具有可测量病灶的患者的肿瘤大小相对于基线的最大变化(图 3a)。在铂类治疗队列中,HR 基因变异的患者在一线化疗后肿瘤显著缩小;非铂类治疗队列的瀑布图显示 HR 基因变异患者的肿瘤缩小有限。
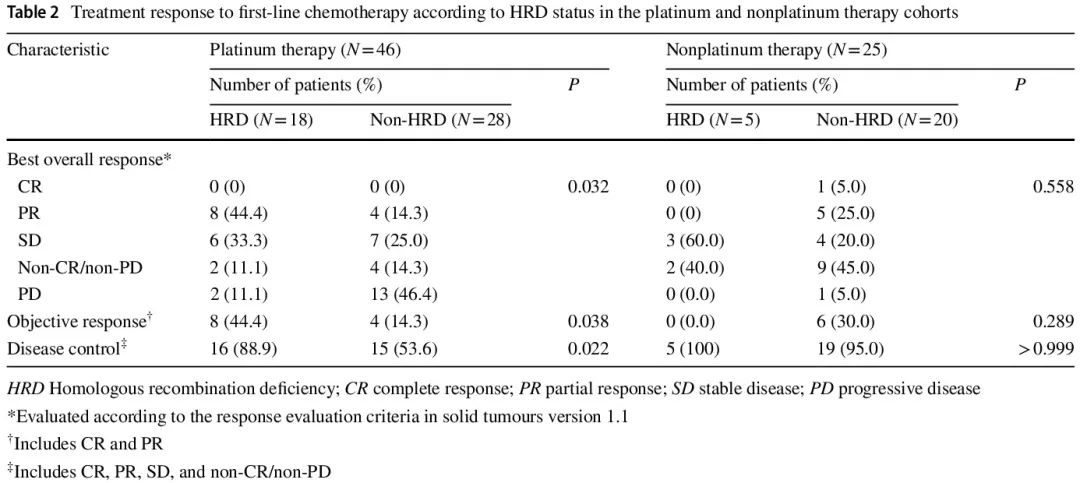
表2
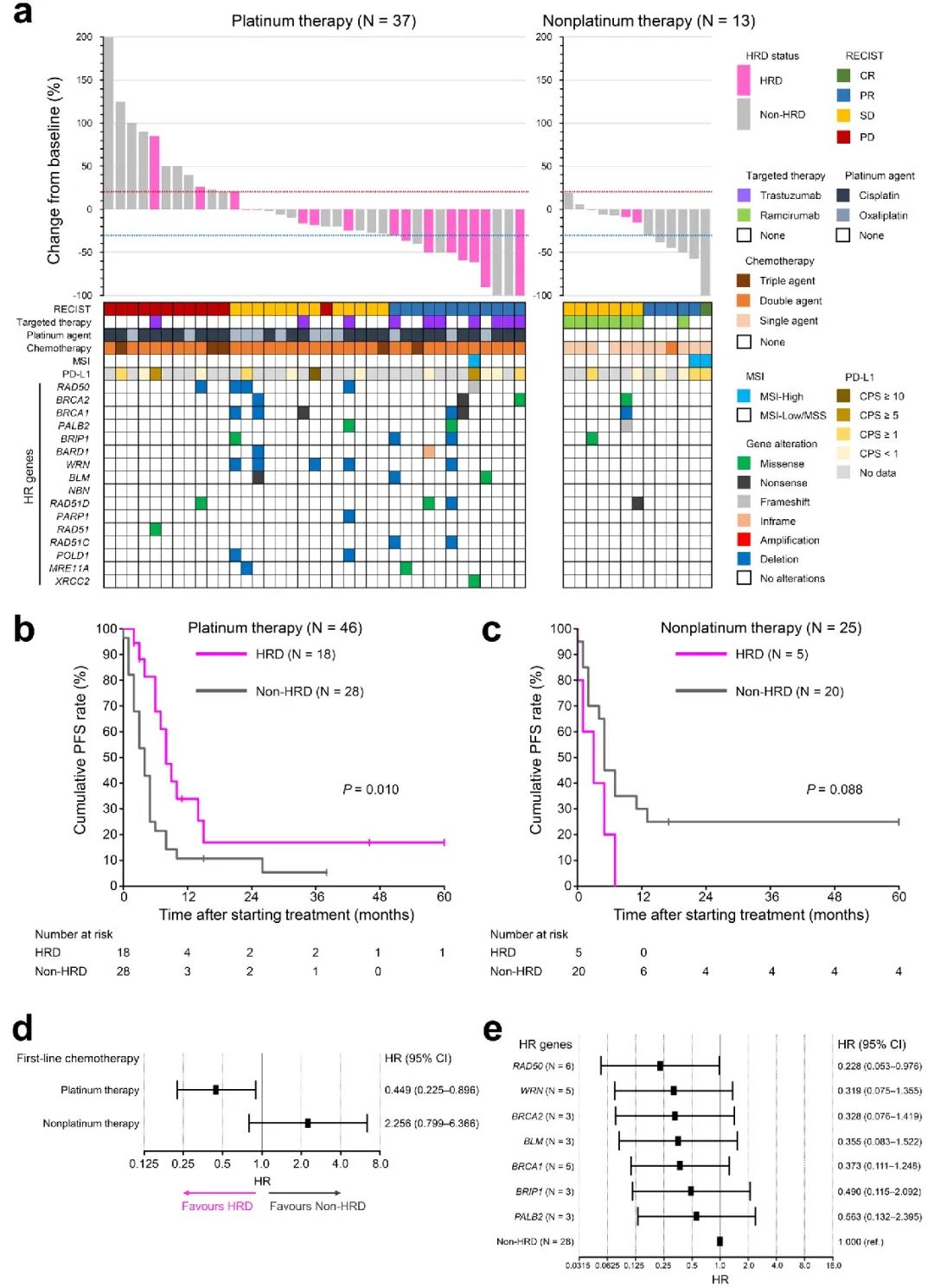

图3
开始一线化疗后的预后
在接受一线化疗的 71 例患者中,开始一线化疗后的中位随访时间为 16 个月。铂类和非铂类治疗队列的中位无进展生存期 (PFS) 分别为 5.0 个月和 5.0 个月。在铂类治疗队列中(图 3b 和 d),HRD 组的 PFS 显著长于非 HRD 组(中位 8.0 个月 vs. 3.0 个月,P = 0.010),单变量 HR 为 0.449(95% CI 0.225–0.896)。非铂类治疗队列中两组的 PFS 无显著差异(图 3c 和 d)。在铂类治疗队列中,各 HR 基因变异患者的单变量 PFS HR 如图 3e所示。与非 HRD 组相比,RAD 50 具有最有利的预后影响,HR 最低,为 0.228(95% CI 0.053–0.976)。单变量生存分析显示,铂类治疗队列中的潜在混杂因素包括肉眼类型、既往胃切除术、淋巴结转移、腹膜转移、化疗方案和靶向治疗,而非铂类治疗队列中的潜在混杂因素包括肿瘤分化、转移部位数量、化疗方案和靶向治疗(表 3)。PFS 多变量生存分析结果详见表 4。在铂类治疗队列中,调整 6 个混杂因素的 HR 后,HRD 与较好的 PFS 独立相关(调整后的 HR = 0.337,95% CI 0.151–0.753)。在非铂类治疗队列中,HRD 状态与 PFS 无关(调整后的 HR = 2.418,95% CI 0.688–8.493)。
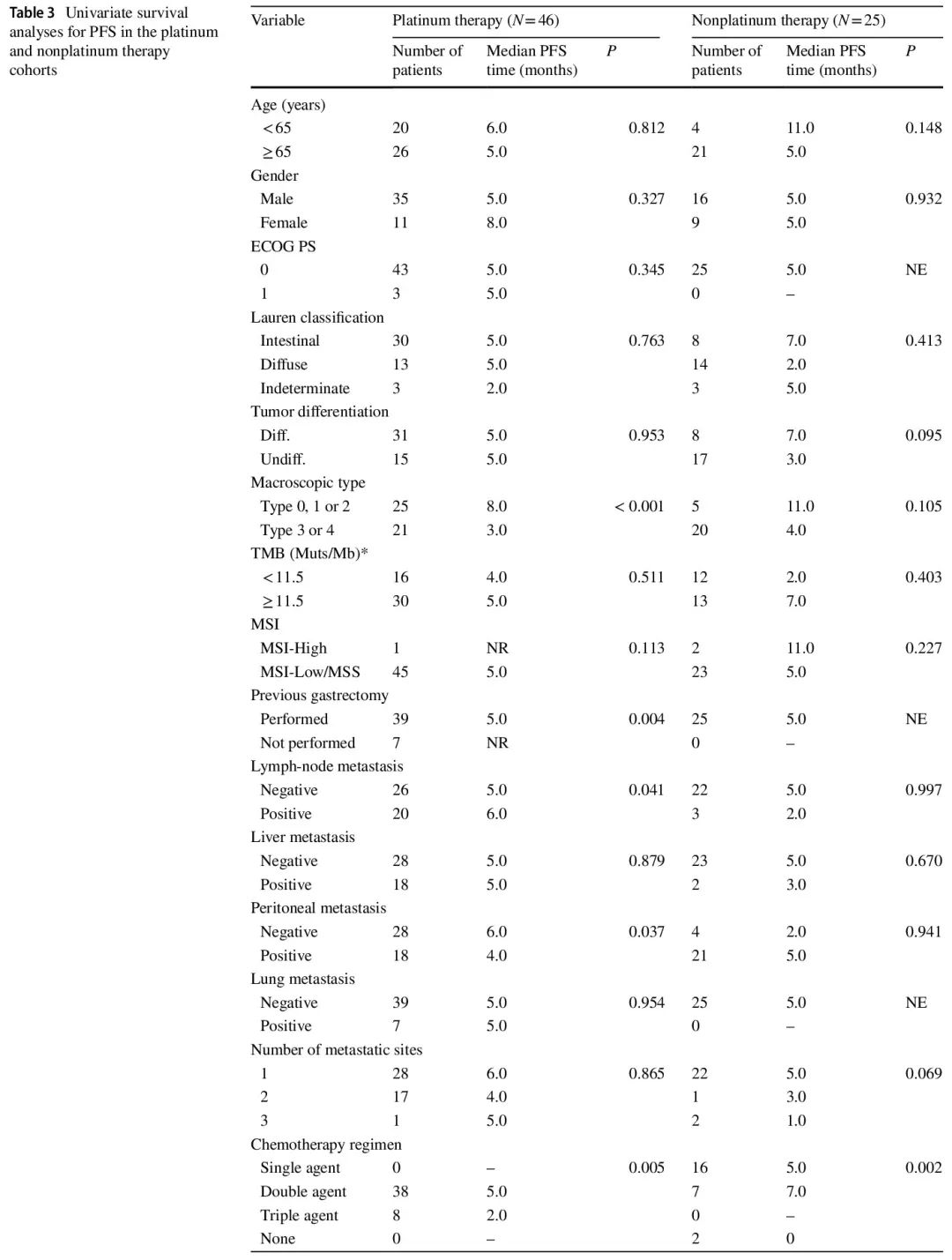
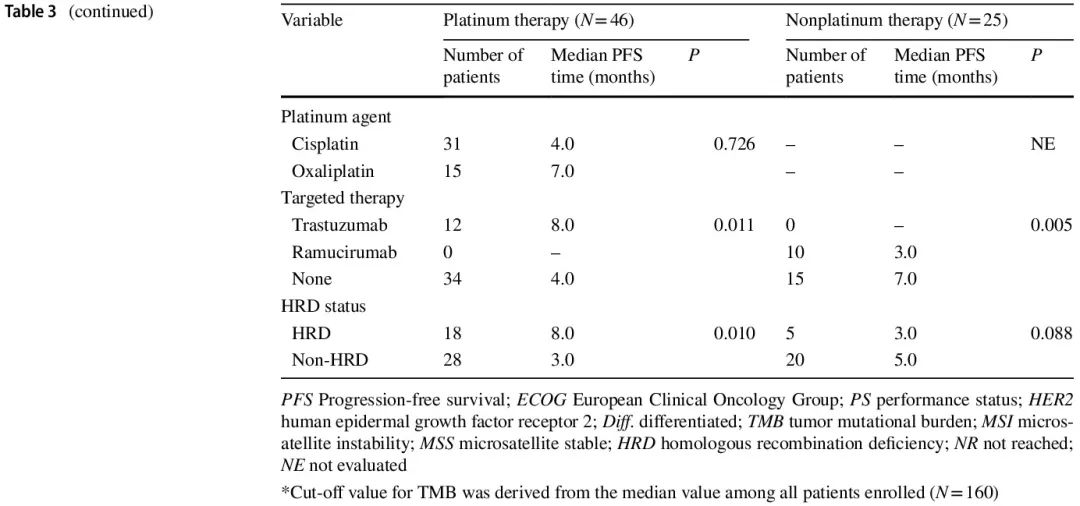
表3
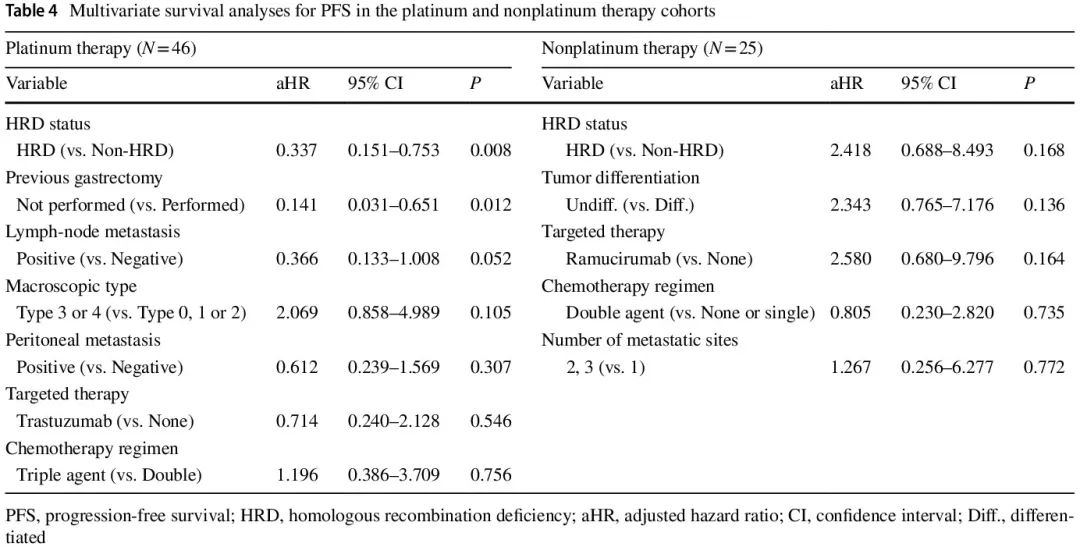
表4
铂类和非铂类治疗队列的中位总生存期 (OS) 分别为 13 个月和 21 个月。在铂类治疗队列中,HRD 组的 OS 显著优于非 HRD 组(中位 28.0 个月 vs. 13.0 个月,P = 0.009),单变量 HR 为 0.405(95% CI 0.200–0.823)。非铂类治疗队列中两组的 OS 没有显著差异。在铂类治疗队列中,调整 HR 后,HRD 与较好的 OS 独立相关(调整后的 HR = 0.343,95% CI 0.151–0.775)。在非铂类治疗队列中,HRD 状态与 OS 无关(调整后的 HR = 1.412,95% CI 0.470–4.240)。
讨 论
GC 是 HR 基因致病变异发生率第二高的癌症,仅次于卵巢癌。HR 基因与癌症易感性有关。对 HR 基因胚系致病变异和幽门螺杆菌感染协同增加 GC 风险的认识,使研究人员关注 HRD 作为 GC 的重要分子特征。在此,我们全面回顾了 HR 基因变异。此外,我们回顾性评估了不可切除转移性 GC 中 HRD 状态与一线化疗结果的相关性。我们阐明了由 HR 基因变异引起的 HRD 对接受铂类一线化疗的不可切除转移性 GC 患者(而非接受替代化疗的患者)有利结果的潜在贡献。本研究结果表明,HRD 或可作为不可切除转移性 GC 一线铂类化疗结果的预测性标志物。尽管本研究的患者数量较少,但我们首次尝试通过多变量分析调整混杂变量的预后影响,将 HRD 描述为预测标志物。本研究结果表明,在癌症基因组医学时代,肿瘤基因检测可能在不可切除转移性 GC 的初始治疗开始时具有相当大的价值。
参与 HR 通路的基因定义不明确。本研究根据先前的报道,将 BARD1、BLM、BRCA1、BRCA2、BRIP1、MRE11A、NBN、PALB2、PARP1、POLD1、RAD50、RAD51、RAD51C、RAD51D、WRN 和 XRCC2 定义为 HR 基因。BARD1、BLM、BRCA1/2、PALB2 和 RAD 蛋白是 HR 的核心成分,可修复 DNA 双链断裂。尽管 DNA 损伤反应基因(如 ATM、ATR 和 CHEK1/2)也参与 HR 通路,但在本研究中我们并未考虑这些基因的改变会导致 HRD。最近的一项大规模基因组研究表明,DNA 损伤反应基因改变通过独立于 HR 通路核心成分的机制导致基因组不稳定性。除了功能丧失突变和深度缺失的拷贝数变异 (CNA) 外,HR 基因的表观遗传沉默是导致胃肠道癌症 HRD 的另一种机制。HRD 评分定义为三个单独指标的未加权数值总和,即大片段迁移 (LST)、杂合性缺失 (LOH) 和端粒等位基因失衡,是对 HRD 的综合评估。HRD 评分在预测乳腺癌和卵巢癌对铂类化疗的反应方面已被证明是有用的。Myriad Genetics, Inc. 设计的 MyChoice CDx 可同时识别 BRCA1/2 突变并量化 HRD 评分,可作为卵巢癌中聚(ADP-核糖)聚合酶 (PARP) 抑制剂的伴随诊断检测。后续研究应致力于阐明 HRD 评分在不可切除转移性 GC 管理中的临床意义。
先前的卵巢癌和乳腺癌研究表明,携带 HRD 的肿瘤表现出独特的临床病理学特征。Alsop 等人报道,BRCA1/2 突变的卵巢癌与浆液性组织学和较高的肿瘤分级显著相关。乳腺癌中三阴性亚型的 HRD 评分显著高于luminal和 HER2 亚型。本研究发现 HRD 状态与 GC 肉眼类型之间存在关联。HRD 组中 3 型或 4 型肿瘤患者的比例显著低于非 HRD 组。目前还没有大规模的基因组分析探索过 GC 的肉眼类型和分子谱之间的关系。多项证据表明 GC 患者中肉眼类型与OS相关,3 型和 4 型 GC 的预后尤其不佳。在我们的生存分析中,始终观察到 3 型和 4 型肿瘤患者的 PFS 和 OS 不佳。JCOG0501 试验旨在评估这些肉眼类型中顺铂和 S-1 术前化疗的疗效。该研究未能证明术前化疗的有效性。一般来说,表现出 HRD 的肿瘤对铂类药物的敏感性增强;因此,以铂类为基础的术前化疗可能对 HRD 发生率低的 3 型和 4 型肿瘤缺乏疗效,因此对预后改善的贡献有限。
一项利用大规模基因组数据的综合研究揭示了多种癌症中 HRD 与较高 TMB 之间的关联。在本研究中,HRD GC 患者的 TMB 显著高于没有 HRD 的患者。Cerniglia 等人报道,HR 和其他 DNA 损伤反应基因发生改变的胃食管癌比没有改变的胃食管癌具有更高的 TMB,支持了我们研究的结果。有研究表明,HRD 诱导基因组不稳定性,有助于增强肿瘤免疫原性并改善对 ICB 的反应,尽管这些发现仍然存在争议。本研究未发现 HRD 状态与 PD-L1 表达之间有显著关联,尽管样本量较少。据报道,BRCA 1/2 突变相关乳腺癌中HRD 会导致突变和新抗原负荷增加,但免疫原性降低。关于 HRD 在 ICB 有效性中的作用的临床证据不足。在卵巢癌中,未发现 HRD 状态与 ICB单药或联合化疗的疗效相关。一项最新研究整合了全基因组和单细胞 RNA 测序,揭示了卵巢癌中独特的免疫刺激和免疫抑制机制,这些机制与的解剖疾病部位和突变过程相关,具体取决于 HRD 状态。需要进行广泛的研究来阐明 HRD 与肿瘤免疫微环境和 ICB 的有效性之间的关系,以及其对 GC 的影响。
GC 中 HR 基因变异的发生率相对较高,这引起了人们对 HRD 在 GC 中的临床意义的关注。然而,一项基于 MSK-IMPACT 基因组分析的研究表明,在胃食管腺癌 (GEA) 中,基于 LST 的 HRD 与铂类化疗的疗效无关。最近,Petrelli 等人表明,BRCA2 和其他 HR 基因的失活变异与 GEA 铂类化疗后的 PFS 较长有关。Prosz 等人分析了三个独立的 GEA 患者队列以及体外实验,发现 HRD 与铂类化疗后的较好预后显著相关。尽管关于 HRD 与 GC 铂类药物疗效之间关联的证据不断涌现,但全面的研究仍然有限,尤其是关于其临床意义的研究。先前研究中的大多数受试者是 GEA 患者,这种疾病在西方国家更为普遍,与亚洲国家不同。此外,先前的研究尚未彻底探索接受非铂类化疗的患者的 HRD 状态与治疗结果之间的关系,因此尚不清楚 HRD 是铂类化疗疗效的预后因素还是预测指标。在我们的研究中,大多数肿瘤位于胃部,反映了亚洲国家的普遍性。我们证明了在接受一线铂类化疗的患者中,HRD 与良好的治疗反应之间存在显著关联,而在接受不同化疗的患者中,这种关联并不显著。因此,正如本研究和先前的研究所证明的那样,HRD 状态或可作为不可切除转移性 GC 患者对铂类化疗反应的预测指标,无论地理位置如何。
在本研究分析的 16 个 HR 基因中,RAD50 是变异发生率最高的基因。在不可切除转移性 GC 中,RAD50 变异对一线铂类化疗的 PFS 具有最有利的预后影响。此外,我们使用 TCGA 数据集评估了 GC 中的 RAD50 变异,包括突变、拷贝数和 mRNA 表达谱。与我们的研究结果类似,缺失和截断突变(包括移码突变和无义突变)是 TCGA GC 中的主要 RAD50 变异。此外,我们证实,RAD50 缺失或截断突变的肿瘤的 mRNA 表达显著低于没有 RAD50 变异的肿瘤。这些基因变异可能导致 RAD50 功能缺陷,从而可能导致 HRD。先前对卵巢癌的研究表明,RAD50 缺失是 BRCAness(具有 HRD 表型的 BRCA1/2 野生型肿瘤) 的预测标志物,并且与较好的 OS 显著相关,这支持了我们的发现。
在本研究中,与非 HRD 组相比,MSI-H GC 在 HRD 组中更为普遍。在 MSI-H GC 中观察到的 HR 基因移码突变可能归因于错配修复缺陷 (MMRD)。之前,我们证明了 ACVR2A 移码突变在 MSI-H GC 中经常观察到,并且 GC 细胞中 ACVR2A 功能障碍导致侵袭性较低的肿瘤生物学。因此,MSI-H GC 中 HR 基因移码突变可能导致 HRD。然而,此前有报道称,在 GC 和结直肠癌中,HRD 和 MMRD 可能相互排斥。MSI-H GC 中这些突变对 HRD 的影响必须通过特定分析进行验证,例如 HRD 评分和 RAD51 检测,这些仍是未来研究的主题。
在癌症基因组医学时代,HRD 是具有临床价值的 GC 分子特征,因为它不仅有助于铂类药物,还有助于 ICB 的高效治疗。与铂类药物一样,ICB 药物在不可切除转移性 GC 标准一线治疗中很关键,无论 HER2 状态如何。最近的几项研究证实了转化疗法(不可切除转移性 GC 中化疗后目标为 R0 的切除术)的生存获益。携带 HRD 的不可切除转移性 GC 可能是转化疗法的极佳候选者,因为目前一线疗法的疗效很高。PARP 抑制剂是治疗携带 HRD 的恶性肿瘤的有吸引力的药物。抑制 PARP1 和 PARP2 的奥拉帕利已获批用于治疗携带 HRD 的乳腺癌、胰腺癌、前列腺癌和卵巢癌。一项 III 期临床试验未显示奥拉帕利对总体和 ATM IHC 阴性的不可切除转移性 GC 的预后效果。然而,有研究表明,如果患者有合适的生物标志物,奥拉帕利可能有效。实验研究表明,PARP 抑制剂对 HRD 阳性和胚系 BRCA2 突变的 GC 有效。目前正在进行临床试验,评估各种 PARP 抑制剂对 GC 的疗效。预计未来的临床研究将阐明 HRD 在不可切除转移性 GC 治疗中的临床意义。
本研究有三个主要局限性。首先,我们无法确定所识别的 HR 基因变异是体细胞还是胚系变异。此外,我们研究中的基因组测序数据缺乏关于所识别的变异是否伴有双等位基因突变或野生型等位基因 LOH 的信息。携带双等位基因缺失的 BRCA1/2 胚系变异的肿瘤的 HRD 评分显著高于没有双等位基因缺失的肿瘤。利用体细胞和胚系基因组测序的更全面研究将揭示 GC 中 HR 基因变异对 HRD 程度的影响。其次,在有限数量的患者中回顾性评估了 HRD 与一线化疗治疗效果之间的相关性。尽管治疗人口统计学的异质性和潜在的选择偏差是不可避免的,但至少我们研究中的铂类治疗队列很可能反映了总体该疾病人群。铂类治疗队列的中位 PFS 和 OS(分别为 5.0 个月和 13.0 个月)与之前的 III 期研究相当,该研究比较了奥沙利铂加 S-1 与顺铂加 S-1 作为不可切除转移性 GC 的一线化疗。第三,由于 2009 年至 2019 年期间获得的 GC 样本的回顾性性质,我们无法评估 HRD 状态与当前标准一线铂类化疗联合 ICB 治疗反应之间的关联。尽管如此,我们相信,在癌症基因组医学时代,这项探索性研究的结果将对未来的 GC 治疗策略产生影响。
总之,肿瘤基因检测显示,29.4% 的 GC 患者携带导致 HRD 的 HR 基因变异。较低比例的肉眼 3 型或 4 型肿瘤和较高的 TMB 是HRD GC 的独特特征。HRD 状态可能成为不可切除转移性 GC 一线铂类化疗结果的预测指标。值得开展大规模验证研究评估 HRD 状态的临床效用,推进 GC 精准医疗的发展。
参考文献:
Ichikawa H, Aizawa M, Kano Y, Hanyu T, Muneoka Y, Hiroi S, Ueki H, Moro K, Hirose Y, Miura K, Shimada Y, Sakata J, Yabusaki H, Nakagawa S, Kawasaki T, Okuda S, Wakai T. Landscape of homologous recombination deficiency in gastric cancer and clinical implications for first-line chemotherapy. Gastric Cancer. 2024 Aug 7. doi: 10.1007/s10120-024-01542-1. Epub ahead of print. PMID: 39110344.



