最新!多囊卵巢综合征高雄激素血症的研究进展
时间:2024-09-26 23:03:44 热度:37.1℃ 作者:网络
多囊卵巢综合征(PCOS)是育龄期妇女最常见的生殖内分泌疾病,影响女性生育能力、代谢水平、心血管系统等多方面;但由于其异质性及发生机制的复杂性,目前临床上多为针对其症状的临时和不完善的治疗,难以达到令人满意的效果。高雄激素血症(HA)是PCOS的主要临床表现和核心生化指征之一,本文主要总结近年来关于PCOS-HA相关发生机制及有效治疗的研究进展,为PCOS-HA的临床干预提供更多参考和思路。
多囊卵巢综合征(PCOS)是以临床和/或生化性高雄激素血症(HA)、月经失调和卵巢多囊样表现为主要特征的内分泌疾病。全球6%~20%的育龄期妇女深受其困扰,高雄激素妇女的患病率高达89%。PCOS及其相关特征的家族聚集性,提示了其具有遗传性。由于其病因和机制的复杂性,目前尚无统一的诊断标准,但无论何种标准,HA都是PCOS诊断的关键因素。
鉴于PCOS是一个影响女性身心健康、造成社会和经济负担的全球性问题,且存在许多并发症,而目前可用的治疗方法并不是完全有效且没有副作用的,因此有必要研究其发病机制并寻找新的治疗靶点。
一、HA的诊断
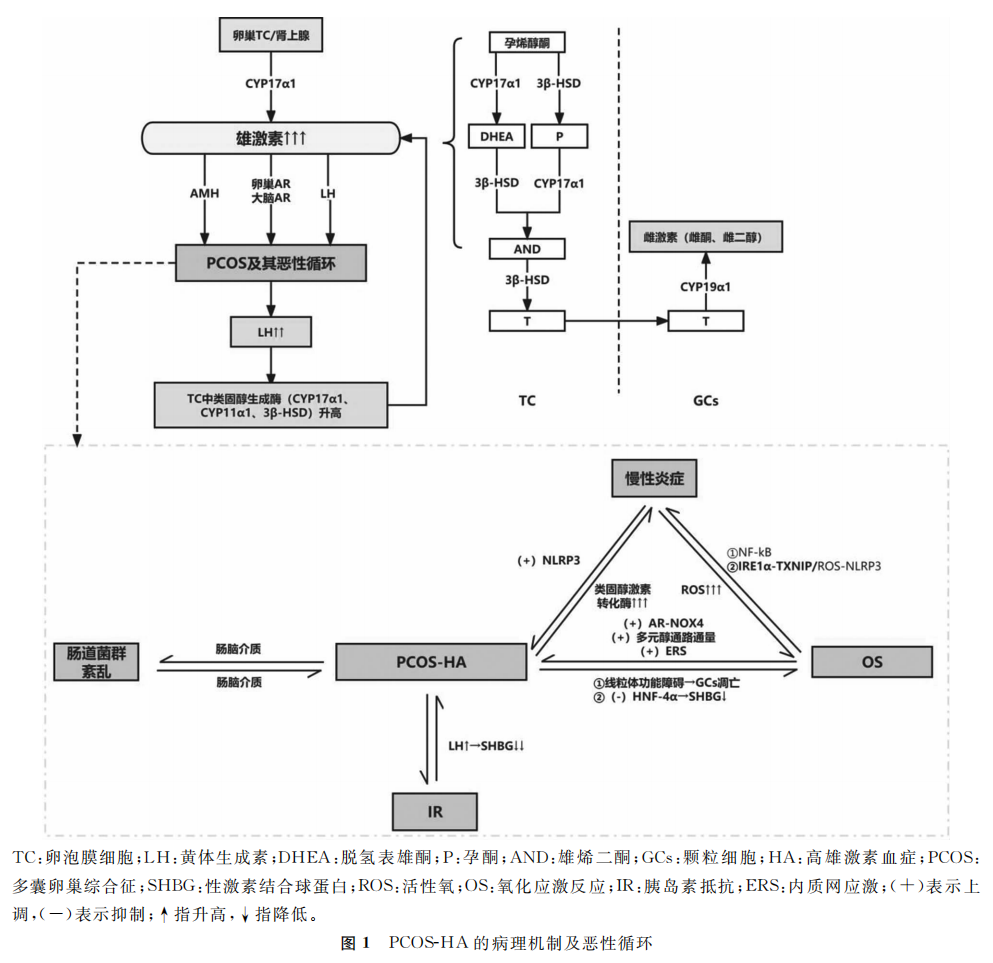
雄激素是类固醇激素家族的一部分,雄激素过多是PCOS的主要临床表现之一。雄激素包括睾酮(T)、二氢睾酮(DHT)、雄烯二酮(AND)、脱氢表雄酮(DHEA)和硫酸脱氢表雄酮(DHEAS)。AND、DHEA和DHEAS都是DHT和T的前体,T和DHT直接与雄激素受体(AR)相互作用。女性雄激素的主要来源是卵巢和肾上腺。类固醇生成酶调节雄激素的合成,雌激素合成酶催化雄激素(AND和T)转化为雌激素(雌酮和雌二醇)。各种因素共同作用,调节血清雄激素水平。
HA的特点是血液循环中总睾酮(TT)、游离睾酮(FT)、AND水平和游离雄激素指数(FAI)升高。受检测条件的影响,目前临床上多以性激素六项中TT作为诊断标准,而PCOS患者的高雄状态多由性激素结合球蛋白(SHBG)合成障碍导致,因此以TT单独作为诊断指标漏诊率较高。而AND、FAI的阳性诊断率显著高于TT,一致性较差,建议将AND和FAI联合拟作诊断“金标准”并拟定TT最佳诊断界值为1.43 nmol/L。
二、HA是PCOS的关键因素
许多证据表明HA在PCOS中起着至关重要的作用。虽然PCOS的临床症状存在异质性,但是多毛症、痤疮、体重增加、腹部和皮下脂肪增多、雄激素性脱发等影响患者身心健康的PCOS相关症状都是由HA导致的。同时,HA对PCOS患者的代谢稳态具有有害影响,其可以作用于不同的代谢组织,如脂肪组织、肝脏、肌肉和胰腺以及大脑。
从卵泡发育和性激素水平来看,一方面,PCOS患者卵巢周期及卵泡发育的紊乱可能受到抗苗勒管激素(AMH)水平升高的显著影响。卵巢卵泡膜细胞(TC)过度合成的雄激素诱导颗粒细胞分泌更多的AMH。另一方面,HA降低了促性腺下丘脑细胞对雌二醇和孕酮(P)的敏感性,导致促性腺激素释放激素(GnRH)和LH水平升高,加速窦前卵泡和小窦卵泡的生成,导致卵泡发育障碍。
三、PCOS的发生发展
及症状的存在依赖于HA
HA会诱导PCOS患者发生一系列病理生理变化,除了下丘脑-垂体-卵巢轴(HPO轴)功能异常导致的神经内分泌变化外,还包括氧化应激(OS)、内质网应激(ERS)、慢性炎症、卵巢纤维化、胰岛素抵抗(IR)及肠道菌群失调等。
1. PCOS患者的HA与OS、慢性炎症:OS和慢性炎症在PCOS-HA中经常共存且相互转化,共同诱导雄激素过度分泌。
(1)OS通过抑制SHBG及影响线粒体功能来诱导雄激素过度分泌。OS即体内活性氧(ROS)水平超过抗氧化酶和抗氧化剂的保护能力,导致氧化与抗氧化作用失衡的状态。PCOS患者体内总氧化能力与总抗氧化能力的比值和OS指数均较正常人高。这说明PCOS处于OS状态。
在体外实验中,氧化低密度脂蛋白(ox-LDL)和氧化高密度脂蛋白(ox-HDL)处理后SHBG浓度、SHBG及肝细胞核因子-4α(HNF-4α)的mRNA水平以及HNF-4α的蛋白水平较对照组显著降低,这证明了OS可能通过下调HNF-4α抑制SHBG的表达和分泌,促进PCOS-HA的发生。线粒体是产生超氧自由基的主要部位,可缓冲ROS的氧化作用。然而,过量的ROS会改变线粒体膜通透性,引起线粒体肿胀、破裂,导致线粒体功能障碍,促进卵巢颗粒细胞凋亡,影响雄激素的转化与合成,导致雄激素水平升高。
(2)HA可能诱导OS的发生发展。体外实验证明高水平的T通过AR-NADPH氧化酶4(NOX4)信号通路引起线粒体功能障碍和ROS水平增加。此外,高水平的雄激素还可以诱导卵巢醛糖还原酶的表达,导致多元醇通路通量增加,进而通过OS影响卵巢功能。
目前,慢性炎症反应被认为是PCOS发病的主要原因,但其机制尚未明确。研究证明T处理的小鼠模型血清白介素6(IL-6)和IL-1β及核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体过度表达,进一步实验证明NLRP3过表达显著增强了细胞色素P19α1CYP19α1)、CYP11α1和FSH受体(FSHR)在蛋白质和mRNA水平上的表达,卵巢细胞中纤维化因子如转化生长因子β(TGF-β)、结缔组织生长因子(CTGF)的表达也显著增加。
而抑制NLRP3的表达后,DHT处理的颗粒细胞在蛋白质水平上表现出NLRP3、TGF-β、CTGF显著降低。这些证据共同证明了高雄激素刺激卵巢中的慢性低度炎症以激活NLRP3,进一步诱导卵巢颗粒细胞凋亡和卵巢纤维化。据报道,各种炎症因子也可以引发卵巢分泌过量雄激素或抑制雄激素的转化。转录组测序技术分析结果也提示,PCOS与对照组队列比较,其血清T和AND水平显著上调。
在PCOS妇女中,炎症标记物的增加与OS呈正相关,这证明了炎症反应与OS密切相关。高水平的ROS增强促炎基因的表达,导致肿瘤坏死因子-α(TNF-α)水平升高和核转录因子-κB(NF-κB)等多种通路的激活,促进炎症细胞的聚集,炎症细胞释放大量ROS,ROS导致OS,进一步加剧氧化反应,形成恶性循环。
此外,高雄激素通过诱导ERS来促进ROS的产生,激活肌醇需求酶1α(IRE1α)-硫氧还蛋白相互作用蛋白(TXNIP)/ROS-NLRP3信号通路,并促进NLRP3炎症小体的激活,进而导致颗粒细胞功能障碍和卵泡发育障碍。同时,OS和炎症反应共同作用又可增强类固醇激素转化酶的活性促进雄激素的产生。可见,ERS、炎症和OS在PCOS患者的卵泡微环境中形成了一个恶性循环,抑制OS及慢性炎症可能是改善PCOS-HA的关键一环。
2. PCOS患者的HA与IR:在PCOS的病理环境下,IR和HA可以形成一个相互刺激的恶性循环。之前的一项孟德尔随机化研究报告了空腹胰岛素增加与SHBG水平降低和生物可利用T水平升高之间存在因果关系。胎儿在子宫内或出生后不久的雄激素过度暴露已被证明会加重内脏肥胖和IR,诱导成年女性出现PCOS样表型。IR导致血清胰岛素水平升高,进而引起HPO轴功能失衡,刺激LH过度分泌,使LH水平失去周期性且峰值消失、LH/FSH比例失调,促使卵巢TC及肾上腺合成分泌雄激素,并抑制肝脏中SHBG的合成,导致FT水平升高,共同形成HA。因此,干预IR在改善PCOS-HA生殖及代谢方面起到至关重要的作用。
3. PCOS患者的HA与肠道微生物紊乱:肠道菌群失调可能会影响性激素水平、卵泡发育的调节,诱导IR,促进PCOS的发生发展。一项前瞻性研究结果提示包括克雷伯氏菌属在内的14个菌属在PCOS患者中占优势,而包括瘤胃球菌属、普雷沃特菌属在内的4个菌属在健康对照组中占优势;血清FT和AND水平与巨单胞菌呈正相关,而TT水平与另枝杆菌呈负相关。这证明,PCOS患者的肠道菌群组成结构与对照组相比存在明显改变,且这与血清T水平存在一定相关性。
另一项研究证明PCOS患者,尤其是肥胖个体,通常有IR和应激相关的FKBP5 DNA甲基化水平降低,这两种病理状态可能导致肠道微生物多样性的下降;同时,FKBP5是AR的正调节因子,较低的FKBP5 DNA甲基化水平将导致FKBP5蛋白表达的升高和雄激素活性的增加,而FKBP5-NF-κ B信号介导炎症反应,诱导PCOS患者HA和慢性低度炎症反应的发生。应激相关指数、FKBP5 DNA甲基化水平和PCOS相关表型及肠道菌群之间的密切联系可能为PCOS的治疗提供新的靶点。
四、雄激素相关基因的异常表达
CYP17α1介导孕烯醇酮合成17-羟孕酮(17-OHP),进而转化为DHEA,DHEA通过3β-脱氢酶(3β-HSD)转化为AND。另一方面,3β-HSD还可以介导孕烯醇酮转化为P,进而通过CYP17α1转化为AND。17-HSD主要在卵巢中表达,是催化T合成最后阶段的关键酶。
TC是卵巢中产生雄激素的场所,卵巢中LH通过cAMP-PKA和PI3K-Akt通路上调TC中类固醇生成酶的表达(如CYP17α1、CYP11α1和3β-HSD),增加雄激素的合成。CYP19α1基因编码的细胞色素P450芳香化酶(P450arom)是雌激素合成的限速酶。雄激素从TC转移到颗粒细胞,并在P450arom的作用下转化为雌激素。较高的雄激素水平导致P450arom的表达下调,减少雄激素的转化,雄激素累积,形成恶性循环。
研究发现,PCOS小鼠卵巢CYP17α1、CYP11α1蛋白表达水平较对照组显著升高,而CYP19α1蛋白表达水平显著降低。以上结果说明在PCOS患者中,雄激素合成能力的增强和转化能力的降低,共同导致雄激素水平升高。有研究显示,调节参与胆固醇合成相关基因的转录因子SREBF1和调节类固醇生成酶(CYP17α1、CYP11α1)基因表达的锌指转录因子6(GATA6),在驱动PCOS患者卵巢TC分子信号中起主要作用。这确定了PCOS-HA治疗的另一个潜在靶点。
除此之外,肾上腺功能异常也是导致HA的机制之一。30%~50%的PCOS患者具有肾上腺源雄激素过多。而且,具有肾上腺功能早现(PA)病史的患者相较于对照组更倾向于表现出PCOS症状,如多毛和痤疮的患病率增加。PA并不是一个独立的疾病,而是一系列事件中的一个阶段,最终导致儿童期的高胰岛素血症和成年期的HA、PCOS和代谢综合征。由此可见,对于早期肾上腺雄激素过多,且出现阴毛、腋毛生长的儿童应尽早查明原因并及时干预,避免病情进展。
PCOS-HA发生的病理机制及与各种病理反应的恶性循环详见图1。
(图1)
五、PCOS-HA的治疗研究新进展
PCOS-HA与IR密切相关,因此患者目前的治疗除了抗雄激素药物(达英-35)外还包括了具有调节胰岛素敏感性和葡萄糖代谢功能的二甲双胍;体育活动和合理的饮食也是目前多数PCOS-HA患者必不可少的干预方法。其中达英-35由2 mg醋酸环丙孕酮和35 μg炔雌醇组成,通过阻断雄激素和激活P受体起作用,研究显示其可有效恢复DHT诱导的PCOS大鼠的生殖功能,且联合二甲双胍治疗可达到调节性激素平衡、改善代谢水平、恢复发情周期和排卵的效果。
然而目前的治疗并不是完全有效且没有副作用的,醋酸环丙孕酮的过量使用存在血栓、脑膜瘤发生风险,且脑膜瘤发生与醋酸环丙孕酮有很强的剂量依赖性。二甲双胍的使用也可能导致明显的胃肠道反应,因此对PCOS-HA治疗方案的创新存在必要性。
1. 肠道菌群的调整:直接或间接调整肠道菌群在改善PCOS症状和体征的临床应用中具有很大前景。乳酸双歧杆菌V9可上调PCOS患者有益肠道菌群,下调疾病相关菌群,有利于降低雄激素水平。
2. 肌-肌醇(MI)和D-手性肌醇(DCI)按比例给药:二甲双胍可能会引起胃肠道副作用,肌醇在治疗PCOS-IR方面是其潜在替代品。然而,目前的证据还不足以使它们作为指南中的标准疗法,因此需要进一步研究。肌醇有9种立体异构体,其中最重要的是MI和DCI。MI在胰岛素刺激下作为第二信使刺激FSH信号传导通路,并减少TC释放雄激素,DCI抑制芳香酶合成并增加雄激素合成,二者通过特定比值改善雄激素水平,继而改善卵巢功能。
较近的一项荟萃分析结果提示,与安慰剂相比,MI治疗在显著降低PCOS患者空腹血糖及体质量指数的同时,也可显著降低FT和TT水平,并显著增加SHBG水平。同时,与二甲双胍治疗相比,MI在大多数结果中表现出非劣效性,且MI组的副作用发生率较低。提示适量的MI治疗PCOS-HA是一种安全有效的治疗方法。
3. 中医治疗:近年来,中医药治疗PCOS-HA的疗效在临床和实验中均得到验证。中药可以消除雄激素诱导的ERS、GCs凋亡及卵巢纤维化,降低PCOS患者DHEA水平,改善PCOS血清T水平。此外,Xu等证明电针改善PCOS大鼠的生殖特征可能是通过减弱雄激素活性来调节脑kisspeptin-GnRH/LH神经回路功能障碍来实现。
综上所述,HA是PCOS发生和进展的关键环节,HA与OS、慢性炎症、IR、肠道菌群紊乱、ERS等病理改变均存在恶性循环,同时受到雄激素相关基因的影响(如图1示)。目前,通过机制研究明确了改善HA的潜在治疗靶点,但接下来仍需在更大样本中进行进一步研究验证,并试图找到在PCOS-HA发生机制中的关键环节加以干预。
文章来源:张苗苗,孙忻.多囊卵巢综合征高雄激素血症的研究进展[J].生殖医学杂志,2024,33(8):1114-1119.


