室管膜瘤?节细胞胶质瘤?RNA测序鉴别EWSR1-PLAGL1重排幕上神经上皮肿瘤
时间:2024-09-30 13:00:23 热度:37.1℃ 作者:网络
最近,PLAGL1 融合或 PLAGL1/PLAGL2 扩增的神经上皮肿瘤经常分别被描述为具有室管膜瘤样或胚胎组织学特征。为了进一步评估具有 PLAG 家族基因变异的新兴实体,本研究描述了圣裘德儿童研究医院遇到的 8 例临床病例(EWSR1-PLAGL1 融合 n = 6;PLAGL1 扩增 n = 1;PLAGL2 扩增 n = 1)的组织学、分子、临床和影像学特征。在具有 EWSR1-PLAGL1 重排的幕上神经上皮肿瘤亚群 (4/6) 中,观察到初始切除样本的组织学特征是同时存在室管膜和神经节分化。这包括室管膜瘤/室管膜下瘤样区域内明显的神经节细胞簇,室管膜样组织中低到中等频率的散在神经节细胞,或具有神经节细胞成分的局灶性区域。如果幕上神经上皮肿瘤内同时出现室管膜样和神经节特征,则可能考虑 EWSR1-PLAGL1 融合,并迅速开始适当的分子检测,如 RNA 测序和甲基化分析。一例 EWSR1-PLAGL1 融合病例在包含横纹肌样/胚胎细胞小簇的区域中显示亚克隆 INI1 缺失,并在复发时具有明显的神经节细胞成分。因此,EWSR1-PLAGL1 神经上皮肿瘤是一种可能发生获得性 SMARCB1 失活和出现非典型畸胎样/横纹肌样瘤(AT/RT)特征,导致临床进展的肿瘤类型。相比之下,PLAGL2 和 PLAGL1 扩增病例表现为胚胎组织学或包含具有显著程度的结蛋白染色的胚胎成分,这也可以引起对 PLAG 实体的考虑。继续积累相关临床数据和组织病理学发现对于了解具有 PLAG 家族基因变异的新兴实体至关重要。
研究背景
PLAG 家族的三个基因分别是位于染色体 6q24 上的 PLAGL1(PLAG 样 1)、位于 8q12 上的 PLAG1 和位于 20q11 上的 PLAGL2,它们编码 C2H2 锌指转录因子,参与细胞周期调控和增殖等各种过程。PLAG1(多形性腺瘤基因 1)重排发生在多形性腺瘤和脂肪母细胞瘤中,最近在一组具有高频室管膜样特征的幕上神经上皮肿瘤中描述了 PLAGL1 重排。在 Sievers 等人的系列研究的 40 个病例中,根据可及的补充细节,2例初始诊断为胶质神经元肿瘤或间变性节细胞胶质瘤。其他关于 EWSR1-PLAGL1 重排CNS肿瘤的报道包括一例具有神经节细胞成分的额叶胶质神经元肿瘤、一例通过回顾性甲基化分析确定的间变性节细胞胶质瘤,以及一例诊断为 INI1 缺陷型非典型畸胎样/横纹肌样瘤(AT/RT)的病例。相比之下,PLAGL1 或 PLAGL2 扩增在由原始胚胎样细胞组成或含有原始胚胎样细胞区域的脑肿瘤中得到描述,这些细胞缺乏强烈的 GFAP 和突触素表达,一部分具有结蛋白染色。PLAG 扩增病例最初是通过与既定组不匹配的甲基化分析识别的,一小部分具有“PLAG 家族扩增的胚胎性肿瘤”甲基化谱的肿瘤实际上缺乏扩增,在极少数情况下,在没有扩增的病例中发现 PLAG1 融合。本研究进一步为一小部分具有 PLAG 家族基因变异的神经上皮肿瘤增加了详细的组织学评估、相关临床结局数据和影像学发现,扩大了组织病理学和临床谱,同时强调了外观和染色特性在评估过程中的效用。
研究结果
临床和影像学特征
圣裘德儿童研究医院遇到 8 例具有 PLAG 家族基因变异的神经上皮肿瘤(EWSR1-PLAGL1 融合 n = 6;PLAGL1 扩增 n = 1;PLAGL2 扩增 n = 1),临床和影像学特征总结于表 1。幕上 PLAGL1 融合病例通过 RNA 测序检出(4 例女性:2 例男性),并具有相应的 PLAGL1 融合神经上皮肿瘤甲基化谱(DKFZ 12.5,表 2),初次诊断时的年龄从 9 个月到 14 岁不等。扩增病例包括一例 2 岁女童小脑肿块检出 PLAGL2 扩增和一例 4 岁男童左颞肿块检出 PLAGL1 扩增。
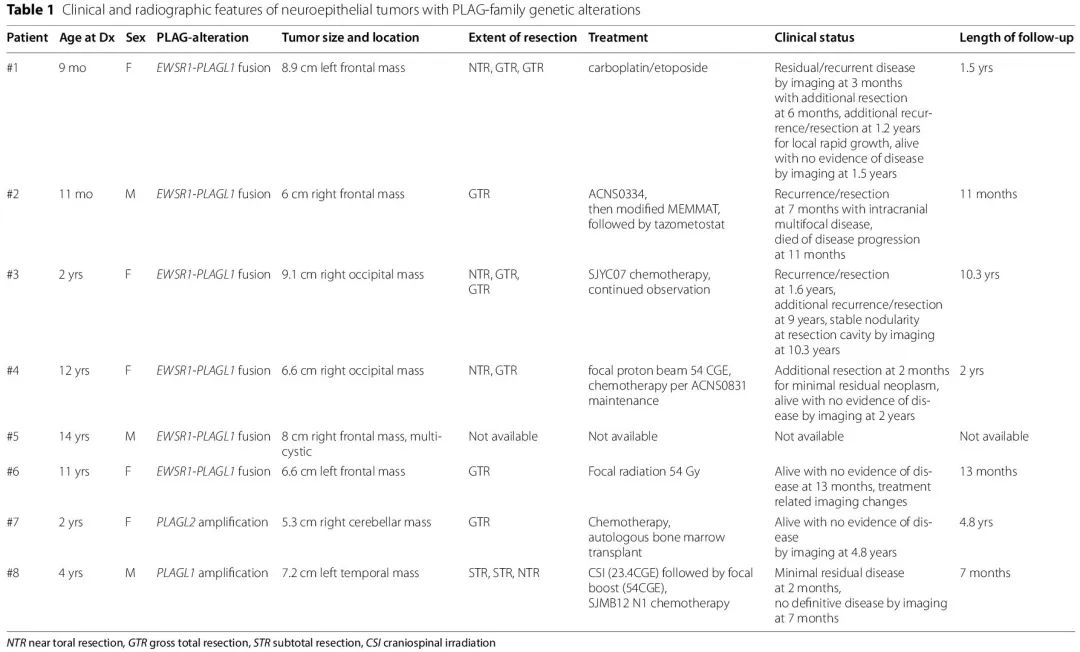
表1
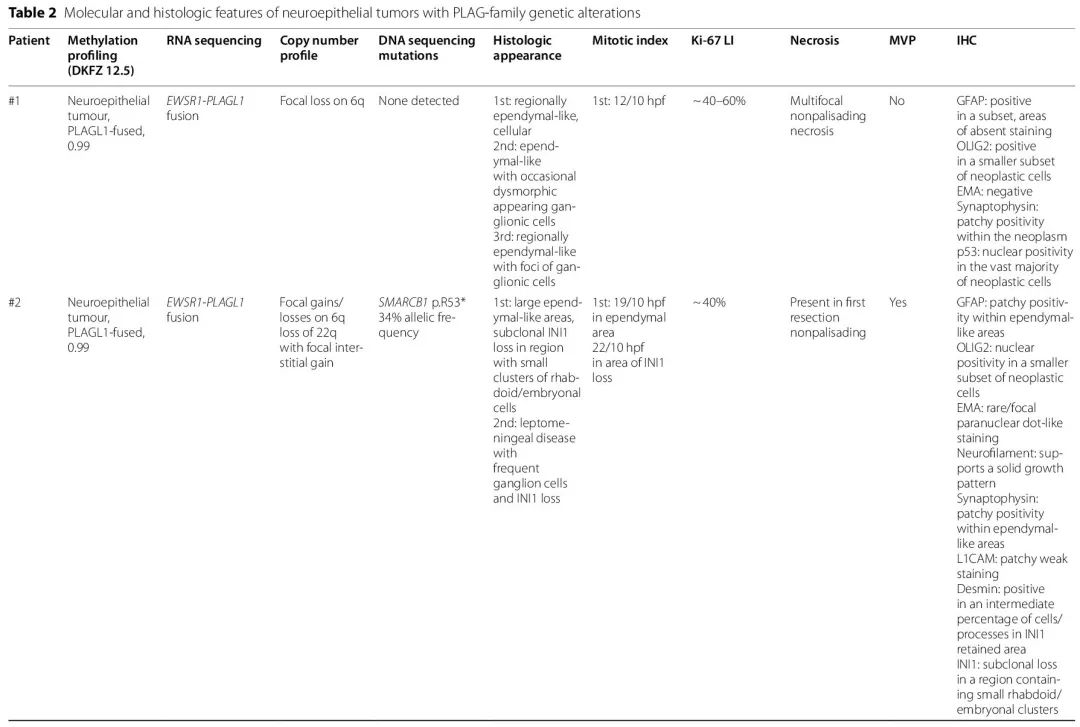
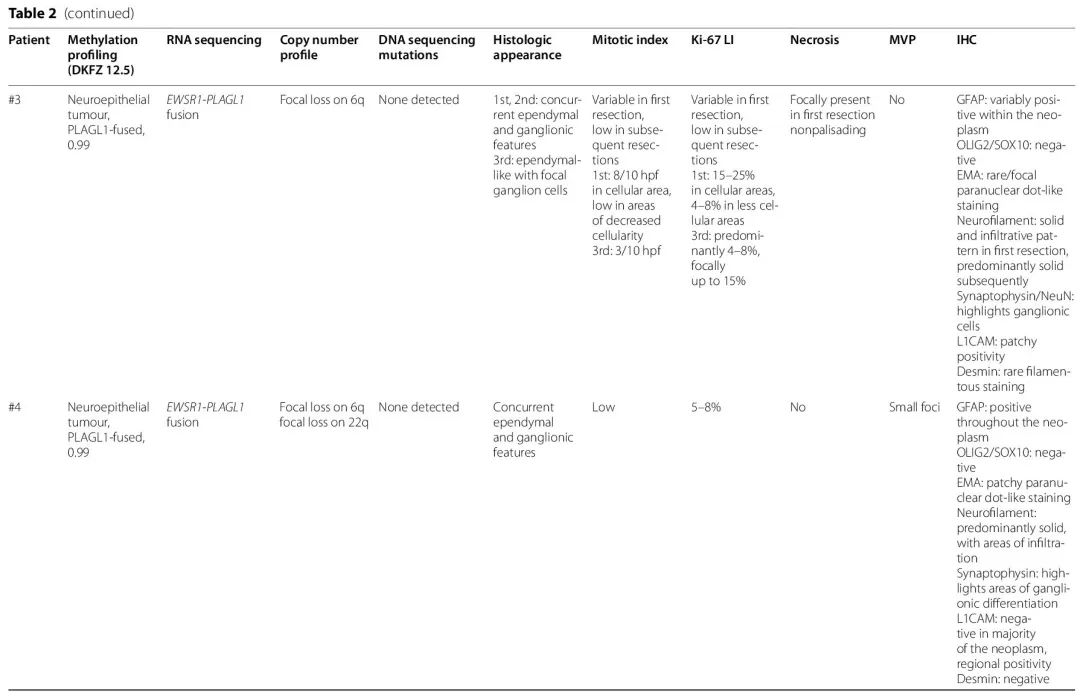
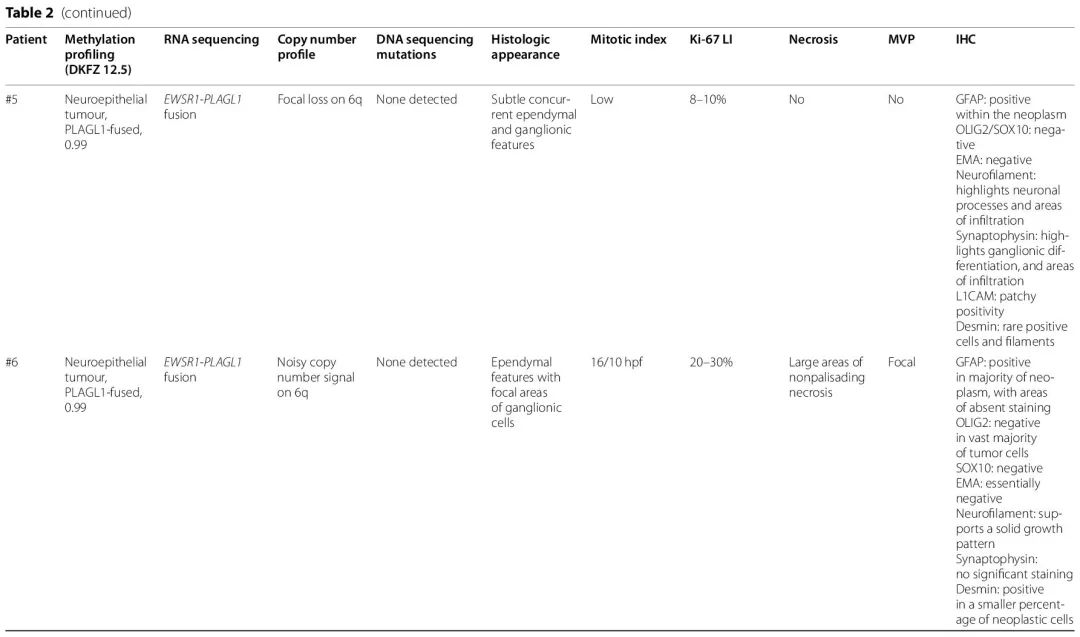
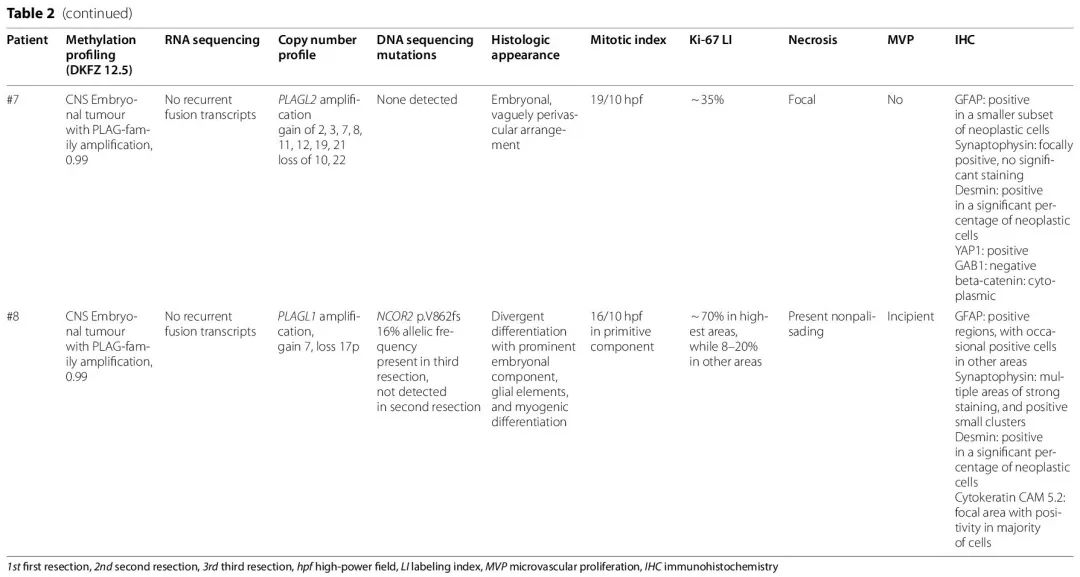
表2
本研究中的所有 PLAG 家族肿瘤均边界清晰,累及邻近的硬脑膜/脑膜,表现为大(> 5 cm)幕上肿瘤,除了一例 PLAGL2 扩增的小脑肿瘤。共同的影像学发现包括实性成分的异质性强化和扩散受限,除了病例 # 5 的肿瘤为多囊性(图 1)。6/8 例存在出血,3/8 例出现肿瘤周围水肿,3/8 例具有囊性成分。4/8 例有相关骨重建(变薄或骨质减少)。
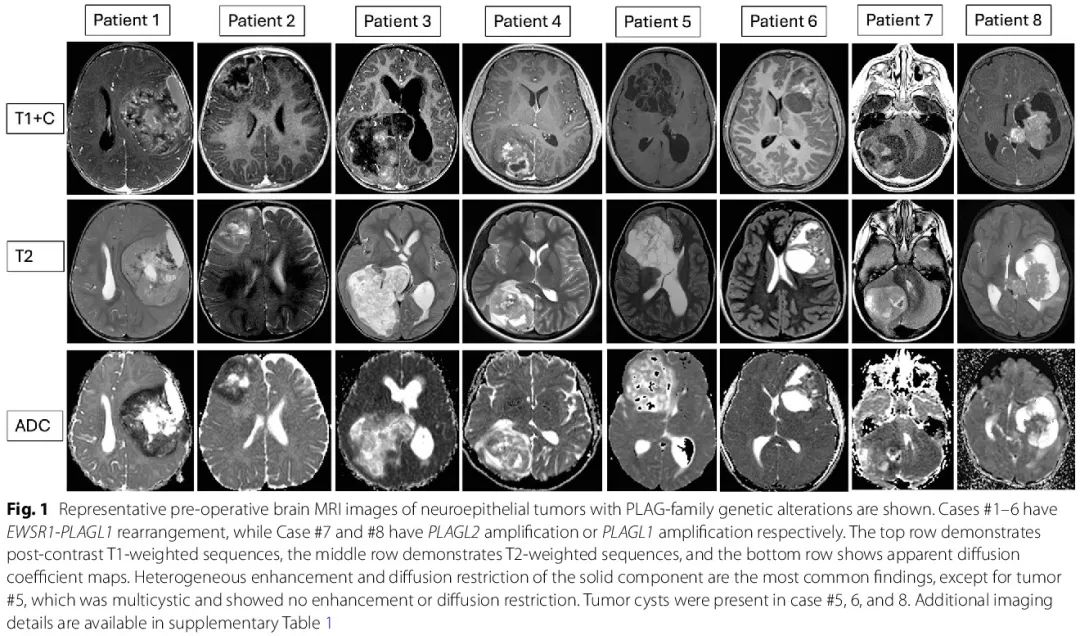
图1
组织学和免疫组织化学特征
EWSR1-PLAGL1 病例主要表现为实性胶质瘤,有浸润区域。在少数病例中,可在选定区域看到与邻近脑实质的清晰分界。结构为室管膜样,具有血管周围无核区(血管周围假菊形团),细微室管膜样,具有不太明显的血管周围区,或者在一例病例中,室管膜样区域和具有核簇的区域的组合,让人联想到室管膜瘤/室管膜下瘤。
病例 #1 的初始切除术样本没有明显的神经节细胞成分,细胞较多,具有血管周围无核区 [图 2L],而在复发肿瘤样本中观察到偶尔的变形的神经节细胞。初始切除术样本中神经节细胞受累程度不同 [图 2L,表 2],从室管膜瘤/室管膜下瘤样区域内的显著神经节细胞簇 [病例 #4,图 2A-E],到位于细胞较少区域的神经节细胞,相邻区域的细胞较多,且细胞较小,具有室管膜特征 [病例 #3,图 2H-I],再到细微的室管膜样组织学中散在的低到中等频率的神经节细胞 [病例 #5,图 2F-G],以及室管膜样肿瘤内含有神经节细胞的局灶性区域 [病例 #6,图 2J-K]。
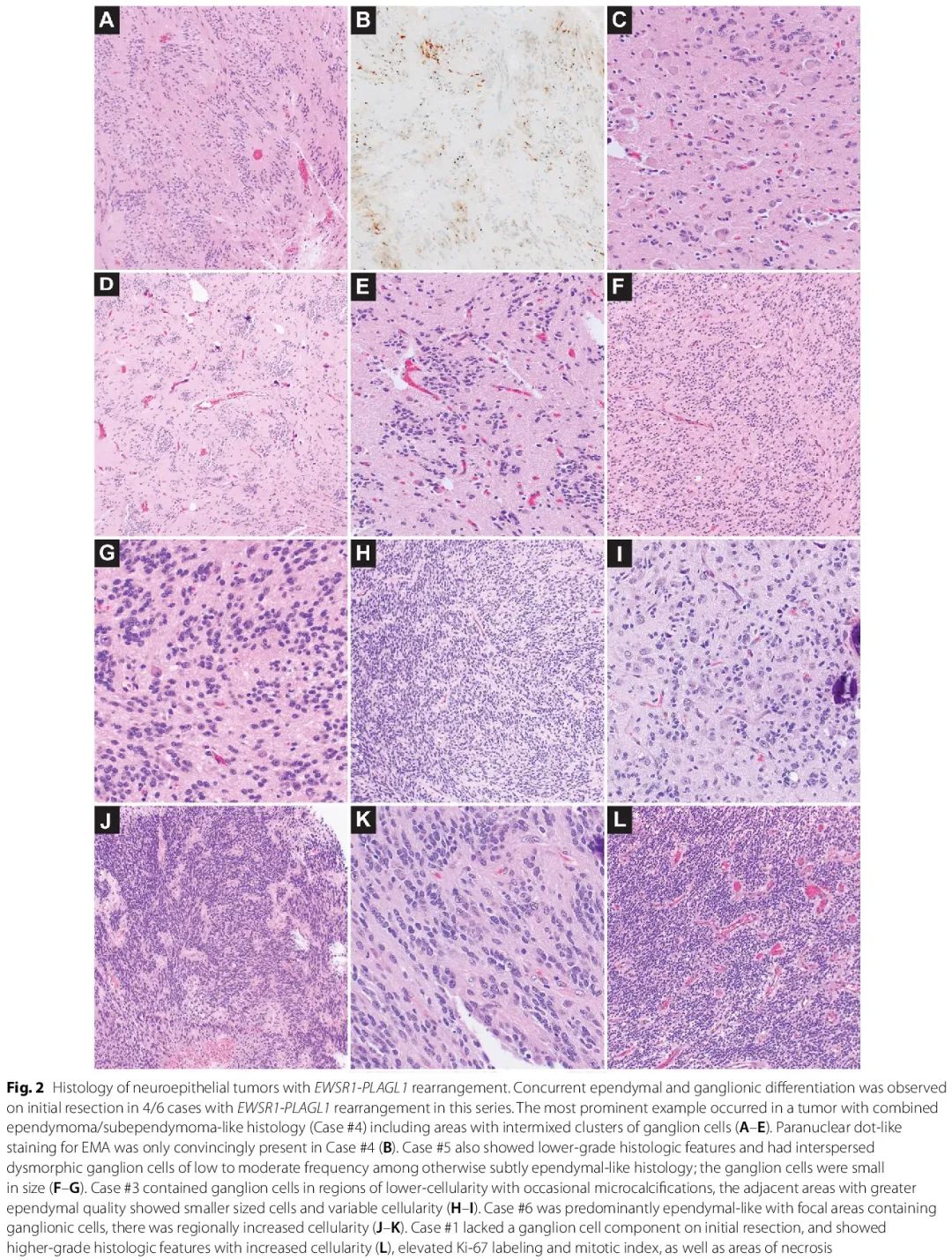
图2
病例 #2 [图 3A-E] 也是实性、细胞多、主要胶质样的肿瘤,具有室管膜样结构 [图 3A],但其独特之处在于免疫染色显示亚克隆 INI1 缺失 [图 3C]。INI1 缺失的区域涉及细胞较多的区域,该区域有小胚胎/横纹肌样细胞簇 [图 3B]。该患者出现多灶性颅内疾病,并累及软脑膜。后续切除术显示皮质表面有明显的神经节细胞成分 [图 3D],并混杂有较小的细胞,这些细胞在外观上与之前的室管膜样区域相似,但多形性略高。复发时绝大多数肿瘤细胞,包括神经节细胞和小细胞成分,显示 INI1 缺失 [图 3E]。该患者复发时神经节细胞的发生可能与治疗有关。INI1 失活区域可能提示室管膜样肿瘤内 AT/RT 转化,或与 EWSR1-PLAGL1 神经上皮肿瘤中肿瘤进展相关的获得性伴随突变。在 INI1 缺失区域单独进行的甲基化分析显示,甲基化类别非典型畸胎样/横纹肌样瘤 SHH 激活亚阈值校准分数较低,为0.39,进一步支持肿瘤过渡区域,具有更高程度的 AT/RT 表观遗传同源性。甲基化类别神经上皮肿瘤 PLAGL1 融合在肿瘤该区域的较低校准评分结果中没有体现,尽管发现具有 PLAG 家族扩增的 CNS 胚胎肿瘤评分极低。
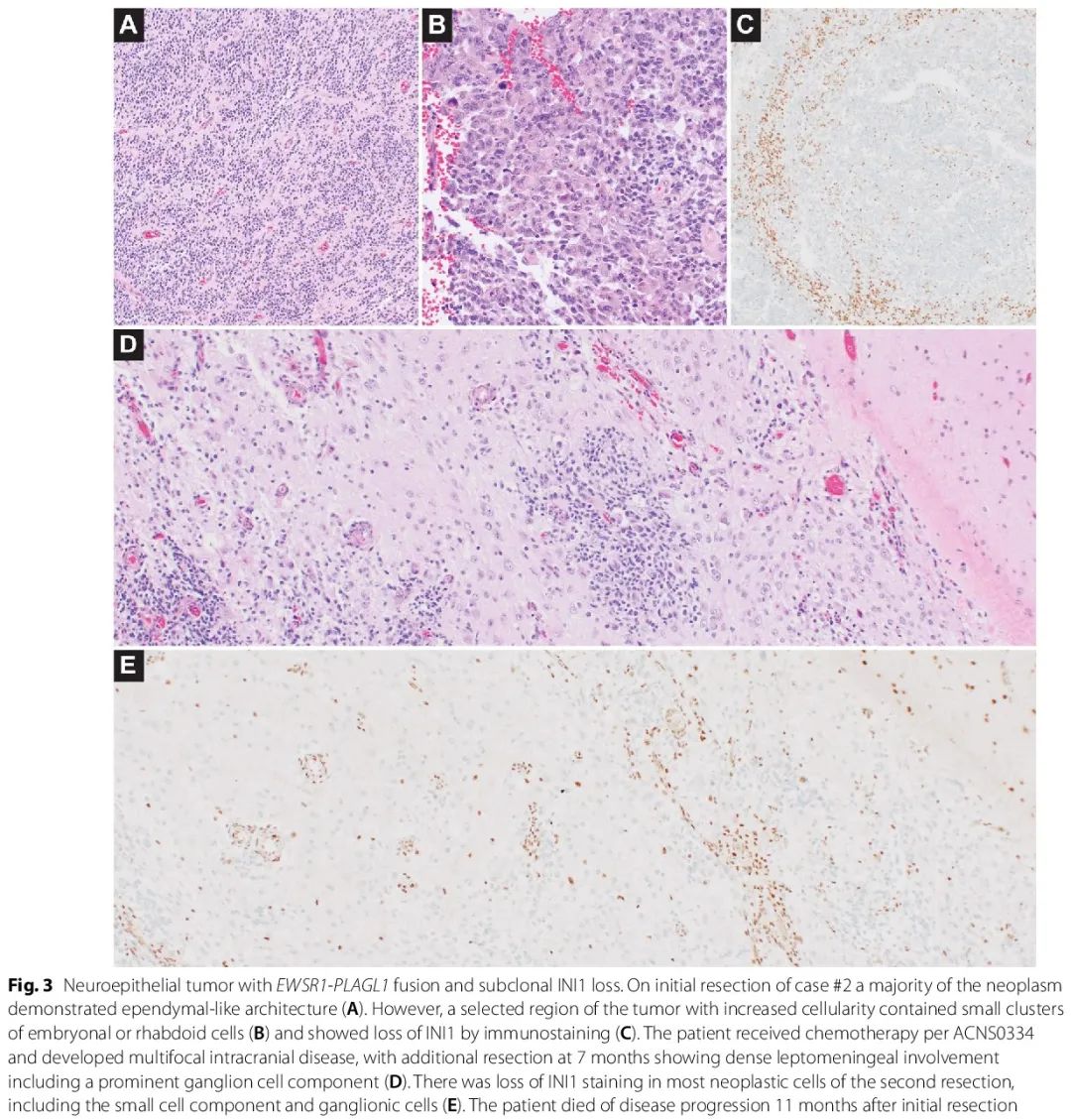
图3
在 2/6 例 EWSR1-PLAGL1 融合病例(#4、#5)中,有丝分裂活性较低,有丝分裂象不常见或不明显,这与没有坏死和较低的 Ki-67 标记指数相关(范围为 5% 至 10%)。相比之下,3/6 例患者(#1、#2、#6)具有较高的有丝分裂指数(每 10 个高倍视野有 12、16 或 19 个有丝分裂象),非栅栏状坏死区域和较高的 Ki-67 标记指数(≥ 30%)。病例 #3 的初始切除术样本有不同的有丝分裂活性和 Ki-67 区域,并且在组织学上被认为是高级别神经上皮肿瘤或可能是一种间变性节细胞胶质瘤,而随后的两次切除术样本具有低级别组织学特征。微血管增生虽然在 3 例患者中至少局灶性存在,但在这些病例中不是显著的发现。从细胞结构、Ki-67 标记、有丝分裂指数和坏死面积来看,整体组织学印象支持 2/6 例(#4、#5)为较低级别神经上皮肿瘤,3/6 例(#1、#2、#6)为较高级别神经上皮肿瘤,1 例混合有低级别和高级别区域(#3)。有丝分裂活性与诊断年龄没有明确相关性,在 1 岁以下和 11 岁的患者中均观察到较高的有丝分裂活性。
在 EWSR1-PLAGL1 融合病例中,缺乏 OLIG2 和 SOX10 染色且生长模式相对稳定,这是室管膜样特征,尽管室管膜瘤类型 EMA 染色仅在1例中明显存在 [图 2B],2例中有局灶/罕见核旁点状染色。神经丝染色支持 3/5 例病例中以实性为主的生长模式。病例 #3 最初呈实性和浸润性混合模式,后续切除表现出更多的实性生长。在病例 #5 中,神经丝和突触素染色提示肿瘤内同时存在浸润区域和神经抗原表达成分。在检测的4个病例中,L1CAM 未表现出明显的强或弥漫性染色。在2个较高级别样 PLAGL1 重排病例中,结蛋白染色在较小到中等比例的肿瘤细胞和细胞过程中显示阳性。
PLAGL1 扩增肿瘤区域对 GFAP 或突触素表现出强阳性,有时染色区域重叠,而其他肿瘤区域对这两种谱系标记物基本呈阴性,只有小簇或偶尔有细胞表现出阳性。尽管 GFAP 和突触素染色存在差异,但在整个肿瘤中相当大比例的肿瘤细胞中结蛋白呈阳性 [图 4E],少数细胞显示密集的嗜酸性胞浆或伸长 [图 4F]。组织学从拥挤的具有深染细胞核的原始样细胞 [图 4A-B],到具有更多胞浆的胶质区域 [图 4C],以及不太常见的梭形区域 [图 4D]。这种组织学和染色模式与 Keck 等人描述的相似,他们报告 9/12 例肿瘤的结蛋白染色,范围从稀少阳性细胞到弥漫性强阳性不等。PLAGL2 扩增实性细胞丰富肿瘤同样在大部分肿瘤细胞中显示出结蛋白染色 [图 4I],且结蛋白阳性程度高于 GFAP 或突触素。PLAGL2 组织学显示细胞核深染的较小胚胎样细胞呈模糊的血管周围排列 [图 4G-H]。在 PLAGL1 扩增病例区域内也可见类似的原始细胞松散血管周围/假乳头状结构 [图 4A]。在2例 PLAG 扩增病例中,原始区域内的有丝分裂活性均较高,每 10 个高倍视野分别有 16 个或 19 个有丝分裂。
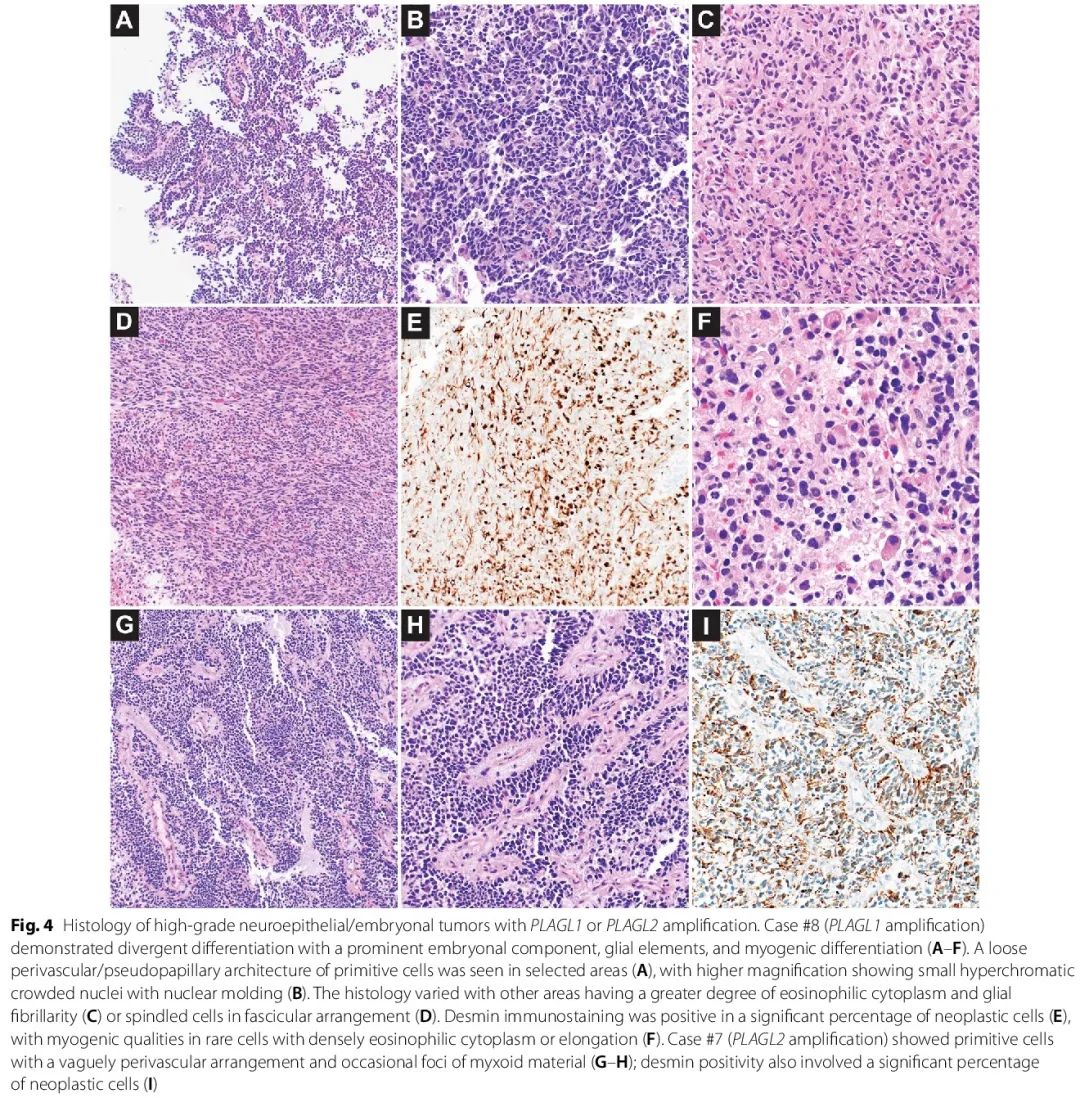
图4
分子特征
对于 EWSR1-PLAGL1 融合病例,5/6 例 EWSR1 (NM_05243.4) 外显子 8 与 PLAGL1 (NM_001080951.2) 外显子 8 融合,1 例 EWSR1 (NM_05243.4) 外显子 7 与 PLAGL1 (NM_001080951.2) 外显子 8 融合。拷贝数改变显示染色体 6q 和 22q 的局部改变,靠近 PLAGL1 (6q24.2) 和 EWSR1 (22q12.2) 基因的位置。发现1例 EWSR1-PLAGL1 病例具有致病 SMARCB1 截断突变(p.R53*,突变丰度为 34%),这与免疫组织化学观察到的亚克隆 INI1 缺失相对应。尽管病例 #1 的绝大多数肿瘤细胞存在 p53 核阳性,但未发现相应的 TP53 突变。在 PLAG 家族扩增的病例中,RNA 测序分别显示 PLAGL1 和 PLAGL2 的 RNA 表达增加。所有病例的分子发现,包括甲基化分析校准评分结果,总结在表 2 中。
临床结局
5/6 例 PLAGL1 融合患者(范围:11 个月至 10 年)有临床随访数据,治疗方式和切除程度各异 [表 1]。3 例患者出现复发,其中1例患者在 ACNS0334 方案治疗后 7 个月出现颅内多灶性疾病,11 个月时死亡;1例患者在化疗后 1.6 年和 9 年出现两次复发;1例患者在 6 个月时出现残留/复发疾病,1.2 年时局部快速复发。PLAGL2 扩增病例的结局数据显示 4.8 年时无疾病迹象,PLAGL1 扩增病例的现有结局数据显示 7 个月时无明确残留疾病。
讨 论
在临床上 RNA 测序和甲基化分析可及之前,许多未检测到 EWSR1-PLAGL1 融合的病例可能在组织学上被诊断为室管膜瘤,而一些病例可能被认为是一种间变性节细胞胶质瘤或高级别神经上皮肿瘤。鉴于目前报告的有结局数据的分子确诊病例数量有限,尚不清楚未来的分类是否会将具有室管膜特征的 EWSR1-PLAGL1 重排的幕上神经上皮肿瘤视为幕上室管膜瘤的一种独特类型,还是一种全新的实体。有趣的是,研究 ZFTA-RELA 融合的小鼠脑肿瘤模型发现,ZFTA-RELA 融合蛋白产物含有与 PLAGL1 相似的 C2H2 锌指结构域,并与富含 PLAGL 家族转录因子基序的基因组位点结合,这可能提示 ZFTA-RELA 融合室管膜瘤与 PLAGL1 重排室管膜样肿瘤在转录调控机制上存在相似性。Sievers 等人对 ZFTA-RELA 融合室管膜瘤和幕上神经上皮肿瘤 PLAGL1 融合甲基化组之间的基因表达分析证明了肿瘤样本的分离。在确定如何将肿瘤分类为独特、相似或独立实体时,不同参数的权重,如甲基化或突变谱与组织学、影像学、免疫染色和临床过程,是肿瘤分类理论中一个不断发展的领域。虽然 PLAGL1 重排病例通常具有室管膜样组织学,并且同样缺乏 OLIG2/SOX10 免疫染色,但罕见的 EMA 核旁染色和其他差异可以解释为与真正的室管膜谱系不同。EWSR1-PLAGL1 重排病例是代表一种新的分子类型的室管膜瘤还是一种具有组织学重叠的独特神经上皮实体,需要进一步评估以阐明这种关系,特别是对于临床治疗意义。
由于室管膜样病例的增殖速度和坏死情况存在差异,以及潜在分子定义的实体没有明确的临床结局关联,将 PLAGL1 重排神经上皮肿瘤普遍描述为低级别或高级别可能还为时过早。分子定义的室管膜瘤同样当前缺乏有意义的结局数据用于 WHO 分级,补充关于室管膜瘤组织学分级的有争议的历史。在具有细胞增多、Ki-67 升高、有丝分裂指数升高和坏死区域的组合的 PLAGL1 重排病例中,这些组织学特征将支持出于治疗目的的更高级别归类。在本研究中,一例随访时间长达 10 年的患者疾病复发,鉴于临床观察时间的长度,病程相对缓慢。相比之下,一例患者出现多灶性颅内疾病,在初始切除术后 11 个月死亡;该肿瘤还携带亚克隆 SMARCB1 突变和胚胎细胞簇,使其在组织学和分子学上区别于其他病例。起源于胶质或神经胶质神经元实体的其他 AT/RT 实例通常显示不良预后。这些差异强调了报告 PLAG 家族改变的神经上皮肿瘤及其临床和组织病理学相关性(包括治疗和预后)的重要性。罕见和新出现的实体的治疗决策通常是根据具体情况在多学科脑肿瘤会议上讨论并考虑已发表的文献或临床试验可及性后做出的。虽然本研究中的病例数和随访时间有限,无法将结局与患者年龄、有丝分裂指数或神经节分化程度相关联,但 PLAGL1 融合病例中最差的预后与 INI1 失活的发生有关。
在具有 EWSR1-PLAGL1 重排的幕上神经上皮肿瘤亚组中观察到的一个特征是同时存在室管膜和神经节分化。虽然并非所有病例都存在并且不太可能是实体特异性的,但同时存在室管膜和神经节特征可能引起对具有 EWSR1-PLAGL1 融合的幕上神经上皮肿瘤的考虑,并促使进行适当的检测,例如 RNA 测序和甲基化分析。这些病例在文献中增加,描述性诊断可能是合适的,例如具有室管膜和神经节特征的 EWSR1-PLAGL1 重排的幕上神经上皮肿瘤。此外,鉴于获得 SMARCB1 突变的 EWSR1-PLAGL1 病例的预后不佳,在 PLAGL1 融合病例中应考虑 INI1 染色。认识到 EWSR1-PLAGL1 融合的幕上神经上皮肿瘤可能发生获得性 SMARCB1 失活和 AT/RT 特征,导致临床进展,类似于之前报道的多形性黄色星形细胞瘤、节细胞胶质瘤和室管膜瘤,这一点很重要。
对于 PLAGL1/PLAGL2 扩增病例,结蛋白阳性程度是本研究中2例病例的一个显著特征,因此当原始样肿瘤存在结蛋白阳性时,可能有助于引起对该诊断的考虑。继续积累相关临床数据对于了解具有 PLAG 家族基因变异的新兴实体,识别其全方位的外观和临床行为至关重要。
参考文献:
Lee JC, Koo SC, Furtado LV, Breuer A, Eldomery MK, Bag AK, Stow P, Rose G, Larkin T, Sances R, Kleinschmidt-DeMasters BK, Bodmer JL, Willard N, Gokden M, Dahiya S, Roberts K, Bertrand KC, Moreira DC, Robinson GW, Mo JQ, Ellison DW, Orr BA. Concurrent ependymal and ganglionic differentiation in a subset of supratentorial neuroepithelial tumors with EWSR1-PLAGL1 rearrangement. Acta Neuropathol Commun. 2024 Sep 3;12(1):143. doi: 10.1186/s40478-024-01809-9. PMID: 39228008; PMCID: PMC11370057.



