雄激素性脱发的病因及发病机制研究进展
时间:2024-09-30 18:02:24 热度:37.1℃ 作者:网络
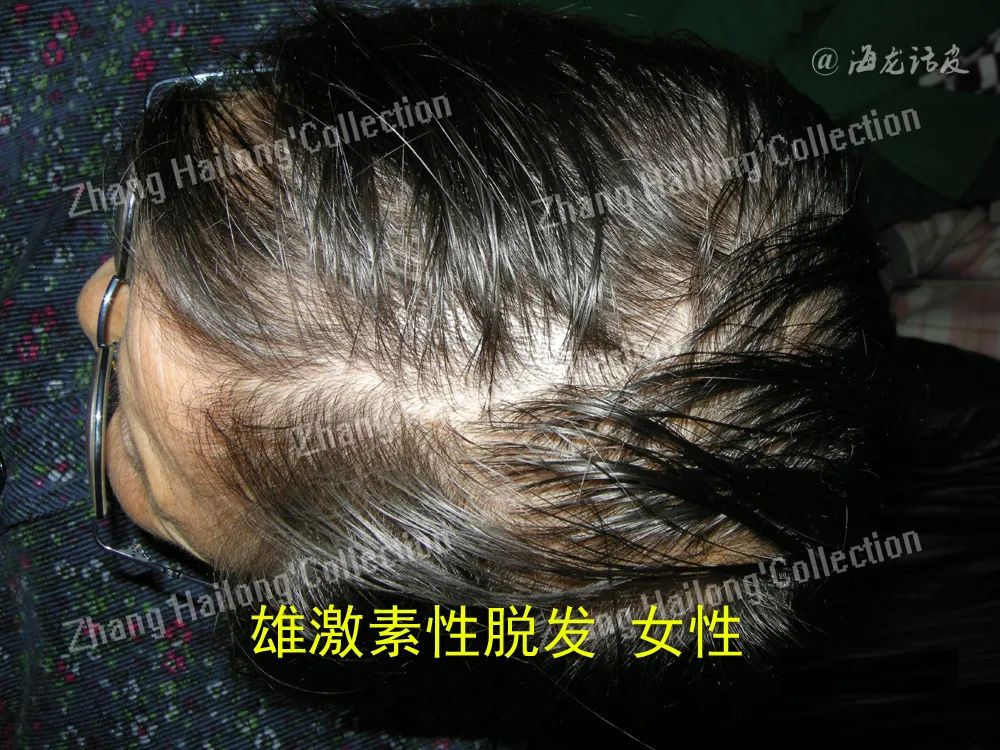
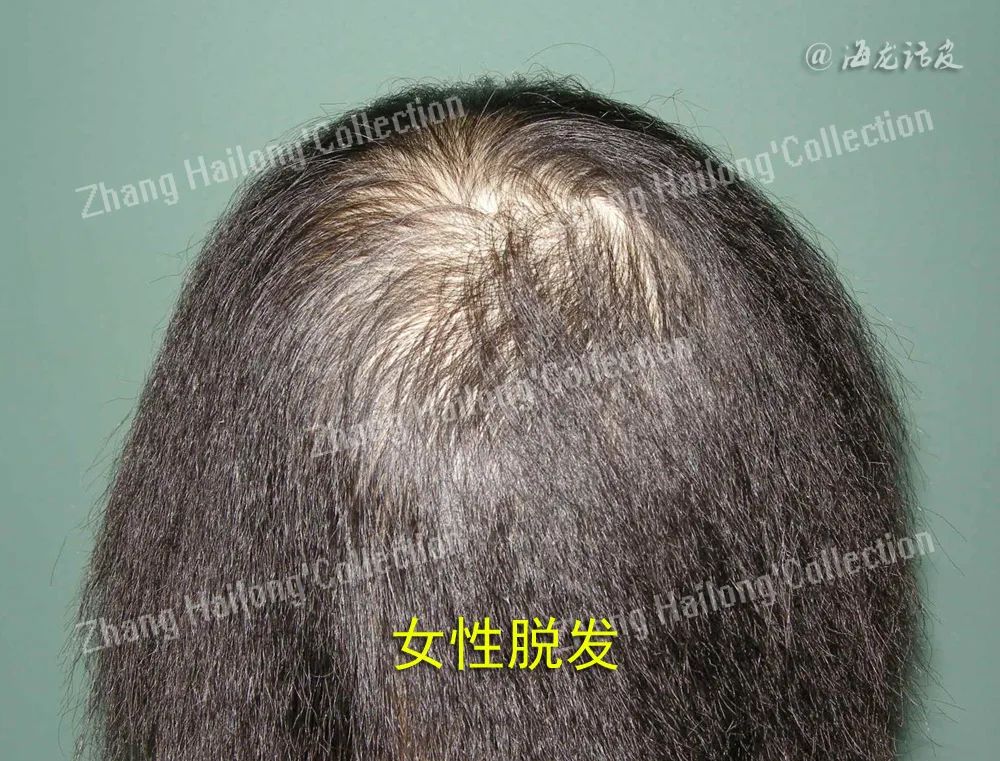
雄激素性脱发(androgenic alopecia,AGA)是一种非瘢痕性脱发,以青春期后进行性终末脱发为特征,是世界范围内常见的脱发形式,根据性别可以分为男性型脱发和女性型脱发。男性型脱发表现为前额两侧延伸至头顶的“M”形发际线后移,与顶部脱发连接成片后形成特征性“马蹄形”图案。而女性型脱发则多为弥漫性稀疏性脱发,患者往往表现为顶部头发稀疏,额叶发际线通常不会出现。

流行病学研究显示我国男性AGA患病率为21.3%,70岁以上男性和女性的患病率分别为41.4%和11.8%,且AGA的患病率也在逐年升高,严重影响AGA患者的生活质量和社会行为的积极性,故研究AGA发病机制为相关治疗提供理论依据显得尤为重要。本文将对AGA的病因及发病机制研究进行概述,以进一步为临床应用及治疗研究提供理论依据。
毛发生长周期与AGA
正常毛发的生长周期一般包含三个阶段:生长期、退行期和休止期。正常头发84%处于为期2~3年的生长期,一部分在一定时间以后会进入退行期,退行期一般很短,仅有2~3周的时间,然 后将进入约12周的休止期,处于休止期的毛发发生脱落,新的毛发从毛囊长出,从而进入新的毛发生长周期。有研究发现毛囊干细胞向祖细胞转化的缺陷在AGA的发病过程中起作用,且血管内皮因子可保护具有祖表型的CD34+干细胞免受雄激素的诱导而凋亡。AGA患者毛发处于生长期的时间明显缩短,而处于休止期的时间则大大延长。
研究表明决定毛发生长的关键时期为休止期,患者处于休止期的毛发比例大幅上升,会导致新生毛发长度比原有毛发长度缩短,大量细而短的毛发产生,且AGA患者毛发镜检结果显示,相较于正常人群,患者头发中细而短的头发占比更高。生长期时位于毛囊上皮的角质形成细胞快速增殖,退行期时角质形成细胞则会发生细胞凋亡从而导致毛囊退化进入休止期,毛发停滞生长。
DPCs通过信号激活毛囊间充质干细胞(hair follicle mes enchymal stem cells,HFSCs)使其增殖并重新填充毛囊上皮,诱导毛囊和皮脂腺的增殖,HFSCs的活化受Wnt/β-catenin信号通路及Notch信号通路的调节。Notch受体配体相结合后可激活Wnt/β-catenin信号通路,参与毛囊和毛发生长周期的调节。如果HFSCs的信号激活失败,HFSCs不能增殖则不能使毛囊重新进入生长期。处于休止期的毛囊就会发生空化,原有的毛干脱落,新生毛发无法生长,最终导致脱发。
雄激素水平与AGA
雄激素主要作用是促进男性性器官发育和第二性征出现,能促进胡须、腋窝、外阴处的毛发生长,但是抑制头发生长。AGA的发病率随着年龄的增长而增加,同时男性青春期后雄激素水平升高以及女性青春期后雌激素水平的下降均会增加AGA的患病率。女性雄激素性脱发患者临床和血液检查可以发现血清二氢睾酮水平升高,雄激素缺乏、AR功能障碍以及由缺乏5-α还原酶导致的假两性畸形患者雄激素性脱发患病率较低,进一步说明了雄激素与AGA的发病密切相关,因而多数学者认为雄激素与毛发生长周期以及毛囊病理变化密切相关。
雄激素中最主要的形式为睾酮,睾酮是一种亲脂性激素,可以自由渗透通过细胞膜,在体内5-α还原酶的作用下转变为二氢睾酮。AGA患者头皮中含有高浓度二氢睾酮,TGF-β1以及Ⅰ型前胶原基因在mRNA和蛋白质水平上的表达均有增加,使用脂肪间充质基质细胞分泌的外泌体治疗后TGF-β1的水平降低,表明睾酮能够诱导TGF-β1和Ⅰ型前胶原基因表达促进AGA中毛囊周围纤维化的发展,最终导致毛囊微型化。
雄激素受体与AGA
雄激素受体(androgen receptor,AR)是核受体超家族中的类固醇受体,由N端转录激活区(NTD)、DNA结合区(DBD)、铰链区和配体结合区(LBD)组成。研究发现AGA患者秃顶头皮真皮(DP)与健康人的额头皮相比,AR的核定位显著升高,AR介导的TGF-β旁分泌信号传导会诱导AGA患者头皮DP中的微血管内皮细胞凋亡,早期抗AR治疗优于晚期治疗。
AR可被由雄激素转化的二氢睾酮激活并易位到细胞核内,在动物实验中使用AR拮抗剂比卡鲁胺后,AR的激活受到抑制,小鼠毛发再生加速,证明了雄激素受体和雄激素的结合在AGA的发生和发展中起着至关重要的作用。只有AR存在的靶组织细胞才能特异性结合雄激素并发挥其生物功能。
遗传因素与AGA
1、雄激素受体基因:
雄激素受体基因是第一个发现的与AGA发生相关的基因,长约90kb,位于X染色体q11.2-q12,由8个外显子和7个内含子组成,受体的N端由最大的1号外显子编码,DNA结合阈由2、3号外显子编码,其他5个外显子编码雄激素结合阈。当雄激素受体基因发生改变时,如 StuI限制位点多态性、CAG和GGC多次重复及序列异常、AR非编码区单核苷酸多态性改变均可能引起AGA的发生。
CAG的重复次数增加会使体内AR转录活性呈现下降趋势。近年来研究者对青年脱发患者、老年脱发患者以及正常男性的雄激素受体多态性的等位基因频率进行比较,发现StuI限制性酶切位点在年轻脱发男性、老年脱发男性以及正常男性的频率分别为98.1%、92.3%、76.6%,较短的CAG和GGC三联重复单倍型在脱发男性中更为普遍。提示雄激素受体基因表达的增加以及多态性与AGA发生密切相关,但此研究结果存在种族差异。通过研究汉族女性型脱发患者CAG重复长度发现,CAG重复序列可能不是中国人群中女性型脱发的遗传标记。
AR非编码区单核苷酸多态性与AGA发病同样密切相关,Ohn等发现了位于PPARGC1A、ABCC4、CYP11B2、FSHB和CYP19A1周围的49个单核苷酸多态性对早发型女性型脱发的发生具有重要意义,并建立模型通过单核苷酸多态性预测AGA发病风险。
2、鸟氨酸脱羧酶基因:
鸟氨酸脱羧酶(ornithine decarboxylase,ODC)是多胺生物合成中的关键酶,ODC有两个功能不同的等位基因分别为A和G。Prokop等发现患有与ODC1基因功能变异相关的独特神经代谢障碍的患者表现有全身发育迟缓、脱发的症状,通过ODC1抑制剂干预可以有效改善相应症状,证明ODC多态性与脱发的相关性。
3、其他基因:
AGA是一种多基因疾病,涉及多个基因,如5-α还原酶基因、LGR4、WNT3、STAT3、EGLN1、EG-LN3、NOTCH、IQGAP1、FGF5、SERP1NF1、SFRP2和PRKD1等基因都可能与AGA的发病相关。5-α还原酶基因有两种同工酶,分别为Ⅰ型和Ⅱ型,Ⅰ型主要局限于皮肤和头皮,Ⅱ型也存在于头皮,是非那雄胺的治疗靶点。
AGA患者与正常人群基因表达相比,脱发人群毛囊DPCs中脉管系统相关基因下调,通过AGA小鼠模型实验发 现血管内皮因子的作用可以促进血管生成及毛囊发育,BMP2和ephrinA3的基因表达降低,NT-4表达显著上调。BMP2和ephrinA3提高了促进外毛根鞘细胞的增殖,并诱导酸性角蛋白3-Ⅱ基因的表达,得出BMP2和ephrinA3基因起促进头发生长的作用。
血液流变学与AGA
程晓等发现防脱育发精华液能够促进头发新生,且能显著降低大鼠血浆黏度和全血黏度,降低红细胞凝集能力,提示雄激素源性脱发的发病与血液流变学变化存在一定的相关性。张蕾等研究发现,长期有氧型中高强度运动有助于促进头皮血液循环,增加头皮摄氧,改善头皮局部缺血缺氧的情况,一定程度延缓AGA病情进展。游离脂肪酸(FFAs)可能与AGA具有相关性。
张文强等采用气相-色谱-真空紫外光谱法研究FFAs与AGA的相关性时发现,在60例AGA患者和33例健康人的外周血游离脂肪酸谱统计学检验中,亚例油酸(LA)与AGA患病风险最为密切,而山嵛酸则是AGA的保护因素,肉豆蔻酸(MA)、二十碳三烯酸(EET)、总不饱和脂肪酸(TMUFA)也是AGA的影响因素。刘柯含等通过分析研究男性AGA患者的脂质谱发现,男性早发AGA与血脂水平存在相关性,小而密低密度脂蛋白(sdLDL)与AGA的严重程度呈显著正相关。
生活习惯与AGA
陈修漾等对240例雄激素脱发患者进行了病因学相关因素的研究,结果发现在240例患者中有62.5%处于高强度脑力工作中,68.8%精神情况欠佳,46.7%存在睡眠障碍;同时该项研究发现嗜辛辣刺激和饮酒患者分别占比 54.6%和44.6%。叶新等通过对296例青年女性雄激素性脱发患者发病因素探究,发现精神压力大、熬夜、节食减肥、睡眠障碍、月经不调等因素均是AGA发病的危险因素。以上研究结果提示AGA可能与精神状况、心理健康及饮食习惯息息相关。日常生活中,不良饮食习惯,如嗜肥甘、生冷食物,易导致血浆中胆固醇水平上升,血液处于高粘度状态,从而导致微循环障碍影响毛发营养供给。
结语与展望
雄激素性脱发是多种原因引起的一种多基因疾病,对患者的自身形象、心理健康和生活质量都产生巨大的影响。目前研究已证实雄激素与AGA的相关性,其他基因对于AGA的研究尚不完全明确,未来仍需进一步深入研究。关于血液流变学与AGA发病的关系逐渐引起重视,信号通路的研究是目前的热点,有望在今后对AGA的治疗方法提出新思路。
参考文献:
1.王雪,梁粟,赵月铮等.雄激素性脱发的病因及发病机制研究进展[J].皮肤性病诊疗学杂志,2024,6(31):440-444.
2.顾月婷.载低氧预处理间充质干细胞条件培养基的可溶微针构建及其用于雄激素源性脱发的治疗研究[D].杭州:浙江大学,2023:89.
3.赖惠君,杨岚,游馥榕等.毛囊间充质干细胞的研究进展[J].皮肤性病诊疗学杂志,2022,29(5):472-477.
4.其他文献略。


