失代偿期肝硬化及并发症中人血白蛋白的使用:长期还是短期? ——EASL 2024:从现象到本质
时间:2024-10-14 23:00:41 热度:37.1℃ 作者:网络
白蛋白是血浆中最丰富的蛋白质,由肝脏合成。基于其胶体和非胶体特性,人血白蛋白不仅可改善低血容量,还能通过结合内源性和外源性化合物、发挥抗氧化作用、调节炎症和免疫反应、改善心脏功能及恢复内皮完整性等多种病理生理机制作用于失代偿期肝硬化[1]。因此,从病理生理学角度来看,人血白蛋白可作为失代偿期肝硬化的多靶点治疗药物(图1)。国际指南目前推荐急性或短期使用人血白蛋白[2,3],而近年来长期输注人血白蛋白治疗肝硬化及其并发症成为科研和临床讨论的热点问题。那么人血白蛋白治疗,究竟应该选择长期方案还是短期方案?EASL 2024多项研究关注人血白蛋白治疗肝硬化及其并发症方面的临床进展,进一步促进临床对人血白蛋白应用的理解。
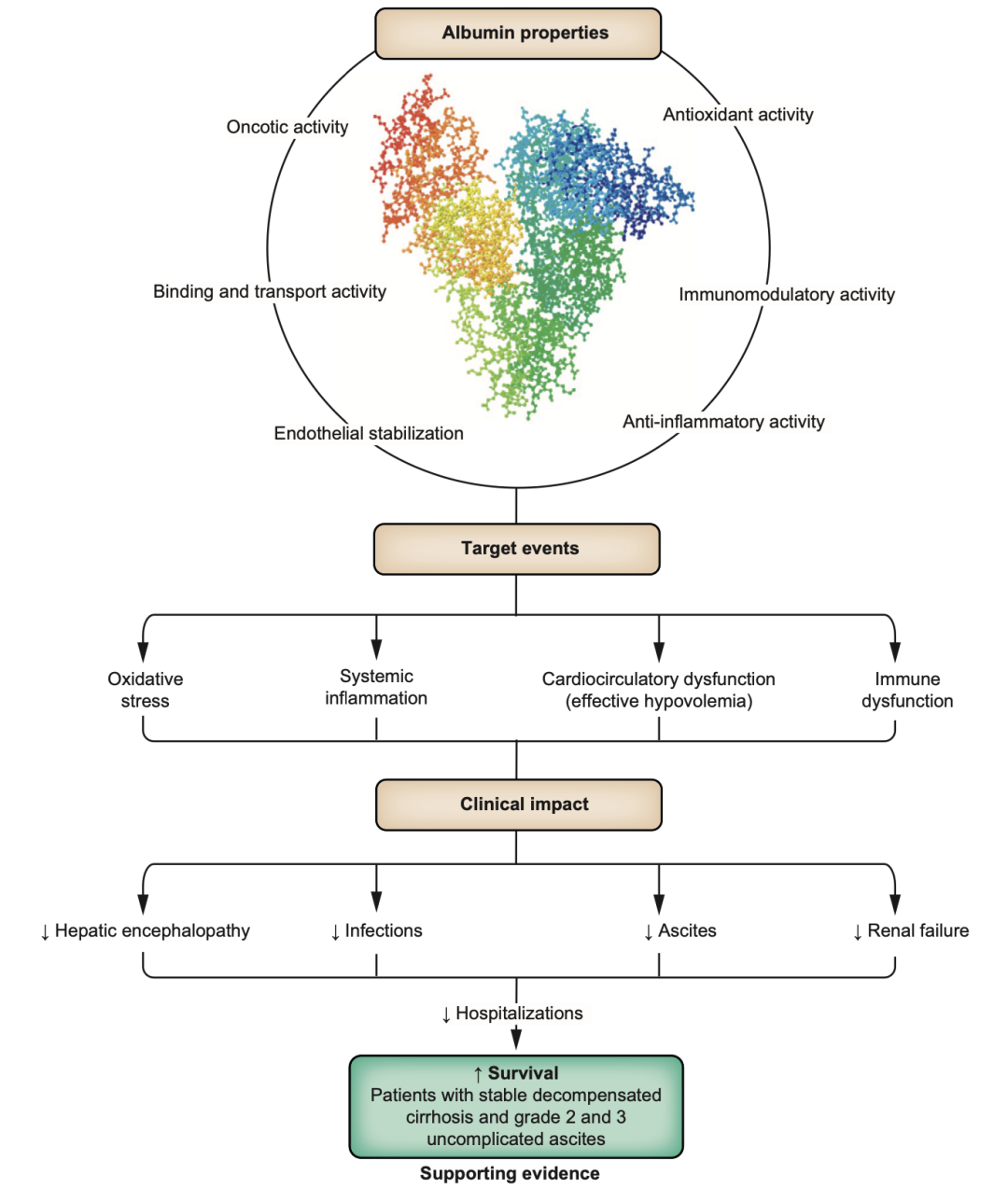
图1. 人血白蛋白治疗失代偿期肝硬化的作用机制、目标事件和临床影响
EASL 2024大会上,2项重要研究报道了长期应用人血白蛋白治疗肝硬化并发症的有效性。
FRI-047-YI Real-ANSWER研究:治疗一个月后血清白蛋白水平≥40 g/L是腹水消退的预测因素之一[4]
一项多中心、回顾性、观察性研究,纳入了2016年1月至2022年2月期间接受至少一个月长期人血白蛋白治疗的312例肝硬化伴腹水患者(酒精性 60%;MASLD 30%)。腹水消退定义为腹水改善至0–1级。
Child-Pugh中位数为8,MELD中位数为15,MELD-Na中位数为18。55%的患者腹水为2级,36%为3级,28%为顽固性腹水,47%的患者在此前6个月内接受过腹腔穿刺术。人血白蛋白剂量中位数为40g/周(IQR 40-40)。在腹水消退前,24%的患者人血白蛋白剂量有所减少,12%的患者因无反应而增加剂量。在最后一次观察时(因任何原因中断治疗或在仍接受治疗的患者随访结束时),56%的患者腹水为0/1级(图2),中位治疗时间为11个月(6–19个月)。

图2 治疗开始与结束时腹水等级变化情况
长期人血白蛋白治疗之前接受过腹腔穿刺术的123例患者中,53%的患者在治疗的3到6个月期间没有再接受过腹腔穿刺术。
与腹水在3个月内和治疗结束时消退的独立预测因素如图3所示。
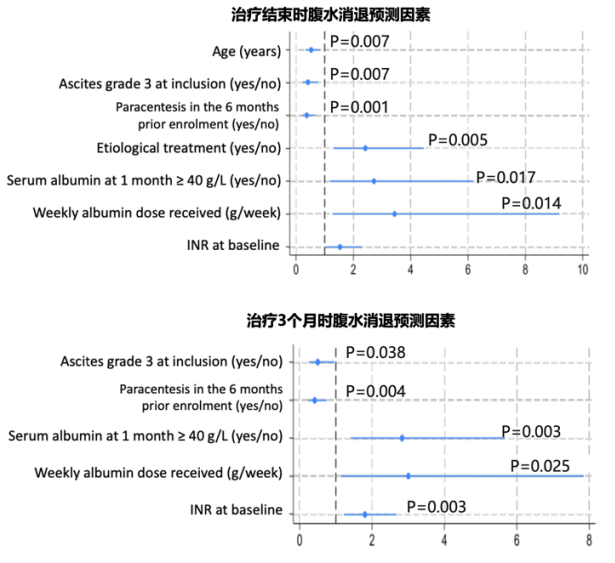
图3 腹水消退的独立预测因素
34%的患者腹水在最初3个月内改善到0/1级,37%的患者在6个月内改善到0/1级,46%的患者在12个月内改善到0/1级。
Real-ANSWER 研究表明,长期人血白蛋白治疗在日常临床实践中是可行和安全的,是失代偿期肝硬化患者的一种有效治疗选择,对于顽固性腹水患者,长期人血白蛋白治疗不应作为替代疗法,而应与其他疗法相结合,临床和治疗相关因素有助于预测对长期人血白蛋白治疗的反应,为个体化治疗提供信息。
SAT-113 长期静脉注射人血白蛋白可提高失代偿期肝硬化和顽固性腹水患者的存活率[5]
肝硬化患者出现顽固性腹水时,6个月的存活率仅为50%。一项意大利观察性研究纳入巴勒莫大学134例在肝病日间病房接受腹腔穿刺大量放液(LVP)的肝硬化顽固性腹水患者(MASH n=46;酒精相关 n=37;HCV n=30;HCV n=11;自身免疫性肝硬化 n=2,隐源性肝硬化n=7,混合病因 n=10)。组1(n=90)仅在LVP期间接受人血白蛋白输注,观察时间为2019年1月至2022年4月;组2(n=44)在LVP期间及之后长期输注人血白蛋白(40g/周),观察时间为2022年5月至2023年11月。研究旨在探索长期输注人血白蛋白是否可提高失代偿期肝硬化伴顽固性腹水患者的存活率。
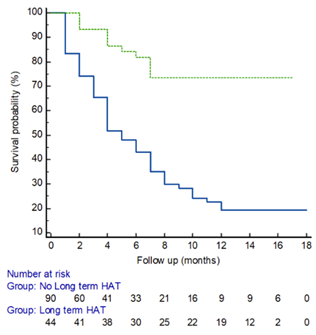
图4.长期白蛋白治疗对患者生存的影响
结果显示:组1有74例患者(82%)、组2有19例患者(45%)至少有一次因并发症住院治疗(P< 0.001);组1所有患者均接受LVP,而组2有12例患者(27%)不再接受LVP(P< 0.001);最终,组1的65例患者(71%)和组2的11例患者(26%)死亡(P<0.001)。组1患者的平均存活期为5个月,组2患者的平均存活期为7个月。长期人血白蛋白治疗可明显改善顽固性腹水患者的预后,降低死亡率,且耐受性良好。
综上可见,长期人血白蛋白治疗可有效缓解失代偿肝硬化患者腹水并降低顽固性腹水患者死亡率[4,5]。那么,不同剂量的效果是否不同?长期人血白蛋白治疗的安全性和耐受性如何?EASL 2024大会上Pilot- PRECIOSA研究探讨了这些问题。
FRI-121 失代偿期肝硬化患者长期白蛋白治疗安全性和耐受性良好,与低剂量相比,高剂量人血白蛋白更有效减少腹水[6]
Pilot- PRECIOSA研究是一项概念验证、多中心、非随机、前瞻性、开放标签的IV期临床试验(NCT00968695,EudraCT 编号:2008-003920-40),评估了长期人血白蛋白治疗(20%)对肝硬化伴腹水患者心血管循环和肾功能以及全身炎症的影响。患者在治疗期间接受低剂量(每两周1g/kg,LAlbD组)或高剂量(每周1.5g/kg,HAIbD组)的20%人血白蛋白溶液治疗,为期12周,并对两组患者的不良事件(AE)、严重不良事件(SAE)、生化和血液学实验室指标进行了评估,还评估了长期人血白蛋白治疗对腹水和肝性脑病等级的影响。
对31例患者进行了分析(n=15,LAlbD;n=16,HAlbD)。各组之间的 AE 总发生率没有差异。接受低剂量或高剂量白蛋白治疗的患者在任何治疗剂量下均未出现与肺水肿或呼吸衰竭相关的AE(图5)。87例(62.1%)被认为是SAE,其中最常见的是:肝性脑病(12例,13.8%)、腹水(6例,6.9%)、胃肠道出血(6例,6.9%;包括3例食道出血)。主要生化指标和血液学指标在不同时间段和不同组别之间无差异。
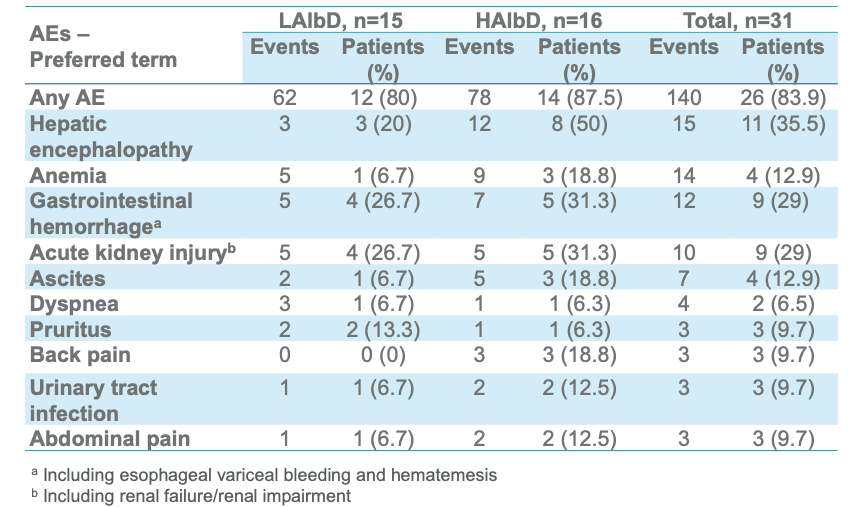
图5 研究期间两组主要的AEs
胃肠道出血和瘙痒这两种不良反应(1.4%)与人血白蛋白治疗有关。
与LAlbD组患者(0%)相比,HAlbD 组患者在研究结束时无腹水的比例更高(42.9%)。基线时,81.25%的HAlbD组患者和86.7%的LAlbD组患者无HE,而在研究结束时,所有患者均无临床HE。
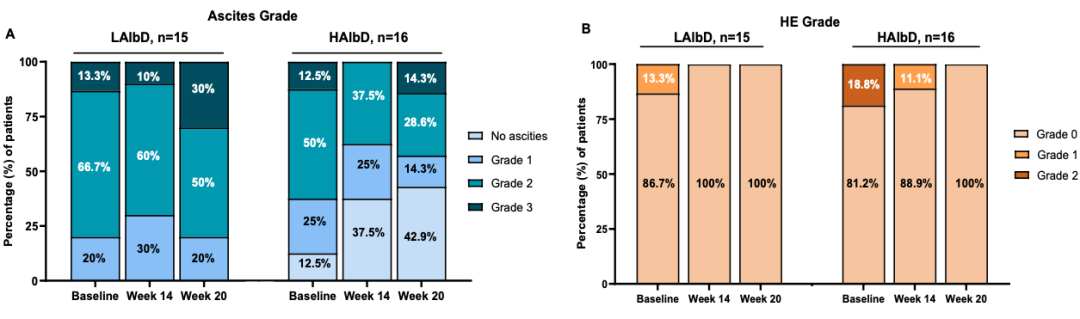
图6.长期人血白蛋白治疗对肝硬化并发症的影响
该研究提示,长期人血白蛋白治疗安全性和耐受性良好,与低剂量相比,高剂量人血白蛋白组无腹水的患者比例更高。
长期输注人血白蛋白似乎是一种有效而安全的治疗方法,可改变病程。可以推测,当人血白蛋白的剂量足够大、持续时间足够长,以恢复该分子的生理水平和可能的功能时,治疗效果就会显现出来[7]。人血白蛋白的作用不仅取决于其绝对水平, 还取决于其在体内发挥的有效功能, 因此有效白蛋白浓度(eAlb)成为更有意义与价值的临床概念。在这个前提下,我们假设短期大剂量给予人血白蛋白治疗应该同样有效。EASL 2024大会的另一项研究验证了这一想法。
WED-120:人血白蛋白短期大量输注可减少全身炎症因子[8]
肝硬化失代偿期的重要特征之一是系统性炎症导致多器官功能障碍。EASL 2024公布了泰国朱拉隆功国王纪念医院的一项前瞻性、开放标签研究,纳入确诊为肝硬化失代偿期伴有腹水的患者,接受大剂量人血白蛋白输注治疗(80g)。假设肝硬化患者接受人血白蛋白治疗的抗炎特性可能部分与1,25 (OH)2 维生素D水平的变化有关,从而影响免疫调节。主要结果是评估输注人血白蛋白前后一周内1,25 (OH)2 维生素D水平和 25(OH) 维生素D水平的变化。次要结果包括评估输注人血白蛋白前后10种炎症因子水平的变化。
本次中期分析报告了17例肝硬化伴腹水患者(酒精相关性肝硬化,n=5例;非酒精性脂肪肝NASH,n=4例;慢性乙型肝炎感染,n=3例)、隐源性肝硬化,n=2例;其他病因n=3例)的数据。
输注人血白蛋白后,1,25(OH)2维生素D水平在一周内显著下降(P=0.011),而25(OH)维生素D水平略有下降(P=0.101),干预后IL-1 beta、IL-6、TNF-α和IFN-gamma水平明显下降(P值分别为0.043、0.037、0.005和0.02)。然而,维生素D水平的变化与细胞因子水平之间没有相关性。
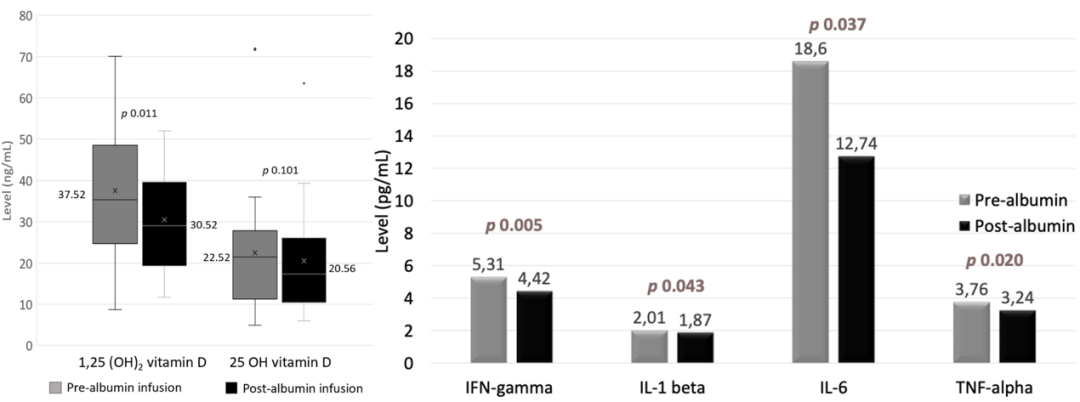
图7 短期大量输注人血白蛋白后1,25(OH)2维生素D与炎症因子水平的变化
失代偿期肝硬化患者短期输注大剂量人血白蛋白后,1,25(OH)2 维生素D和炎性细胞因子水平明显降低。
到这里,我们不得不再次强调eAlb的重要性,即功能完整白蛋白的血浆浓度是决定白蛋白有效性的关键。2021年, Caraceni教授团队提出了"eAlb"量化公式,发现失代偿期肝硬化患者的eAlb明显降低, 验证了白蛋白功能和"eAlb"量化的相关性[9]. 这一发现表明, eAlb是白蛋白发挥生理功能的关键。我们推测,由于现有研究并未根据这一本质性的参数确定人血白蛋白的剂量与用药时长,从而造成了剂量方案和疗效的不一致性。另一方面,目前无法精准测算现有白蛋白制剂中eAlb浓度如何,可能会在未来成为无法精准制定患者个体化人血白蛋白输注方案的障碍之一。
EASL大会历年的研究中都不乏人血白蛋白在肝硬化并发症治疗中显示积极作用的研究,当然也有效果欠佳的研究,这些不一致性也促使我们更为关注背后的“真相”。追求现象背后的本质,是医学科学和临床研究不懈的追求和努力,在未来的探索中,eAlb有可能作为可量化的指标来衡量人血白蛋白治疗的有效性,在此基础上探索更为个体化的治疗方案,使得人血白蛋白的使用更为合理和规范,造福患者。
参考资料:
1.Caraceni, Abraldes, Gines, et al., The search for disease-modifying agents in decompensated cirrhosis: From drug repurposing to drug discovery. J Hepatol, 2021. 75 Suppl 1: p. S118-S134.
2.Biggins, Angeli, Garcia-Tsao, et al., Diagnosis, Evaluation, and Management of Ascites, Spontaneous Bacterial Peritonitis and Hepatorenal Syndrome: 2021 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology, 2021. 74(2): p. 1014-1048.
3.European Association for the Study of the Liver. Electronic address and European Association for the Study of the, EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol, 2018. 69(2): p. 406-460.
4.Pompili, Predictors of ascites resolution in patients with cirrhosis receiving long-term albumin treatment. Results from a real-world study in Italy (Real-ANSWER) EASL 2024 FRI-047-YI.
5.Lombardo, Long-term therapy with intravenous human albumin increase survival in patients with decompensated cirrhosis and refractory ascites EASL 2024 SAT-113
6.Thitaporn Roongrawee1 , , Nunthiya Srisoonthorn3, et al., Safety and tolerability of long-term albumin treatment in patients with decompensated cirrhosis. EASL 2024. FRI-121.
7.Caraceni, O'Brien, and Gines, Long-term albumin treatment in patients with cirrhosis and ascites. J Hepatol, 2022. 76(6): p. 1306-1317.
8.Javier Fernández1, Raquel Horrillo3, and Càndid Villanueva5, Albumin infusion in decompensated cirrhotic patients with ascites induced decreasing serum active form of vitamin D, 1, 25dihydroxy vitamin D, an opposite effect on promoting systemic inflammatory cytokines reduction. EASL 2024, 2024. WED-120.
9.Baldassarre, Naldi, Zaccherini, et al., Determination of Effective Albumin in Patients With Decompensated Cirrhosis: Clinical and Prognostic Implications. Hepatology, 2021. 74(4): p. 2058-2073.


