李吉/邓智利/汪犇/聂青联合团队《自然·通讯》:揭示玫瑰痤疮发病新机制
时间:2024-10-15 12:02:05 热度:37.1℃ 作者:网络
玫瑰痤疮是一种好发于中青年女性、主要累及面部血管及毛囊皮脂腺单位的慢性复发性炎症性疾病,其临床表现主要为阵发性潮红、一过性或持久性红斑、毛细血管扩张、丘疹脓疱等。该病的全球患病率在1%-22%之间不等,国内约为3.48%,即国内有近5000万的患者1-3。玫瑰痤疮患病率高,受众广;其好发于面中部,对患者社交和生活质量产生较大的影响;由于诊疗不规范,误诊误治现象较常见;最重要的是,玫瑰痤疮的发病机制并不明确,以致目前尚无有效的根治方法。因此,探明玫瑰痤疮的发病机制寻找有效的治疗手段具有重要意义。

2024年10月9日,中南大学湘雅医院皮肤科李吉教授、邓智利副研究员、汪犇副研究员和加州大学欧文分校聂青教授联合在《Nature Communications》杂志上发表了题为“Single-cell transcriptomics reveals aberrant skin-resident cell populations and identifies fibroblasts as a determinant in rosacea”的原创性研究成果。该研究利用单细胞转录组学分析联合动物及细胞疾病模型揭示了玫瑰痤疮患者皮肤驻留细胞群的异常改变,及成纤维细胞在该病发生发展中的关键作用及调控机制。
玫瑰痤疮是在一定的遗传背景下,由神经血管功能失调、免疫功能紊乱以及皮肤屏障功能受损等导致的皮肤炎症和血管异常扩张4-9。虽然关于玫瑰痤疮的基础研究越来越多,也从多个方面揭示了玫瑰痤疮的可能发病机制。但是,由于当前的玫瑰痤疮动物模型很难真正模拟玫瑰痤疮的临床症状,这使研究者无法深入揭示皮肤关键细胞群及其亚群在玫瑰痤疮发生发展中的作用,也极大地阻碍了玫瑰痤疮的发病机制研究。随着生物医学研究技术的发展,特别是单细胞转录组测序技术的出现,为深入研究玫瑰痤疮的发病机制提供了一个契机。
为了找到更全面的介导玫瑰痤疮发病的调控机制,研究人员利用健康对照、玫瑰痤疮患者面中部皮损和患者对应耳前正常皮肤进行了单细胞转录组测序。这也是目前首个玫瑰痤疮患者皮肤单细胞数据。首先,研究人员通过降维分析和各类细胞的标志分子鉴定得到11群不同类型的细胞,包括角质形成细胞、成纤维细胞、血管内皮细胞、血管壁细胞和各类免疫细胞等。具体来说,在玫瑰痤疮皮损中:角质形成细胞比例减少、成纤维细胞增加、血管细胞增加;炎症以T细胞和巨噬细胞浸润为主(图1)。随后,对不同类型的细胞进行进一步的鉴定及功能分析发现:CD74+角质形成细胞亚群中IFNγ通路异常活化可能通过抑制皮肤屏障相关分子表达参与玫瑰痤疮的发生发展(图2);C3+成纤维细胞亚群高特异表达多种促炎趋化因子,可能在玫瑰痤疮皮肤炎症产生过程中发挥重要作用(图3);T细胞浸润明显增加,且易向Th1和Th17细胞分化;同时,存在一群疾病特异的记忆T细胞,可能与玫瑰痤疮的易复发特性相关;此外,巨噬细胞浸润增加,且表达多种与T细胞趋化相关的趋化因子;虽然血管壁细胞(血管平滑肌和周细胞)亚群无明显变化,但IL-17等炎症相关通路均明显上调、收缩功能明显下降;同时,存在一群疾病特异的血管内皮细胞和Schwann细胞亚群,其中多种炎症通路明显活化(图4)。
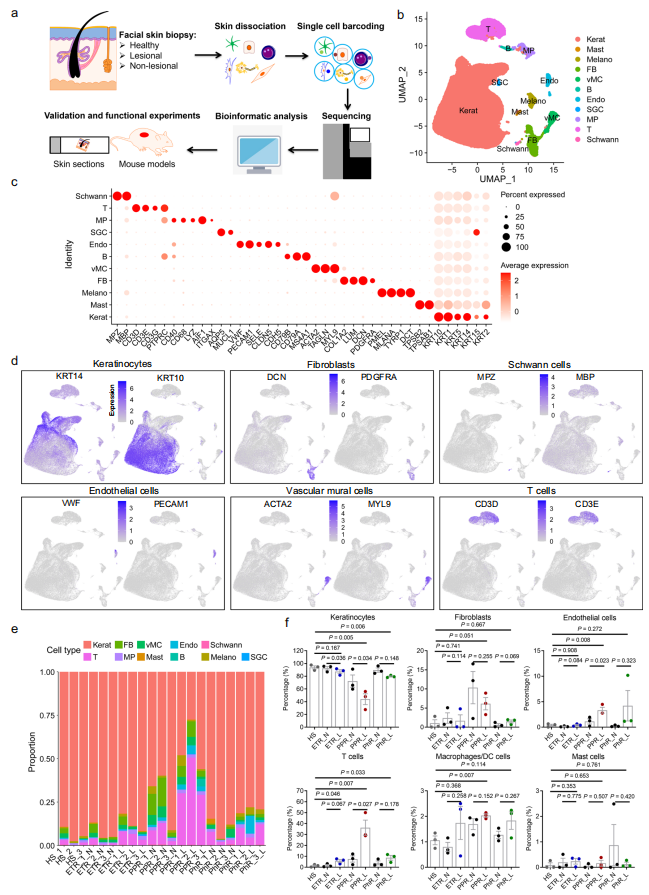
图1. scRNA-seq揭示玫瑰痤疮患者皮损和健康人皮肤中的细胞类型组成
(图源:Chen et al., Nature Communications. 2024)
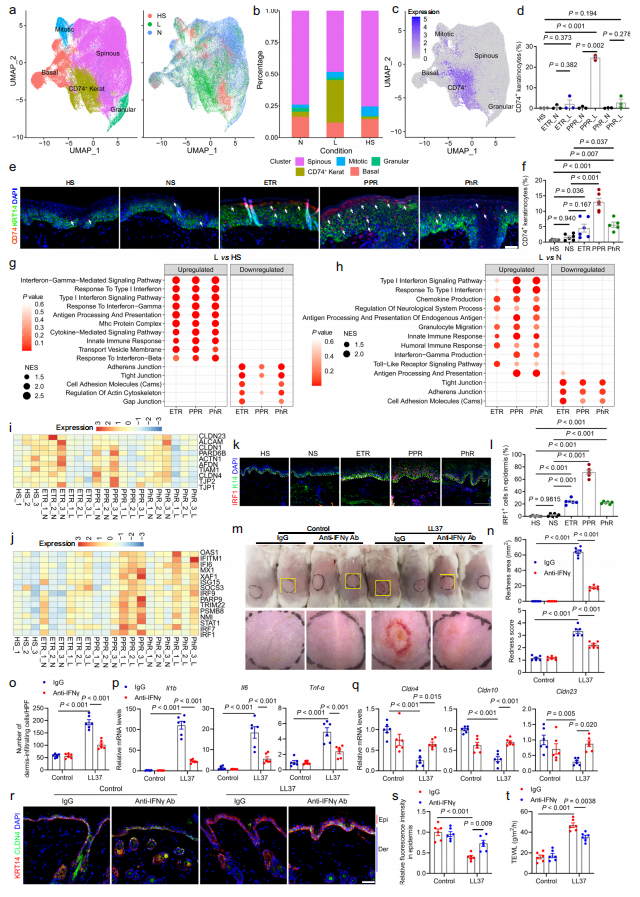
图2. 玫瑰痤疮中角质形成细胞亚群鉴定及功能研究
(图源:Chen et al., Nature Communications. 2024)
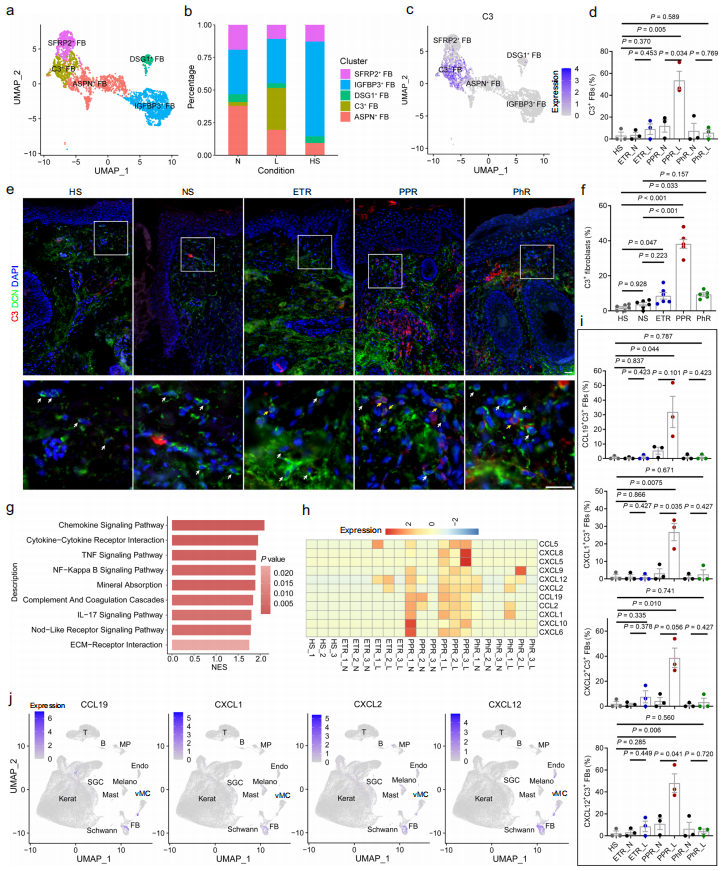
图3. 玫瑰痤疮中促炎成纤维细胞亚群鉴定
(图源:Chen et al., Nature Communications. 2024)
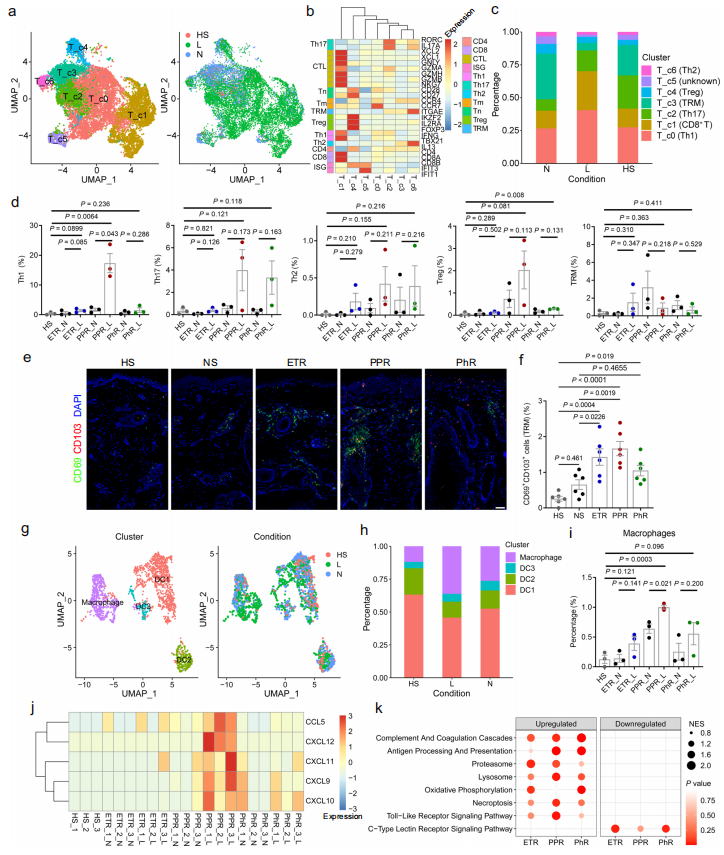
图4. 玫瑰痤疮中免疫细胞组成改变及功能分析
(图源:Chen et al., Nature Communications. 2024)
接着,作者们利用Cellchat分析工具对各类细胞之间的相互作用进行分析,发现在玫瑰痤疮皮损中,皮肤成纤维细胞是最主要的信号输出细胞,且输出信号以炎症和扩血管信号为主,而巨噬细胞、血管内皮和血管壁细胞、T细胞、角质形成细胞和B细胞是皮肤成纤维细胞输出信号的主要接收细胞,这提示皮肤成纤维细胞可能在玫瑰痤疮发病中发挥关键作用(图5)。为进一步研究成纤维细胞在玫瑰痤疮发病中的作用,作者们构建了局部特异清除成纤维细胞与局部敲降成纤维细胞特异高表达的关键分子Ptgds的小鼠模型,并通过一系列体内外实验证实,皮肤成纤维细胞可通过PTGDS等关键分子诱导皮肤炎症和血管异常扩张,从而参与玫瑰痤疮的发生发展(图6)。
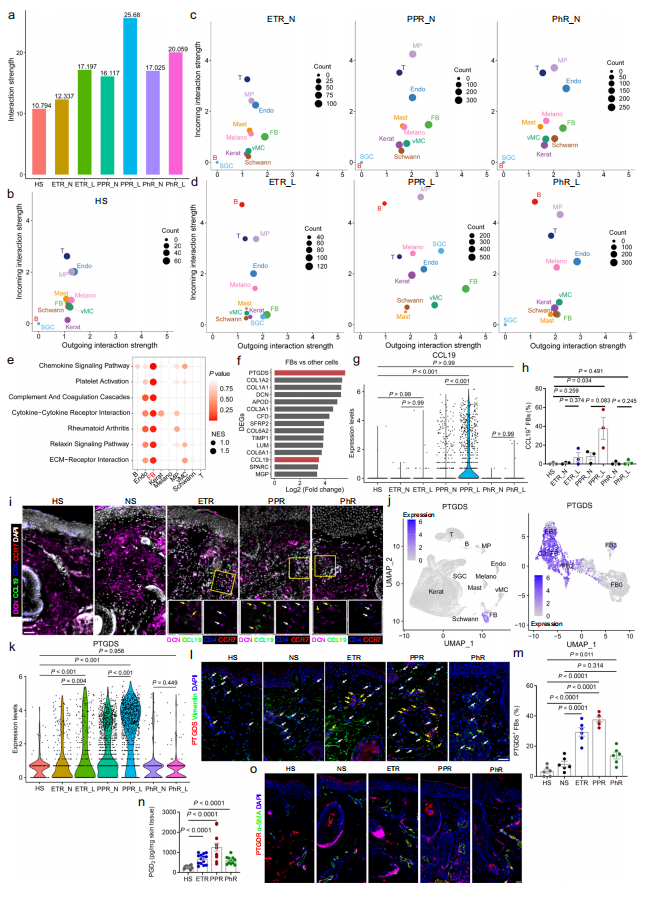
图5. 成纤维细胞是玫瑰痤疮皮损中的主要信号输出细胞
(图源:Chen et al., Nature Communications. 2024)
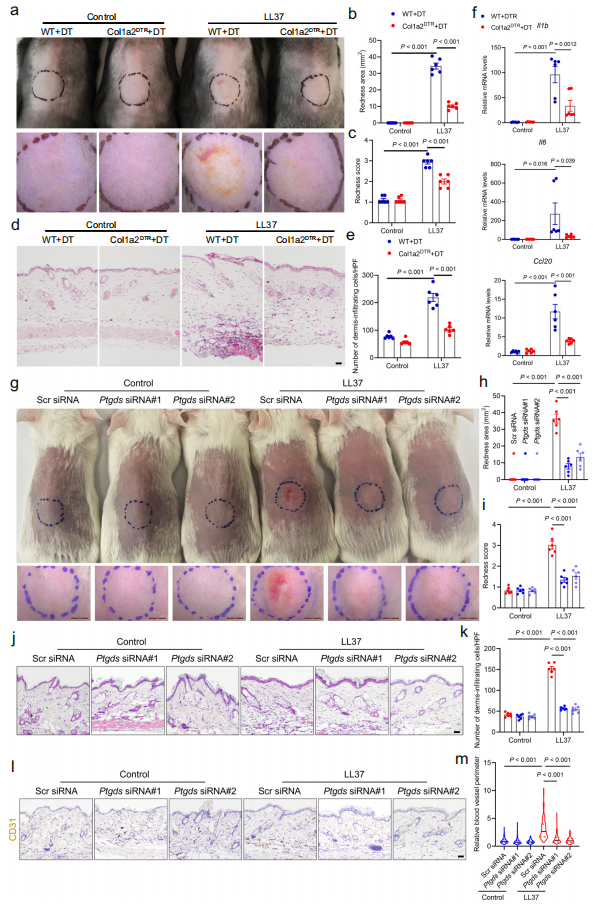
图6. 成纤维细胞对玫瑰痤疮的发生发展至关重要
(图源:Chen et al., Nature Communications. 2024)
综上所述,此研究从皮肤屏障破坏、免疫调控紊乱和成纤维细胞异常等方面揭示了玫瑰痤疮发病的新机制,特别是成纤维细胞在该病中的关键作用,为该病的临床治疗提供新思路与潜在治疗靶点。
中南大学湘雅医院李吉教授、邓智利副研究员、汪犇副研究员和美国加州大学欧文分校聂青教授为共同通讯作者,中南大学湘雅医院陈梦婷助理研究员和杨李助理研究员为该文章共同第一作者。本研究受到国家自然科学基金杰出青年基金项目、优秀青年基金项目、面上项目和湖南省优秀青年基金等项目资助。
参考文献
1、van Zuuren, E. J. Rosacea. N. Engl. J. Med. 377, 1754–1764 (2017).
2、Gether, L., Overgaard, L. K., Egeberg, A. & Thyssen, J. P. Incidence and prevalence of rosacea: a systematic review and meta-analysis. Br. J. Dermatol. 179, 282–289 (2018).
3、 Li, J. et al. Epidemiological features of rosacea in Changsha, China: a population-based, cross-pal study. J. Dermatol. 47, 497–502 (2020).
4、 Buddenkotte, J. & Steinhoff, M. Recent advances in understanding and managing rosacea. F1000Res 7, F1000 Faculty Rev-1885 (2018).
5、 Medgyesi, B. et al. Rosacea is characterized by a profoundly diminished skin barrier. J. Invest. Dermatol. 140, 1938–1950.e1935 (2020).
6、 Deng, Z. et al. Claudin reduction may relate to an impaired skin barrier in rosacea. J. Dermatol. 46, 314–321 (2019).
7、Steinhoff, M. et al. Clinical, cellular, and molecular aspects in the pathophysiology of rosacea. J. Investig. Dermatol. Symp. Proc. 15, 2–11 (2011).
8、 Deng, Z. et al. A positive feedback loop between mTORC1 and cathelicidin promotes skin inflammation in rosacea. EMBO Mol. Med. 13, e13560 (2021).
9、 Liu, T. et al. Aberrant amino acid metabolism promotes neurovascular reactivity in rosacea. JCI Insight 7, e161870 (2022).
原文链接:
https://www.nature.com/articles/s41467-024-52946-7.


