【Blood】How I Treat继发性急性髓系白血病
时间:2024-10-17 15:01:23 热度:37.1℃ 作者:网络
继发性急性髓系白血病(sAML)传统上用来指任何由先前的血液系统疾病或先前的细胞毒性或放疗引起的AML。在2016年WHO分类中,sAML包括两个亚型:AML伴MDS相关改变(AML-MRC)和治疗相关性髓系肿瘤,后者包括治疗相关性AML (tAML)和治疗相关性MDS (tMDS)。
在过去几年中,对sAML的生物学和分子基础的理解大大扩大,并反映在目前的2022年WHO分类和ICC分类中。多种不同的突变(ASXL、BCOR、EZH2、SF3B1、STAG2、U2AF、ZRSR2)几乎只在sAML中发现,而非de novo AML中(FLT3、NPM1、DMT2A)。根据“突变定义”的sAML患者在强化疗后的生存期比de novo AML 患者更差,并且与根据临床病史诊断的sAML患者相似;还反映在2022年ELN预后分类中,其中以继发性突变事件为特征的AML认为是“高危”。在2022年 WHO 分类中,根据细胞遗传学和/或存在继发性突变(还需要既往有MDS 或MDS/MPN病史),将“AML-MRC”替换为新的亚型,称为“骨髓增生异常相关AML”(AML myelodysplasia-related,AML-MR)(表1A-B)。术语“继发性”现在重新命名为治疗相关性髓系肿瘤 (t-MN),包括细胞毒化疗后髓系肿瘤 (MN-pCT) 或由确定的生殖系倾向演变而来(表1)。对于现有MPN 马上发生或明显发生白血病转化的患者,根据原始细胞5-19%定义为加速期 (MPN-AP)或根据原始细胞≥20%定义为急变期(MPN-BP)。

由于人口老龄化和因其他医疗条件而接受DNA损伤剂治疗的患者寿命延长,sAML的发病率也在稳步上升,目前约占所有新诊断AML的25-30%。sAML多呈高危表型,大多数患者接受标准治疗后的预后欠佳,劣于de novo AML,而通过一线化疗和造血干细胞移植(HSCT)可以获得最佳预后。
尽管自2017年以来批准了大量用于AML的新药,但许多药物要么不适用于sAML(即缺乏可靶向突变),要么疗效有限,要么尚未在这些特定亚型中进行研究。此外,这些患者在临床试验中的代表性不足,因此迫切需要新的治疗方案。
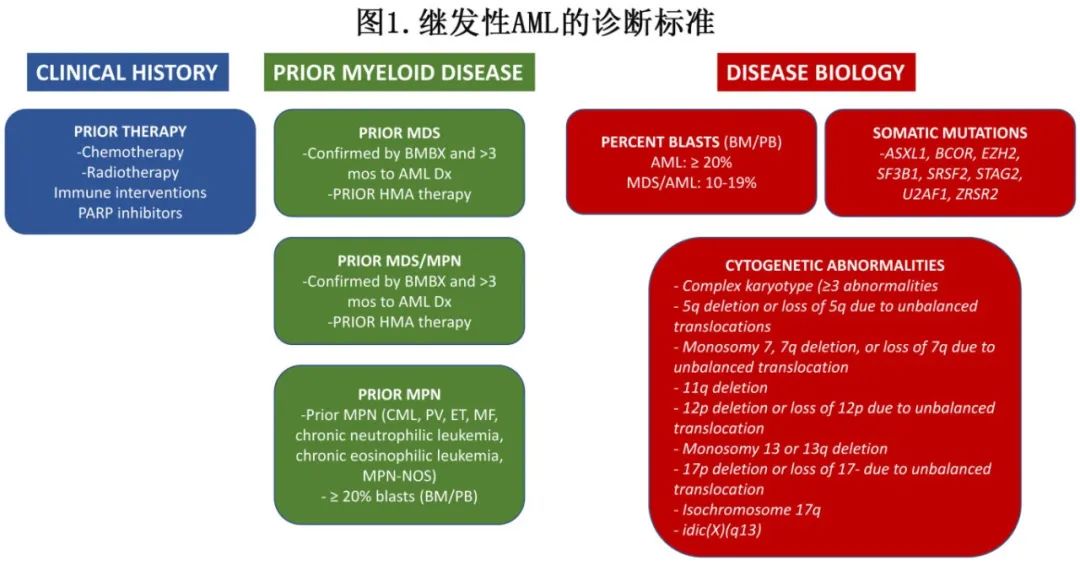
由于sAML属于异质性疾病且命名和标准不断变化,对sAML的诊断也具有挑战性。理想情况下所有疑似AML患者都应接受详细的诊断检查,包括病史、体格检查和骨髓样本的组织病理学分析、流式细胞术、细胞遗传学和突变谱分析。图1总结了当前sAML的诊断标准,包括既往骨髓毒治疗史、既往髓系疾病(MDS,MPN)、疾病负荷(原始细胞≥20%)及特定的核型和体细胞突变。
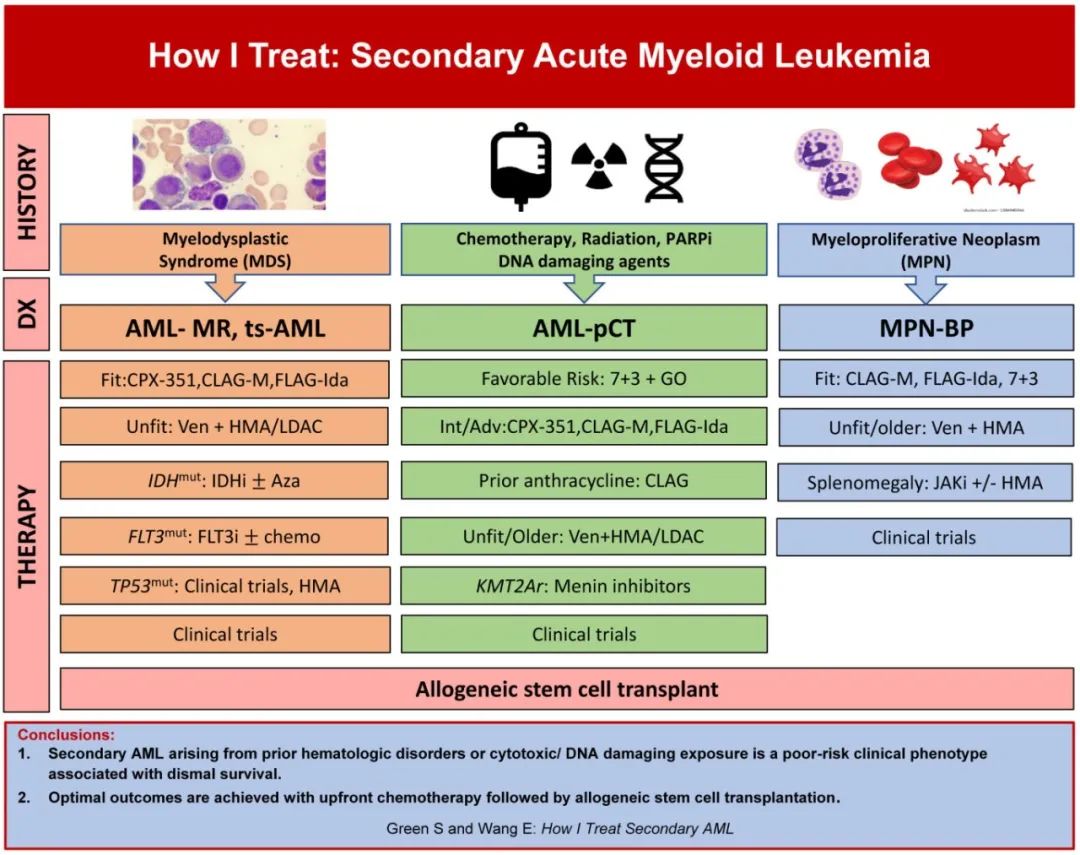
《Blood》近日发表罗斯威尔公园综合癌症中心Steven Green和Eunice Wang教授的综述“How I Treat: Secondary Acute Myeloid Leukemia”,通过多个病例呈现新的sAML分类,并强调了由先前MDS、MPN和细胞毒性治疗引起的sAML的不同临床表现,还为每种情况提供了治疗方案,也讨论了当前治疗的挑战。
病例1
患者为无明显既往病史的57岁男性,一直感觉不适,有显著贫血、血小板减少,外周血原始细胞36%。骨髓活检(BMBx)显示AML伴单核细胞分化。在两系>50%的细胞中检测到异型增生。细胞遗传学检查示核型正常。二代测序显示IDH2、SRSF2和STAG2突变。接受CLAG-M (克拉屈滨、阿糖胞苷、G-CSF、米托蒽醌)治疗并获得完全缓解(CR),通过流式细胞分析无可测量残留病变(MRD)。进行相合非亲缘清髓性异基因HSCT,现在无病生存。
Fit的AML-MR患者的治疗
这名年轻患者诊断为AML-MRC(根据2016年WHO)和AML-MR伴典型体细胞突变(SRSF2、STAG2)(AML-MR with defining somatic mutations)(根据2022年WHO)。由于正常核型和缺乏先前血液学疾病,其预后为中等(ELN 2017)或高危(ELN 2022),从而突出了在决定AML的治疗之前迅速获得完整的细胞遗传学和分子学信息的关键需求,否则的话患者可能无法从包括临床试验在内的sAML特异性治疗中获益。
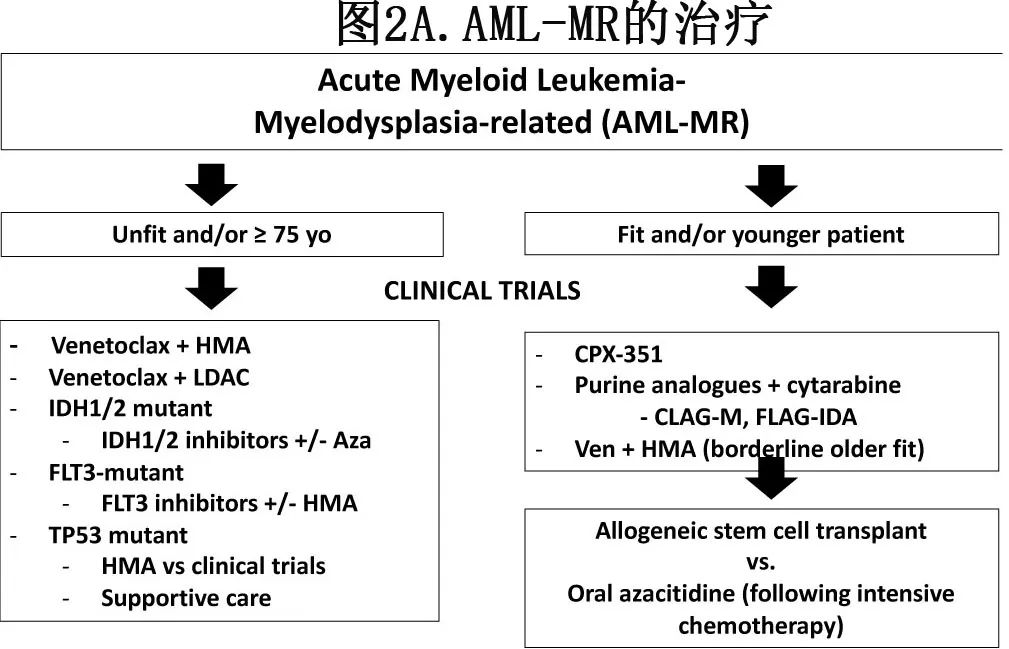
虽然作者对fit AML-MR患者的治疗(图2A)倾向于强化疗序贯HSCT,但最佳一线治疗仍存在争议。多项研究表明阿糖胞苷和蒽环类药物为基础(7+3)化疗治疗sAML的疗效不佳,完全缓解(CR) +完全缓解伴血液学不完全恢复(CRi)率为30-50%,中位总生存期(OS)为6-7个月,而HSCT可改善7+3后的生存期,中位OS为1.5年。
目前唯一获批治疗fit的AML-MR的药物为CPX-351,它是一种阿糖胞苷和柔红霉素以固定的5:1摩尔比的脂质体制剂。在一项纳入60-75岁新诊断tAML、慢性髓细胞白血病(CMML)或AML-MRC的患者且CPX-351对比7+3诱导的3期研究中,CPX-351显著改善中位OS(9.56 vs 5.95个月;p=0.003)和CR/CRi率(47.7% vs 33.3%;P=0.016)。副作用包括脱发和黏膜炎、长期骨髓抑制和皮疹,费用也高于7+3。CPX-351组更多患者桥接HSCT,事后分析表明,一线CPX-351后HSCT的OS改善,主要是由于较低的非复发死亡率和复发率。虽然未使用AML-MR的突变定义,但推断CPX-351也适用于这些患者。虽然未评估MRD,但MRD与更好的疾病控制一致。对于不适合移植的强化疗患者,作者倾向于口服阿扎胞苷维持治疗。虽然CPX-351的批准与年龄无关,但该试验仅入组≥60岁的患者,因此NCCN将7+3列为年龄<60岁的“首选”;但两项回顾性研究表明CPX-351在年轻患者中具有类似的结果。作者目前正在开展一项前瞻性2期研究,旨在解决该问题(NCT04269213)。
在AML-MR和高危非TP53突变AML患者中,采用嘌呤类似物联合大剂量阿糖胞苷的一线方案也可较7+3获得更高的缓解率和更长的的OS。在MRC AML15研究中,年轻sAML患者(n=115)随机分配到FLAG-IDA(氟达拉滨、阿糖胞苷、伊达比星和G-CSF)和7+3为基础的治疗(阿糖胞苷、柔红霉素+/-依托泊苷)。虽然缓解率相同(81% vs 79%),但5年OS(37% vs 27%,p=0.02)和无复发生存率(41% vs 22%;p=0.04)均为FLAG-Ida组更优。MRC AML19研究将高危AML和高危MDS患者随机分配接受强化疗中,分析表明临床上FLAG-IDA或MDS细胞遗传学患者CPX-351和FLAG-IDA治疗后在OS或无事件生存期方面没有差异。然而亚组探索性分析发现,在伴有MDS相关突变的AML患者中,CPX-351比FLAG-IDA有OS获益(HR=0.42,p=0.05)。在sAML (n=7)和tAML (n=5)患者中,将维奈克拉加入FLAG-IDA中,CRc率为83%,MRD阴性反应为90%,中位OS尚未达到;该结果与de novo AML无统计学差异,但作为单学术中心结果,有待在其他中心和更多患者中进一步证实。来自其他研究机构的回顾性数据也表明,与7+3相比,CLAG-M(克拉屈滨、阿糖胞苷、G-CSF、米托蒽酮)治疗年轻sAML患者的反应明显改善。但仍不确定与CPX-351相比,哪些患者可从嘌呤类似物联合强化阿糖胞苷方案中获益。对于一个强化诱导周期后未达到CR的患者,可以给予第二个周期;但作者经常考虑改用维奈克拉联合去甲基化药物(Ven/HMA)来保持体能状态,并挑战使用不同机制的药物。
突变谱显著影响治疗。TP53突变在AML-MR中很常见,并赋予对强化和Ven/HMA化疗的耐药性。TP53突变AML(特别是双等位基因TP53突变、高变异等位基因频率或复杂核型)的患者预后尤其差,存在高度未满足的需求。对于TP53突变的fit患者,作者倾向于给予强化疗(FLAG-IDA、CLAG-M)或Ven/HMA而非AZA单药,以更快地实现疾病控制并在首次CR期HCST;而CPX-351似乎无优势。
在FLT3突变AML-MR中,CPX-351治疗后的缓解率仍然高于7+3 (CR/CRi 68.2% vs 23.8%),事后分析显示CPX-351治疗后的生存率有提高的趋势。评估CPX-351联合midostaurin治疗FLT3突变AML(主要为de novo AML)的1b期V-FAST研究显示耐受性良好及CR率80%。如果存在FLT3突变,可考虑在诱导的第1周期第8天加入FLT3抑制剂(quizartinib用于FLT3-ITD,midostaurin用于FLT3-TKD)。
病例2
患者为69岁女性,既往有COPD和心脏起搏器病史,因贫血就诊。BMBx显示为MDS伴原始细胞增多,原始细胞为6%。细胞遗传学检查示正常核型。二代测序发现BCOR、RUNX1和SF3B1基因突变。患者接受阿扎胞苷治疗。4周期后BMBx再分期显示原始细胞3%。12个周期后出现进行性贫血和血小板减少。重复BMBx显示骨髓细胞增多伴三系增生,原始细胞21%,提示AML转化。染色体核型仍正常。NGS检测出与CEBPA和KMT2A新发突变相同的突变。患者接受维奈托克和地西他滨治疗。第21天的BMBx显示骨髓细胞30%,原始细胞2%。患者的血细胞计数恢复时间较长。第42天重复BMBx显示骨髓细胞10%,原始细胞1%。流式MRD为0.2%。计划继续Ven/Dec,将维奈克拉的持续时间减少到10-14天,并在更多周期后重复MRD检查。患者继续接受HSCT评估。
先前MDS引起的unfit AML患者的治疗
该老年患者诊断为AML-MRC(2016年WHO)和AML-MR伴典型体细胞突变且既往存在MDS(2022年WHO)。该患者属于高危(ELN 2022)。对于unfit AML-MR患者,作者推荐以维奈克拉为基础的低强度治疗;也将这些方案用于临界fitness或伴医学合并症的患者,以尽量减少治疗相关毒性,并保持功能状态用于治愈性HSCT。在前瞻性研究中,HMA单药治疗的总体结果较差。在VIALE-A研究中,sAML患者接受维奈克拉+阿扎苷(Ven/AZA)治疗的中位OS为16.4个月,而安慰剂/AZA治疗的中位生存期为10.6个月;CR/CRi率分别为66.7%和22.9%。比较Ven/HMA与强化疗的回顾性研究显示结果相似,但有待前瞻性研究进行验证。对于年轻MDS/AML患者(原始细胞10-19%),作者更倾向于Ven/HMA而非强化诱导治疗,以保持心脏和其他器官功能,并在HSCT前将治疗相关死亡率和发病率降至最低。维奈克拉联合低剂量阿糖胞苷(ven/LDAC)是frail的sAML患者的另一种选择,基于其耐受性略好和可在家庭自我给药。在VIALE-C研究中,AML-MR患者接受Ven/LDAC的中位OS长于安慰剂/LDAC(5.5个月 vs 3.2个月),CR/CRi率分别为36%和4%。
先前广泛暴露于HMA的MDS后出现的sAML患者,称为经治继发性AML或ts-AML,与既往未经HMA治疗的患者相比,其生存期(4.2个月)和CR(32%)显著较差(与年龄、细胞遗传风险或治疗强度无关),存在高度未满足的需求。年龄较大/健康状况较差的患者构成ts-AML的大多数,对于这部分患者作者倾向于以维奈克拉为基础的方案,主要是基于回顾性研究,因为ts-AML患者被包括VIALE-A在内的许多研究所排除。在526例ts-AML患者中,Ven/HMA相对于不含维奈托克的强化/低强度治疗,具有更高的CR/CRi率(39% vs 25%;p=0.02)和1年OS(34% vs 17%;P=0.05)。Ven/HMA在先前HMA失败的高危MDS患者(目前符合MDS/AML的ICC标准)中的令人鼓舞的结果进一步支持该方案在ts-AML中的疗效。考虑到HMA耐药可能会减弱反应,尽管数据有限,但作者经常根据经验切换HMA,即在既往广泛AZA暴露患者中使用地西他滨(DEC)和维奈克拉,或给予Ven/LDAC。事实上,VIALE-C研究中Ven/LDAC治疗的结果比VIALE-A患者中Ven/AZA结果差的主要原因在于前者允许ts-AML而后者不允许。在VIALE-C研究中,ts-AML患者占所有患者的20%,Ven/LDAC和LDAC治疗后中位OS分别为5.6个月和4.1个月,CR/CRi分别为28.6%和7.1%。
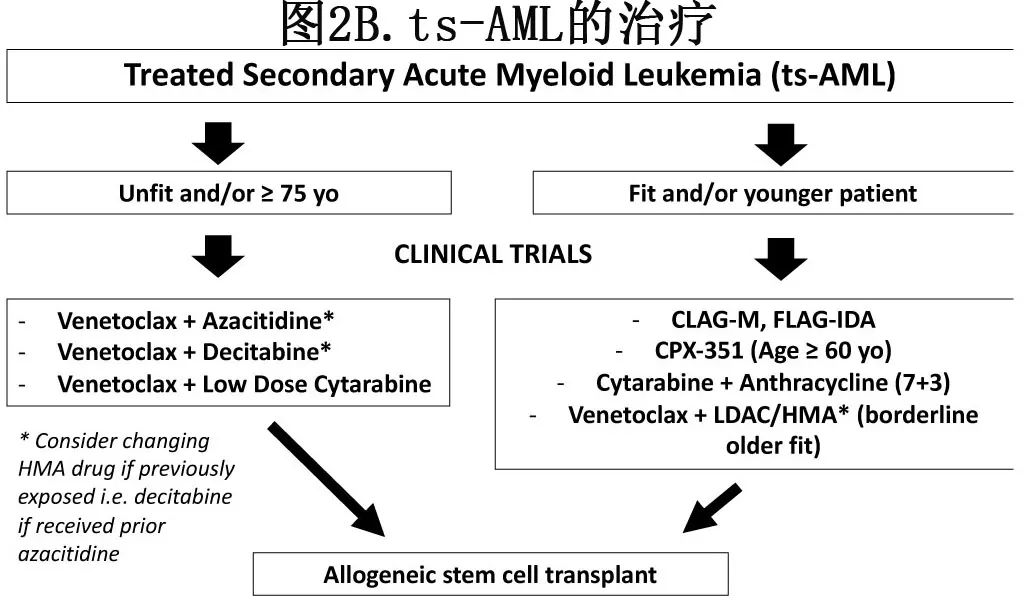
在年轻、fit的ts-AML患者中,作者的方案(图2B)包括使用嘌呤类似物(即CLAG-M、FLAG-IDA)进行强化疗,后者是基于CPX-351与7+3相比缺乏优势,以及CLAG-M具有高缓解率。回顾性分析认为该人群中7+3治疗预后不佳。值得注意的是,在CPX-351对比7+3的3期研究中,接受两种治疗的ts-AML患者的结果没有差异(中位OS分别为5.65个月和7.43个月)。CLAG-M更有价值。在242例接受强化方案治疗的ts-AML患者中,CLAG-M、7+3和CPX-351的CR/CRi率分别为53%、32%和41.2%,但中位OS(7个月)无显著差异。CLAG-M治疗41例ts-AML和不良核型患者,CR/CRi率为64%,中位OS为8.5个月(表2)。
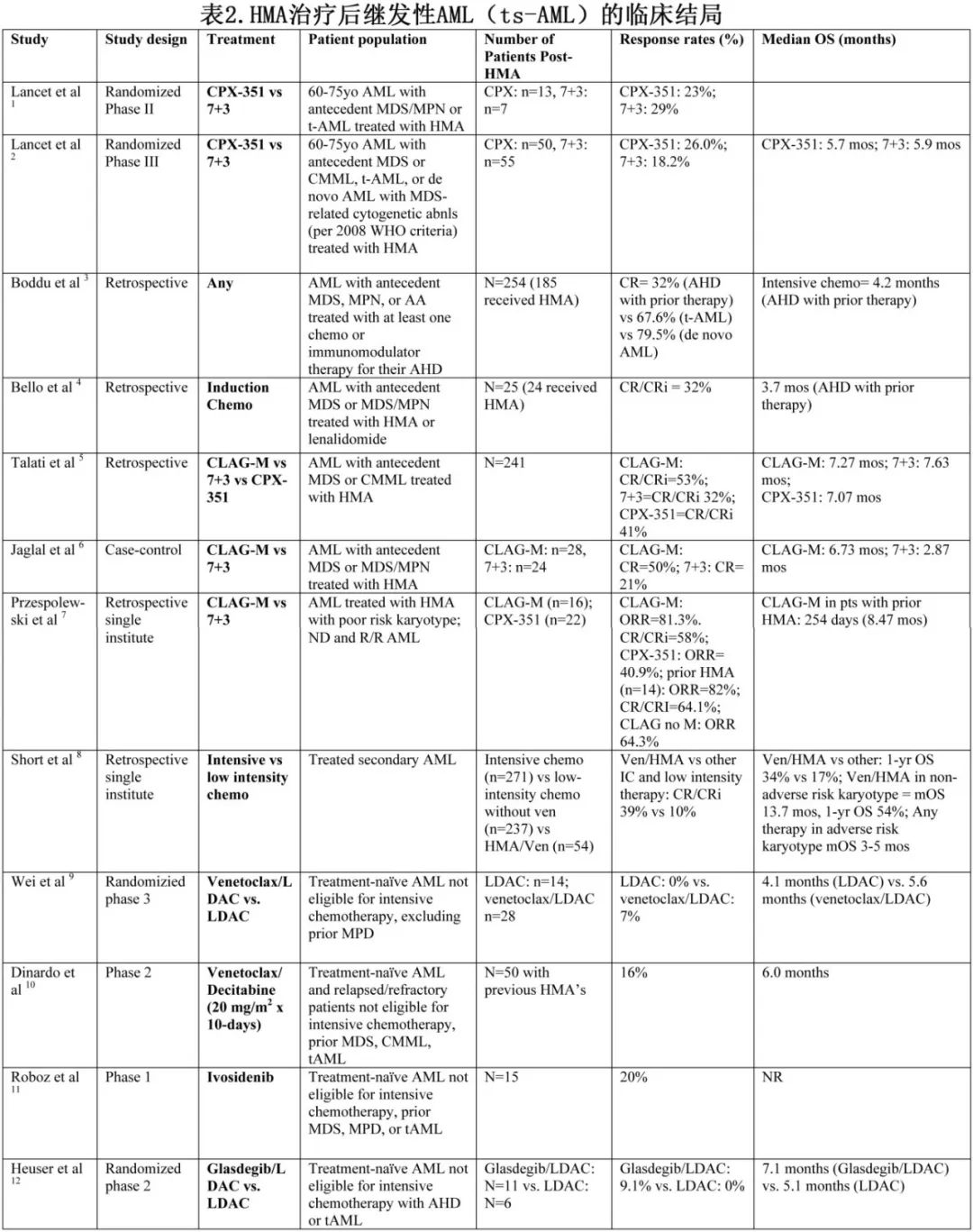
重要的是,ts-AML患者通常被明确排除在临床试验之外(因此在临床试验中的代表性大大不足)。事实上强化疗和Ven/HMA治疗高危核型和TP53突变ts-AML均无效(中位OS 2-3个月)。ts-AML患者应优先进行早期治疗,甚至是一线治疗(表3)。
突变状态,特别是是否存在“可作为治疗靶点”的突变,在治疗选择中占有重要地位,尤其是对于frail患者。unfit/临界状态的IDH1 /2突变AML-MR患者可能从IDH抑制剂(IDHi)为基础的治疗方案中获益,并根据患者的frailty和是否适合移植调整治疗强度。例如对于无法接受每日HMA治疗或频繁输液的患者,作者倾向于将艾伏尼布(IVO)作为IDH1突变sAML患者的单药治疗;与Ven/HMA相比,作者同样更倾向于IVO联合AZA。尽管未在随机对照研究中进行比较,但 AGILE 研究中的 IVO/AZA与 VIALE-a 研究中的 Ven/AZA 相比,无事件生存期 (HR=0.33) 和中位OS(24 vs 7.9个月;p=0.0005)更优且骨髓抑制更少。对于不适合异基因移植的TP53突变sAML患者,应优先考虑临床试验、HMA单药治疗或支持治疗。对于特定患者作者会考虑Ven/HMA,他们可获益于从 ANC 恢复、输血非依赖和/或考虑后续 HSCT。
病例3
患者为60岁男性,有真性红细胞增多症病史,因血细胞计数下降就诊。外周血循环原始细胞11%,BMBx示骨髓显著细胞(>95%)、多系发育不良、中度网状蛋白纤维化和原始细胞~24%,与AML转化一致。细胞遗传学检查:46,XY,i(17)(q10)[20]伴17q三体,17p单体伴1个TP53基因位点缺失。二代测序报告ASXL1、JAK2 V617F、RUNX1、SRSF2和TET2突变。参加一项临床研究,该研究将年轻高危AML患者随机接受7+3或Ven/HMA诱导,并计划在CR1期HSCT。患者接受Ven/AZA治疗,D21 BMBx显示原始细胞2%,存在持续的细胞遗传学异常。第3个周期后,第6周时血细胞计数仍未恢复到足以开始下一个周期,并且外周原始细胞为11%。由于心包积液和胆红素升高导致推迟移植,因此完成另外七个周期的Ven/AZA治疗,且因血细胞导致治疗周期之间的长期延迟。随后患者出现明显复发,骨髓原始细胞占40~50%。考虑到身体状况和治疗目标,患者选择回家接受临终关怀。
先前MPN引起的sAML的管理
该老年患者诊断为AML-MRC(2016年WHO)和基于细胞遗传学和突变谱为AML-MR(2022年WHO),并基于复杂细胞遗传学和体细胞突变(ASXL1, SF3B1)为ELN 2022高危。考虑到临床病史,最合适的诊断为急变期MPN(原始细胞≥20%)(WHO 2022)。
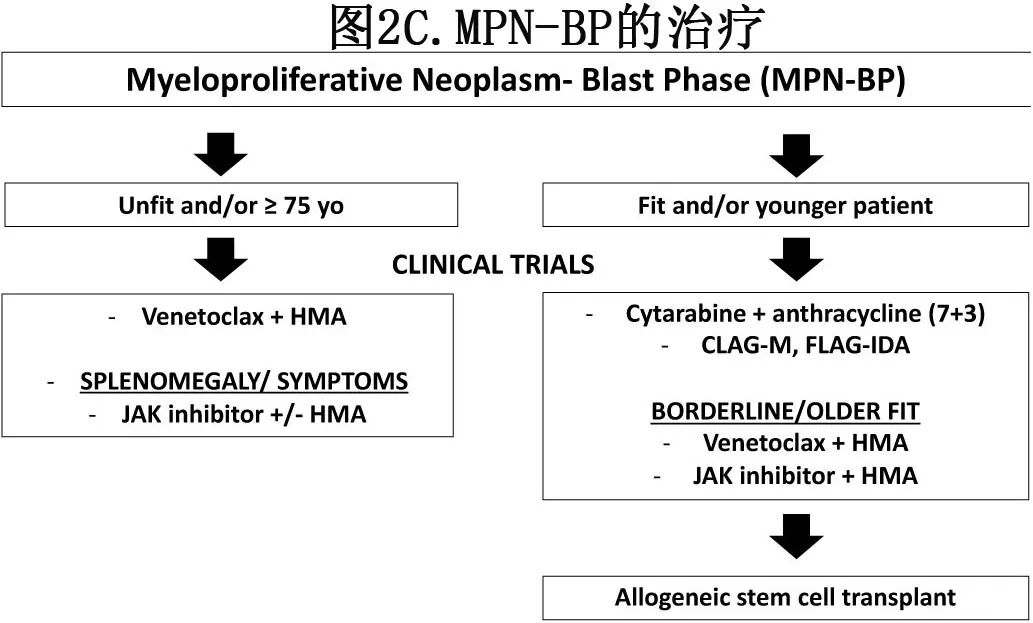
MPN-BP的预后极差,中位OS仅为~3-5个月,HSCT的预后最佳,3-5年生存率为~30%。作者的治疗方案(图2C)类似于AML-MR,但有一些重要的注意事项。对于适合HSCT的年轻、fit患者,作者倾向于强化诱导以获得更高的CR率;但由于CPX-351在sAML中具有里程碑意义的3期研究未纳入MPN-BP患者,其获益尚不清楚。值得注意的是,不进行HSCT的强化疗与更高的治疗相关死亡率(15-33%)相关,并且与非强化疗相比,似乎并没有改善预后。该患者参加了一项比较两种方案的随机研究。考虑到总体预后不良和HSCT前需要的缓解程度不明确,作者支持在一线治疗未达到最佳缓解后直接进行移植,该方案得到非低危AML患者的随机3期研究的支持。
考虑到强化疗的局限性和毒性,作者倾向于对大多数MPN-BP患者进行低强度治疗,包括适合移植的老年临界fit患者,以及不unfit患者。在回顾性分析中,HMA单药治疗的中位OS为5-11个月,CR/CRi率为4-30%。然而,由于许多长期JAK抑制剂(JAKi)的患者停止治疗会导致全身症状的严重复发和/或脾增大,因此在部分患者中,继续使用先前的JAKi并添加HMA可能比Ven/HMA更好。
在HMA治疗中一线还是序贯加入芦可替尼,需取决于患者的症状负荷、脾肿大、是否适合移植和先前JAKi治疗。例如,如果患者有巨大的脾肿大,以前没有使用过JAKi,并且适合移植,可考虑一线HMA中加入芦可替尼以促进植入并改善体能状态。DEC和芦可替尼在MPN-AP/BP的1期和2期试验中进行了研究,2/25(8.1%)的患者达到CR/CRi,中位OS为9.5个月,脾脏减少70.5%,2例患者(8%)接受了移植;缓解率和生存率之间无明显相关性。另外两项早期研究使用芦可替尼联合DEC或AZA,在生存方面取得非常相似的结果,但缓解率差异很大。一项荟萃分析发现,HMA联合芦可替尼治疗MPN-AP/BP患者的总缓解率(ORR)高于HMA单药治疗(45% vs 30%,p=0.0395),与HMA单药治疗相比的CR/CRi率有改善的趋势,生存期有延长的趋势。由于芦可替尼的一个主要问题为显著骨髓抑制,考虑到其缺乏持久缓解,因此因重度血细胞减少而减量药物是合理的。评估其他JAK抑制剂与HMA的临床试验正在进行中(表3)。
尽管评估Ven/HMA和Ven/LDAC的具有里程碑意义的临床研究均排除MPN-BP患者,但Ven/HMA仍是一种选择。总体而言,Ven/HMA治疗MPN-BP的CR/CRi率似乎比单独HMA患者高(~40%),但中位OS相似(6-9个月)。MPN-AP/BP患者的荟萃分析发现,Ven/HMA的CR/CRi率高于单独HMA (36% vs 19%,p=0.0204),CR率高于HMA+芦可替尼(22% vs 8%,p=0.0313),因此可能提高HSCT率。然而与其他AML亚型不同,MPN-BP无明确的BCL-2依赖性,这解释了为什么维奈克拉与单独HMA相比无显著生存获益。虽然接受HSCT的患者的预后不会受到先前低强度治疗的不利影响,但长期血细胞减少导致感染和出血性并发症普遍存在。优化患者选择和微调Ven/HMA的剂量和持续时间至关重要。
尽管IDHi的研究获得了新的结果,但目前没有足够的数据对MPN-AP/BP的靶向治疗提出明确建议,在这些患者中开展的临床试验正在增多,关注生存终点(而非缓解深度等弱可靠的替代终点)可能会带来获益(表3)。
病例4
患者为63岁女性,有浆液性卵巢癌病史,最近从佛罗里达州旅行回来,呈气短、耳鸣、头晕和间歇性心悸加重。患者的卵巢癌在接受5个周期的卡铂和紫杉醇治疗,以及随后的2年奥拉帕利维持治疗后处于缓解状态。实验室检查显示重度全血细胞减少,外周血原始细胞3%。骨髓活检显示AML伴71%成髓细胞。细胞遗传学为7号单体。髓系基因检测提示ASXL1突变。患者接受CPX-351诱导治疗,伴发热性中性粒细胞减少和长期血细胞减少。重复骨髓经流式细胞术显示MRD阴性骨髓形态学缓解。患者接受巩固化疗并进行相合非亲缘HSCT。
先前使用细胞毒药物后治疗相关性AML的治疗
根据2022年WHO,该患者的诊断为细胞毒性治疗后AML (AML-pCT),定义为先前细胞毒或放疗后发生的AML;根据2016年WHO中则为治疗相关性AML (tAML)。AML-pCT是一种多样性疾病,来自预先存在的克隆性造血与骨髓毒药物对造血干细胞和骨髓微环境造成的损伤之间的相互作用。导致AML-pCT的传统暴露包括烷基化剂/电离辐射和拓扑异构酶II抑制剂,前者与AML伴5号和7号染色体畸变、复杂核型和p53突变相关,后者可导致AML伴KMT2A重排、t(15;17)和RUNX1突变。然而少数AML-pCT患者缺乏这些异常,实际上可能具有低危(即CBF)或中危(即正常核型)细胞遗传学和分子学风险疾病(ELN 2016/2022)。此外,2022年WHO现在也将PARP抑制剂等非经典DNA损伤疗法作为AML-pCT的合格标准。
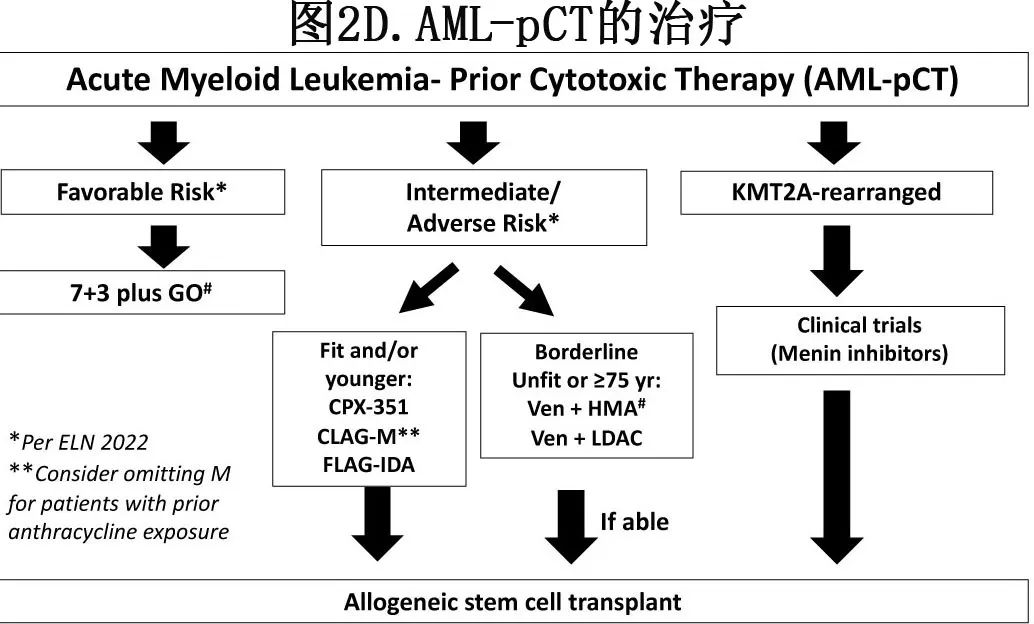
鉴于疾病的异质性和对缺乏大型sAML研究数据,作者对AML-pCT患者的治疗方案(图2D)更侧重于基础的疾病生物学。尽管AML-pCT和AML-MR之间的细胞遗传学和分子学异常有明显重叠,特别是既往MDS的患者,但并非所有患者都如此。由于AML-pCT的命名是基于临床病史而非内在生物学,部分AML-pCT实际上可能是由偶然和/或的常见致癌因素(不依赖于既往治疗)引起的de novo AML,从而偶尔会导致预后和治疗强化。例如,与“真正的”AML-pCT相比,NPM1突变AML-pCT在临床和生物学上更接近于伴随细胞毒治疗的de novo AML,因此不被认为是不良预后。值得注意的是,关于sAML突变是否会对接受强化疗的NPM1突变AML患者的预后产生负面影响,回顾性分析结果存在分歧。尽管核心结合因子(CBF) AML-pCT的预后优于中危或高危AML-pCT,但匹配分析表明,“治疗相关”CBF AML的预后比de novo CBFAML更差,可能是由于患者年龄较大和附加的隐匿性突变。尽管如此,对于低危AML-pCT患者(即以RUNX1::RUNX1T1、CBFB::MYH11或NPM1突变AML为特征,无高危突变),作者倾向于给予7+3和gemtuzumab ozogamicin并延迟MRD阴性缓解患者的移植 。
对于fit的非低危AML-pCT患者,作者多使用CPX-351序贯HSCT。与AML-MR一样,即使通过多因素分析考虑了其他因素,这些患者的总体预后也很差。AML-pCT患者在7+3期后的中位OS约为6个月,而3期研究中CPX-351和7+3治疗的t-AML患者的中位OS分别为12.2和6.0个月(HR=0.48),CR/CRi率分别为47和36%。CPX-351后接受HSCT的AML-pCT患者(37%)获得最大的总体获益,中位OS未达到。
重要的是,AML-pCT患者可能面临独特的治疗挑战,包括广泛的既往蒽环类药物暴露史,既往长期骨髓毒治疗导致的骨髓储备不足,以及存在另一种并发癌症。对于这些患者,需坦率讨论治疗的风险和获益。对于有明显蒽环类药物史和低危fit AML-pCT的患者,作者会给予7+3联合dexrazoxane (用于预防蒽环类药物引起的儿童和青少年心脏毒性)。对于非低危疾病,作者倾向于使用CLAG而不含米托蒽醌,似乎可获得与CLAG-M相似的结局。虽然尚无评估HMA、Ven/LDAC或Ven/HMA的里程碑式研究报告AML-pCT的结果,但都入组了这些患者。因此作者在HSCT前对临界fit患者和老年unfit患者进行Ven/HMA治疗。有时会给予同时诊断为sAML和其他恶性肿瘤的患者中低强度治疗(即HMA)与其他癌症治疗(即免疫检查点抑制剂)。靶向治疗(FLT3和IDH1/2抑制剂)加入化疗骨干治疗AML-pCT的获益尚不清楚,需要进一步研究。
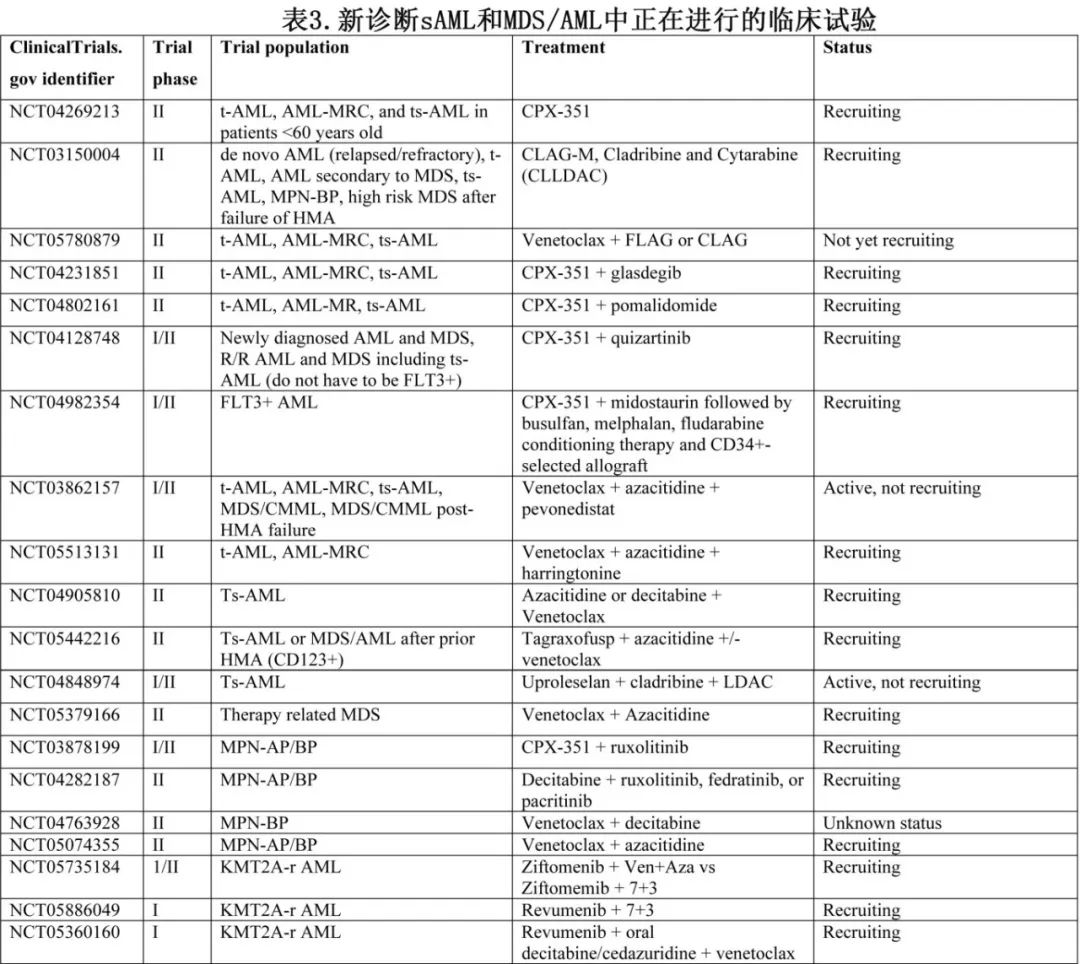
KMT2A(又称混合谱系白血病[MLL])基因重排见于15%的tAML,其中70%发生于拓扑异构酶抑制剂治疗后1~2年。针对menin-KMT2A蛋白相互作用的Menin抑制剂在重度经治复发/难治性KMT2Ar AML中显示出有希望的单药治疗效果(CR/CRi 20-35%,中位OS 7-8个月)。正在进行menin抑制剂联合强化和非强化疗治疗KMT2Ar AML-pCT患者的临床试验。AML-pCT中其他正在进行的研究侧重于开发风险预测模型,以及基于预先存在的CHIP和分子学畸变降级治疗策略(表3)。
结论
在所有sAML亚型的治疗中,最常见的主题就是化疗预后不良,迫切需要进行HSCT以延长OS。考虑到这些挑战,更好地识别和监测白血病转化风险较高的MPN和MDS患者将是获得更好结局的关键,包括早期转诊fit的高危患者进行HSCT。IPSS-M、ICC和WHO 2022等新型分类系统正在通过将疾病生物学(特别是分子信息)纳入常规诊断和预后检查来进一步推动该目标。此外,单细胞测序技术的发展已经阐明了导致sAML白血病发生的机制和克隆结构,将有望转化为更好的疾病监测(即MRD),更早地识别促进白血病的克隆,以及将靶向突变的药物整合到未来的治疗方法中。
sAML还没有标准治疗方案,而现有的大多数治疗证据来源于亚组分析、大型研究的外推和回顾性的单中心经验。应优先考虑在设计良好的多中心研究中纳入明确的生物学和临床亚群患者(即AML-MR、AML-pCT、MPN-BP、ts-AML),这对于改善治疗结局至关重要。
参考文献
Green SD, Wang ES.How I Treat: Secondary Acute Myeloid Leukemia.Blood . 2024 Oct 2:blood.2024024011. doi: 10.1182/blood.2024024011.


