Adv Sci:重庆医科大学秦新月等团队合作报道人工纳米平台MiCM-NPs用于中风治疗
时间:2024-11-03 12:00:52 热度:37.1℃ 作者:网络
缺血性中风是全球范围内导致死亡和残疾的主要原因,中风治疗的主要目标是破坏血栓以使血管再通并保护组织免受缺血/再灌注损伤。然而,目前的再通疗法存在严重的局限性,并且神经保护方法很少。
2024年10月30日,重庆医科大学秦新月、Cao Yang、Zhang Rongrong共同通讯在Advanced Science 在线发表题为“Artificial Microglia Nanoplatform Loaded With Anti-RGMa in Acoustic/Magnetic Feld for Recanalization and Neuroprotection in Acute Ischemic Stroke”的研究论文。该研究报道了一种负载抗排斥导向分子单克隆抗体(抗RGMa)并被小胶质细胞膜(MiCM)包裹的人工纳米平台用于中风治疗,即MiCM@PLGA/anti-RGMa/Fe3O4@PFH(MiCM-NPs)。
尾静脉注射MiCM-NPs可靶向因MiCM而缺血受损的内皮细胞,然后在外部低强度聚焦超声(LIFU)暴露后释放超顺磁性氧化铁(Fe3O4)和抗RGMa。血栓被LIFU诱导的“液气”相变和全氟己烷(PFH)的空化以及外部磁场诱导的Fe3O4运动破坏。Anti-RGMa保护缺血区域免受缺血/再灌注损伤。当血栓位于颅外动脉时,纳米平台可通过超声/光声成像可视化血栓。重要的是,体内动物研究表明MiCM-NPs治疗具有良好的安全性。总之,这种纳米平台有望成为一种结合靶向递送、再通和神经保护的缺血性中风治疗策略。

缺血性中风是全球范围内导致死亡和残疾的主要原因,造成了严重的全球健康负担。中风治疗的关键在于破坏血栓使血管再通和保护组织免受缺血/再灌注损伤。目前,急性缺血性中风广泛使用的再通治疗方法是静脉注射组织型纤溶酶原激活剂(tPA)和机械血栓切除术(MT)。但tPA的再通率较低,为4%至33%,神经功能恢复的机会不利。MT的再通率较高,但其术中并发症的风险也较高(例如血管损伤、腹股沟血肿、血栓嵌顿),主要与血栓切除的部位有关。此外,缺血/再灌注损伤发生在再通之后,这与再通成功的患者的预后不良有关。缺血/再灌注损伤是由缺血/再灌注引起的,是一种复杂的病理生理过程,包括血脑屏障破坏、炎症反应和反应性星形胶质增生。近年来,新出现的临床前数据表明,辅助再灌注治疗的神经保护治疗通过保护缺血区域免受再灌注损伤,减少了梗塞体积并改善了神经功能。由于神经保护药物作为再通治疗的辅助手段可以提供切实的临床益处,因此有必要开发一种将血栓破坏与有效的神经保护药物相结合的综合靶向缺血性中风治疗策略。
随着纳米技术的出现,在临床前研究中,已经开发了一系列基于智能响应纳米材料的机械血栓溶解策略用于动脉和静脉血栓形成,例如超声和磁响应平台。超声响应微泡被认为是一种潜在的治疗诊断系统,可用于超声可视化血栓和通过机械应力破坏血栓。低强度聚焦超声(LIFU)是一种非侵入性超声技术,可减少传统超声引起的能量损伤,并将超声精确聚焦在目标部位,已证明它可以通过触发封装在纳米粒子中的相变材料来破坏和破坏腹主动脉血栓形成和冠状动脉血栓栓塞的动物模型中的血栓。然而,据作者所知,很少有研究关注LIFU触发的血栓破坏用于中风治疗。LIFU可以透过完整的颅骨瞄准大脑结构。挑战在于长时间的LIFU暴露可能会对脑组织造成热损伤,但短暂的LIFU暴露可能无法完全破坏血栓。
因此,本研究提出了一种LIFU和磁性组合响应纳米平台。磁响应材料可以在磁场的操纵下以有针对性的方式移动和旋转。近年来,载有磁响应材料(如超顺磁性氧化铁(Fe3O4))的纳米粒子在与溶栓药物同时使用的情况下,在血栓可视化和破坏方面表现出巨大潜力。据报道,在施加外部旋转磁场时,封装有tPA的Fe3O4微棒可通过破坏血凝块网络来改善tPA诱导的血栓溶解。因此,作者提出了一种LIFU和磁性组合响应纳米平台,以实现安全有效的血管再通。该纳米平台通过全氟己烷(PFH)的“液-气”相变和LIFU诱导的PFH空化以及由亥姆霍兹线圈产生的外部磁场触发的Fe3O4旋转来破坏血栓。此外,PFH的相变可以显著增强B型超声和造影增强超声(CEUS)的超声图像可视化,而Fe3O4可以作为光声成像造影剂。这些成像方式有助于诊断血栓形成,特别是当血栓位于颅外动脉时(例如,颈段血栓形成)。
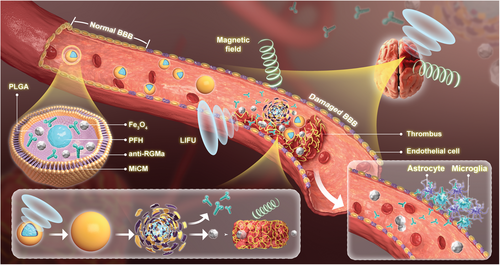
MiCM-NPs在中风中的结构和过程示意图(图源自Advanced Science )
排斥性导向分子-a(RGMa)是一种糖基磷脂酰肌醇锚定膜蛋白,属于排斥性导向分子(RGM)家族。RGMa参与中枢神经系统的许多生理和病理过程。作者之前的研究表明,脑缺血/再灌注后缺血区域的多种细胞类型中RGMa表达上调,包括神经元、星形胶质细胞和内皮细胞。RGMa促进血脑屏障(BBB)破坏、反应性星形胶质增生和炎症。RGMa抑制可减少梗塞体积并促进神经功能恢复。RGMa可能是脑缺血/再灌注后神经保护的关键靶点。抗RGMa单克隆抗体(anti-RGMa)已被证明可以在多种疾病动物模型中减轻疾病严重程度并促进神经功能恢复,包括视神经脊髓炎和脊髓损伤。值得注意的是,据报道,RGMa可促进小鼠急性腹膜炎模型的消退和组织修复。为了避免潜在的副作用并提高治疗效果,最好将抗RGMa靶向缺血区域。因此,作者提出了在靶向纳米粒子中加载抗RGMa的策略,以便在缺血性中风治疗中,它可以保护缺血区域免受再通后的缺血/再灌注损伤。
靶向递送对于中风后的再通和神经保护非常重要。细胞膜涂层是一种有前途的仿生靶向技术。细胞膜包被的纳米粒子擅长与生物底物相互作用,从而使它们能够有效地在复杂的生物环境中导航,避免免疫清除,并在疾病部位积聚。小胶质细胞是常驻免疫细胞,是中枢神经系统抵御损伤的第一道防线。据报道,小胶质细胞膜(MiCM)包被的纳米粒子可减少巨噬细胞的吞噬作用,同时增强对多形性胶质母细胞瘤的靶向性。据作者所知,之前很少有研究使用小胶质细胞膜作为涂层材料来靶向中风后的缺血区域。中风发作后几乎立即,血脑屏障被破坏,小胶质细胞迅速向缺血区域迁移,并与闭塞血管区域受损的血脑屏障内皮细胞接触。因此,小胶质细胞膜涂层可以使纳米粒子(NPs)通过靶向缺血损伤的血脑屏障内皮细胞进入血栓。
在本研究中,作者报告了一种MiCM涂层和LIFU/磁性响应纳米粒子,该纳米粒子负载有抗RGMa(即MiCM@PLGA/抗RGMa/Fe3O4@PFH纳米粒子,MiCM-NP),用于中风后的靶向递送、再通和神经保护。MiCM-NP由PFH作为核心、负载有Fe3O4和抗RGMa的聚乳酸-乙醇酸共聚物(PLGA)作为外壳和小胶质细胞膜组成。图1显示了MiCM-NP的结构,并说明了靶向递送、再通和神经保护的过程。递送后,由于MiCM-NP具有小胶质细胞膜涂层,因此它们会靶向缺血损伤的BBB内皮细胞。然后,纳米粒子被LIFU激活,释放Fe3O4和抗RGMa。血栓被LIFU诱导的“液气”相变和PFH空化以及磁场控制的Fe3O4运动和旋转破坏。抗RGMa可保护缺血区域免受缺血/再灌注损伤。此外,当血栓位于颅外动脉中时,MiCM-NP可以通过超声/光声成像可视化血栓。作者的数据表明,MiCM-NP通过靶向递送、再通和神经保护使闭塞动脉再通,减少了梗塞体积,并促进了神经功能。该纳米平台可能是一种很有前途的中风治疗方法。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202410529


