【衡道丨病例】“动态”中的乳腺导管内乳头状肿瘤的病理学特征观察(上)
时间:2024-11-07 17:00:38 热度:37.1℃ 作者:网络
乳腺的乳头状病变代表异质性肿瘤谱系,其特征是纤维血管轴心被覆上皮细胞,有或没有肌上皮细胞。根据WHO对乳腺肿瘤的分类,乳腺乳头状病变进一步分为导管内乳头状瘤(包括导管内乳头状瘤伴ADH/DCIS),乳头状DCIS,包裹性乳头状癌,实性乳头状癌(原位和浸润性)和浸润性乳头状癌。重叠的形态学特征和免疫组织化学特征使得乳腺乳头状病变的准确诊断充满挑战性。
本期由浙江医院病理科郑珍老师分享一例乳腺导管内乳头状瘤病伴癌变的病例。
病史
患者,女,45岁,因“发现双乳结节1年”入院。
专科检查
超声提示:
双侧乳腺囊性结节——符合BI-RADS 2类,左侧乳腺结节——符合BI-RADS 4a类,导管来源不除外,建议MR增强检查,余乳腺多发结节——符合BI-RADS 3类,双侧腋下未见明显肿大淋巴结。
乳腺磁共振提示:
左乳外上象限2点方向肿块,BI-RADS 4b类,建议进一步诊疗。
大体检查
左乳结节区段切除标本:灰白淡黄乳腺组织一块,大小5.0*4.7*1.0cm,临床四处带线,切面见一灰红结节,结节大小0.8*0.6*0.6cm,质硬界欠清,有颗粒感。
镜下病理形态
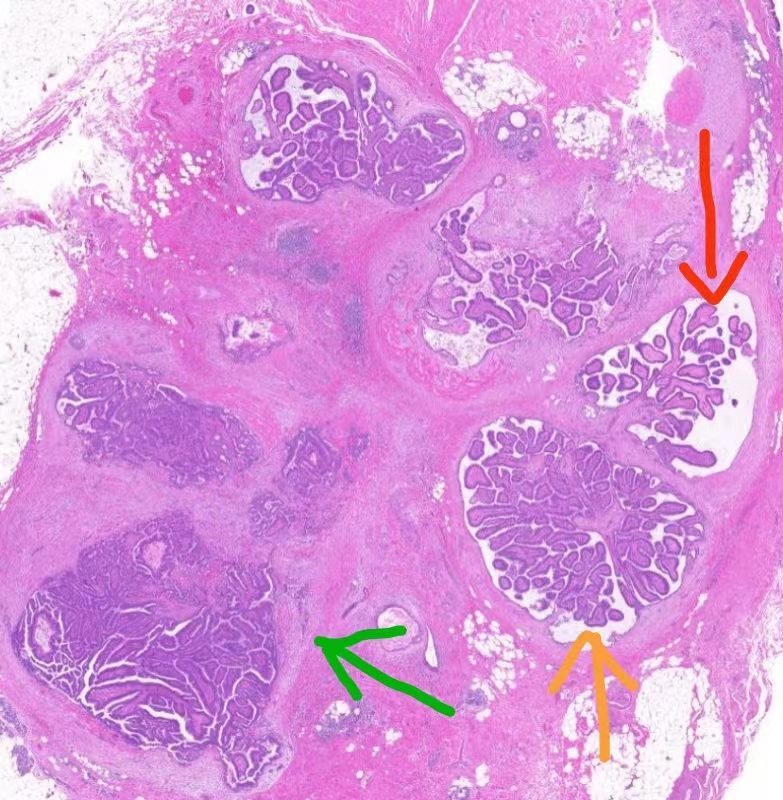
1X放大,见导管内乳头状病变,累及多个导管,根据乳头结构和细胞密度大致可见三种形态(红色箭头、黄色箭头、绿色箭头所示)。
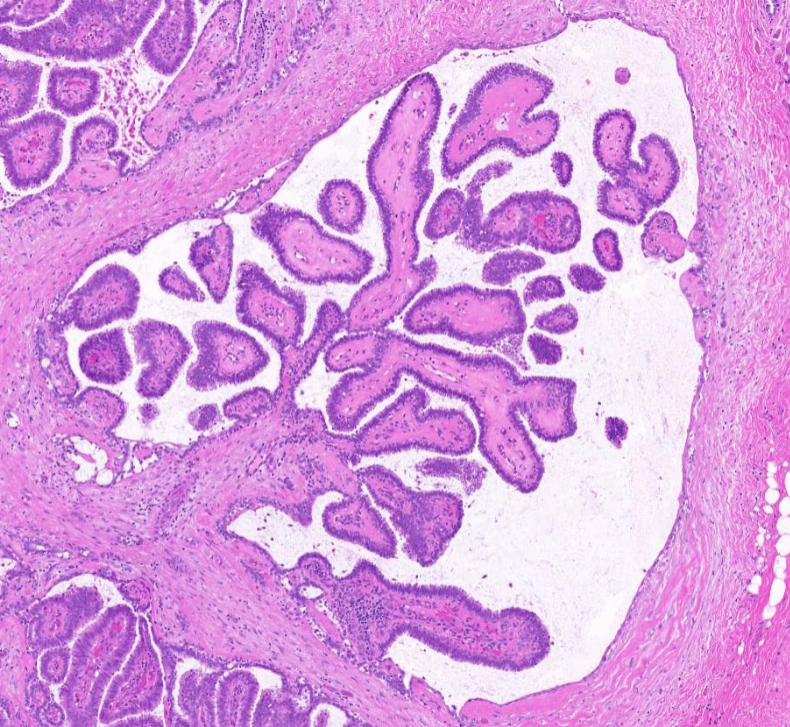
4X放大,红色箭头所示区域放大示导管内乳头状结构简单,至多二级分支,呈良性导管内乳头状瘤形态。
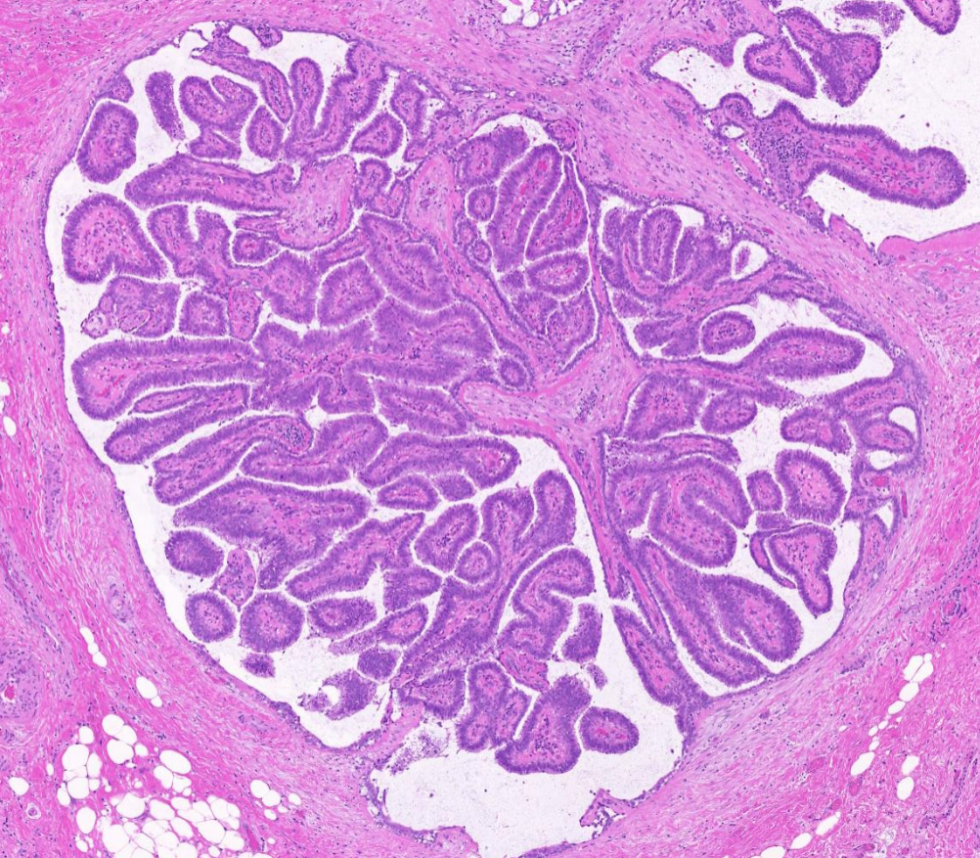
4X放大,黄色箭头所示区域放大示导管内乳头状结构多级分支。
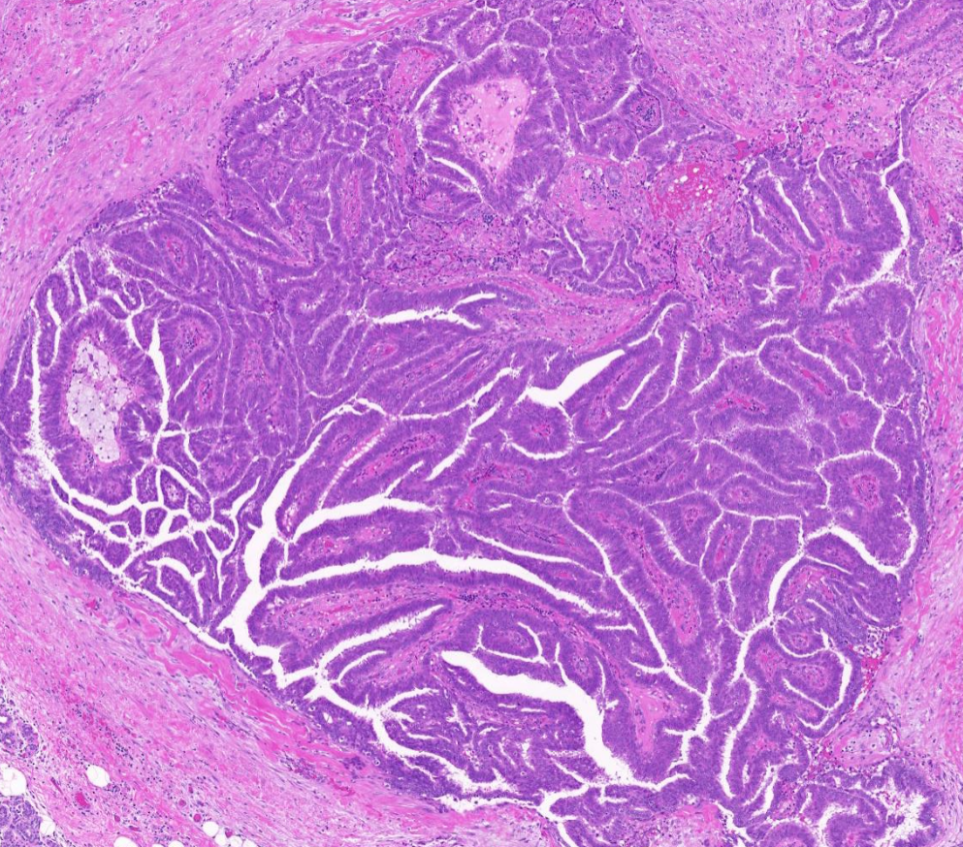
4X放大,绿色箭头所示区域放大示导管内乳头状结构复杂、紊乱。
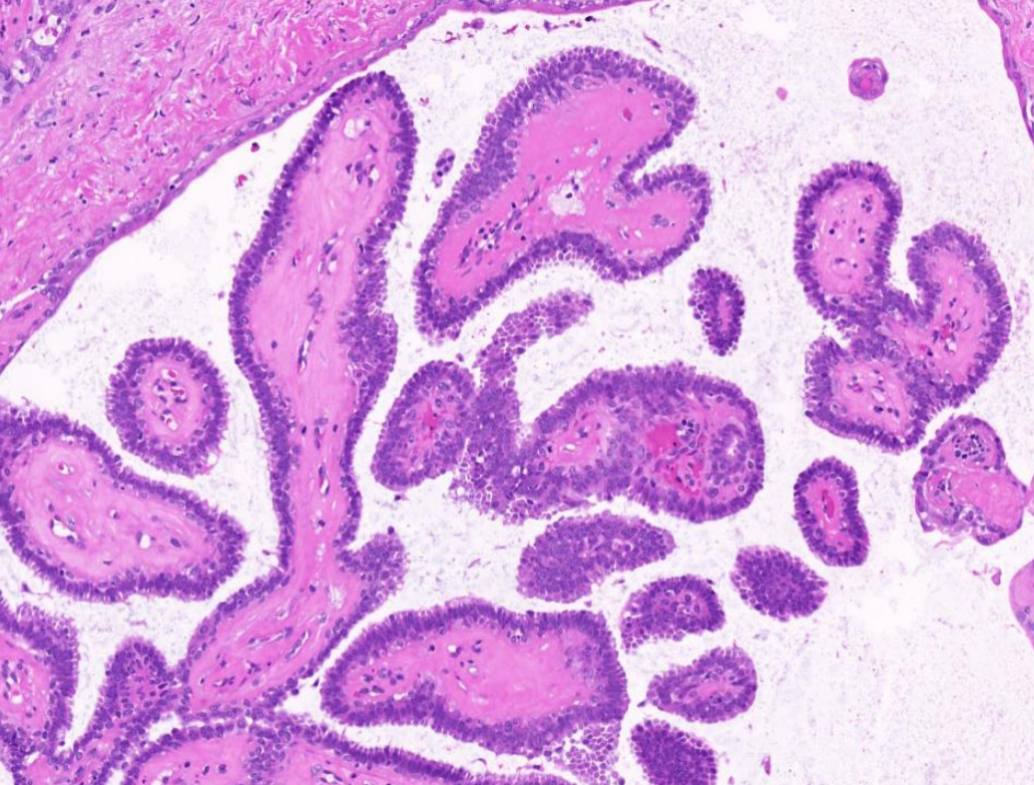
10X放大,红色箭头区域高倍放大,肿瘤细胞形态温和,单层排列,有极向,乳头结构简单。
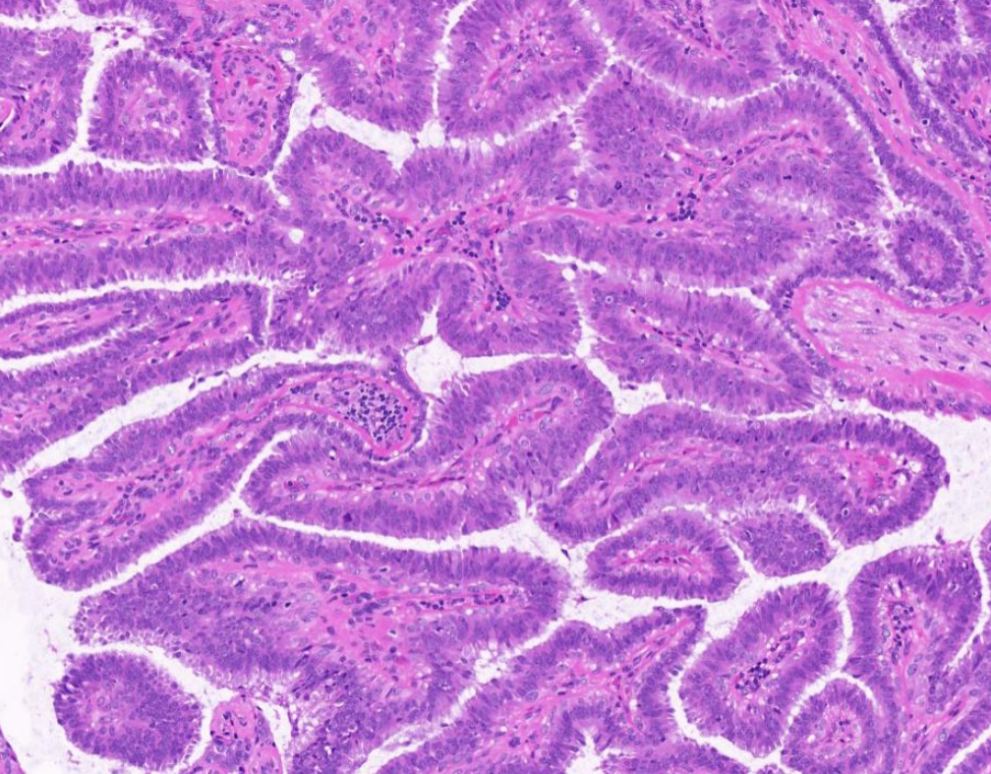
10X放大,黄色箭头区域高倍放大,肿瘤细胞排列紧密,假复层排列,极向尚存,乳头结构不规则。
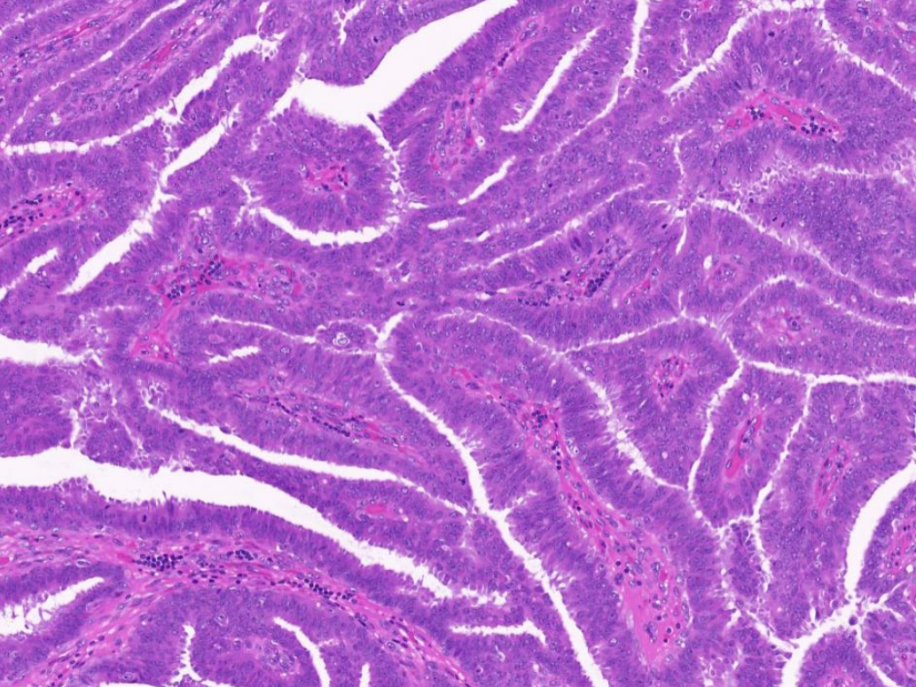
10X放大,绿色箭头区域高倍放大,肿瘤细胞排列致密、复层化,部分极向紊乱,乳头结构不规则、杂乱,局部有融合。
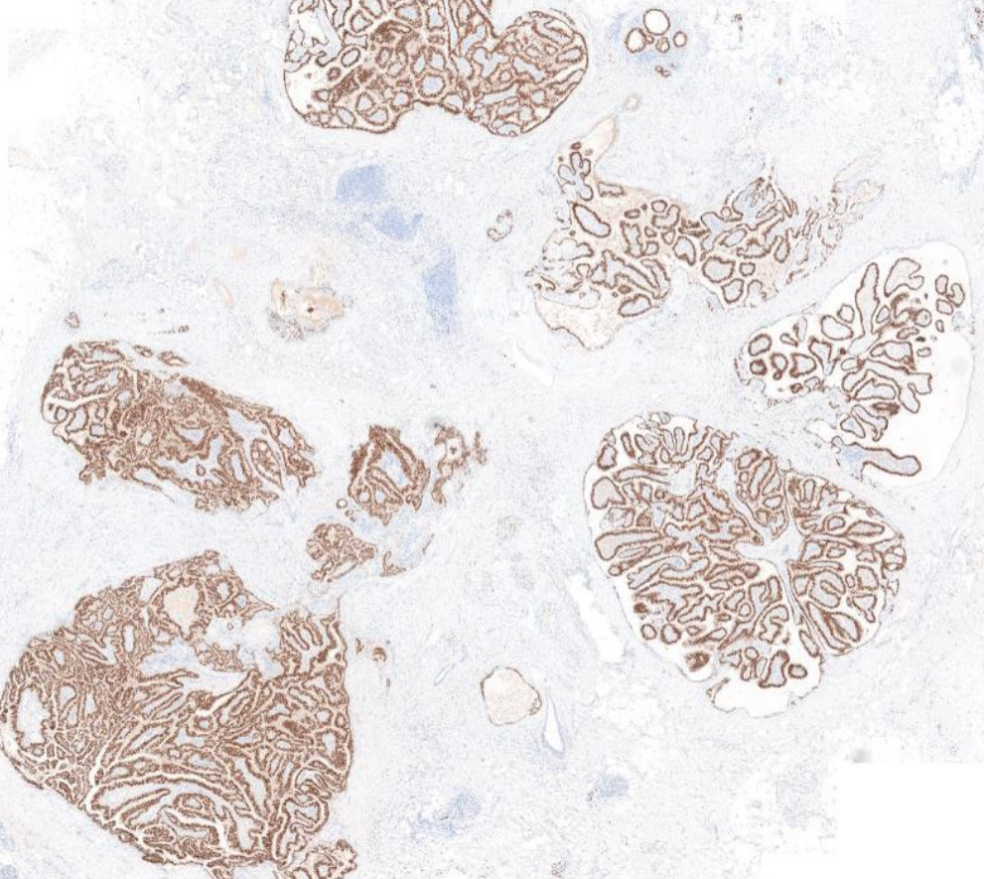
1X放大,三个区域ER均弥漫强阳。
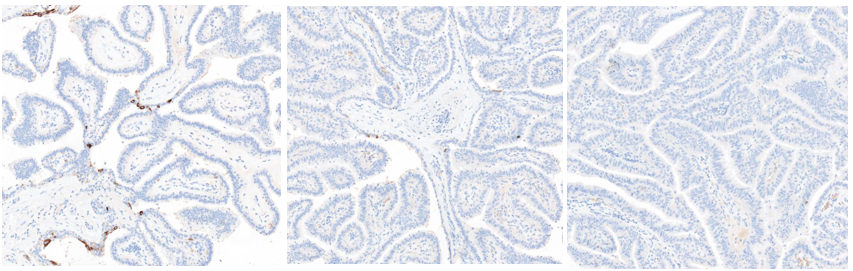
10X放大,红色箭头、黄色箭头及绿色箭头区域CK5/6由少量细胞阳——个别细胞阳——全阴性。
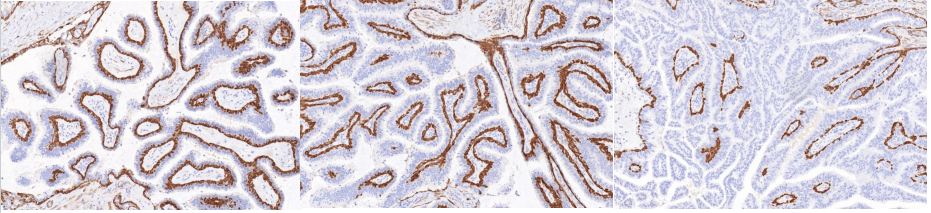
10X放大,红色箭头、黄色箭头及绿色箭头区域Calponin由肌上皮存在——肌上皮存在——局部肌上皮缺失。
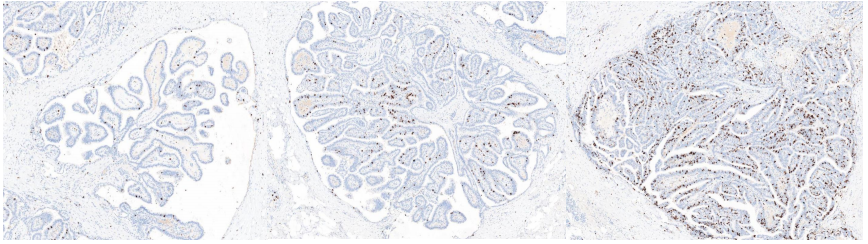
10X放大,ki-67显示红色箭头、黄色箭头及绿色箭头三个区域肿瘤细胞增殖活性有差异,分别约为2%、8%及15%左右。
免疫组化总结:
免疫组化标记
红色箭头区
黄色箭头区
绿色箭头区
ER
+++
+++
+++
CK5/6
少量+
个别细胞+
-
Calponin
肌上皮+
肌上皮+
局部肌上皮缺失
Ki-67
约2%+
约8%+
约15%+
病理诊断
(左乳结节区段切除标本)结合形态及免疫组化结果,符合乳腺导管内乳头状瘤病伴癌变(导管内乳头状癌),临床标记上切缘、下切缘、内切缘、外切缘及自检基底切缘、表面切缘均未见肿瘤组织累及。
讨论
乳腺的乳头状病变代表异质性肿瘤谱系,其特征是纤维血管轴心被覆上皮细胞,有或没有肌上皮细胞。根据WHO对乳腺肿瘤的分类,乳腺乳头状病变进一步分为导管内乳头状瘤(包括导管内乳头状瘤伴ADH/DCIS),乳头状DCIS,包裹性乳头状癌,实性乳头状癌(原位和浸润性)和浸润性乳头状癌。重叠的形态学特征和免疫组织化学特征使得乳腺乳头状病变的准确诊断充满挑战性。Yunbi Ni等人在Seminars in Diagnostic Pathology杂志发表了名为《Papillary lesions of the breast - review and practical issues》的文章,在这篇综述中,讨论了乳头状病变的形态学和相关IHC特征,进一步强调了一些常见的实际诊断问题,建立了一个简单的诊断思路,并讨论了相关的分子特征。
乳腺乳头状病变的分类
在WHO第5版乳腺肿瘤分类中,乳腺乳头状病变包括导管内乳头状瘤(包括导管内乳头状瘤伴ADH/DCIS)、乳头状DCIS、包裹性乳头状癌、实性乳头状癌(原位癌和浸润性)和浸润性乳头状癌,浸润性微乳头状癌和极性反转高细胞癌分别为浸润性乳腺癌和罕见肿瘤。
导管内乳头状瘤
导管内乳头状瘤(图1)是一种常见的乳腺良性乳头状病变,占乳腺良性病变的5%,进展为乳腺癌的风险增加2-3倍。一部分来自中央大导管,为孤立性病变;一部分来自于TDLU,为多发病灶。中央和外周导管内乳头状瘤的特征是导管内乳头状增生,包括纤维血管轴心、外层管腔细胞和内层肌上皮细胞。由于病变起源于导管内,因此受累导管的周围总是存在肌上皮细胞。伴随改变包括导管增生和乳头状增生,梗死、鳞状化生、黏液样变、透明细胞变、皮脂腺化生和胶原球状增生较少见。导管内乳头状瘤中常见的导管增生表现为上皮细胞不均匀增生,继发管壁不规则或细长,可出现硬化和透明变,IHC用于鉴别肌上皮细胞层变薄有助于诊断。导管内乳头状瘤的纤维血管轴心与乳头状癌相比具有广泛硬化的特点,虽然后者可能含有较宽的纤维血管轴心。有时肌上皮细胞不明显,但可用肌上皮细胞标记物标记出。
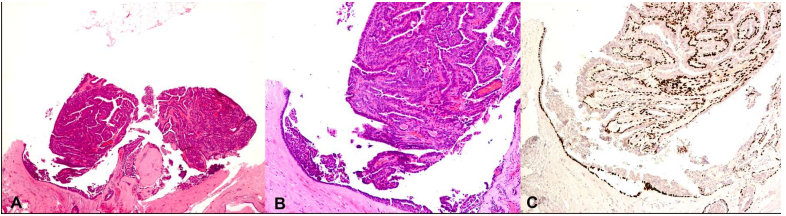
图1所示 A.导管内乳头状瘤低倍镜观。B.导管内增生,包括由外层管腔细胞和内层肌上皮细胞衬覆于分支的纤维血管轴心。c. p63免疫组化染色显示纤维血管轴心和病变导管周围的肌上皮细胞。
导管内乳头状瘤伴ADH或DCIS
导管内乳头状瘤可合并ADH(图2)或DCIS,其特征为单一细胞的局灶性增殖,具有低级别导管异型增生的组织学特征和的免疫特征。在这一区域,肌上皮细胞可能稀少或缺失。这两者之间的鉴别仍具有争议。最初由Page提出的区分导管内乳头状瘤伴ADH和低级别DCIS的标准为3mm,尽管研究证据有限。乳头状瘤内的中、高级别DCIS的诊断应与中、高核级别上皮细胞的增殖程度无关,而与细胞异型性相关。导管内乳头状瘤合并ADH/DCIS发展为浸润性乳腺癌的风险增加5~7倍。
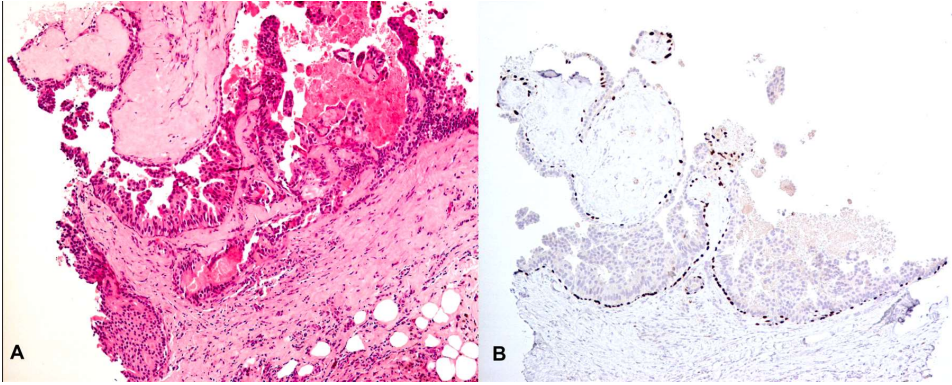
图2所示 A.导管内乳头状瘤伴ADH。非典型细胞单一,形成微乳头状和刚硬的次级管腔。非典型增生区直径为2.5 mm。B. p63免疫组化染色显示纤维血管轴心和病变导管周围的肌上皮细胞。
乳头状DCIS
DCIS的一个亚型是导管内具有分支状的纤维血管轴心,无肌上皮,有肿瘤性导管上皮,肌上皮细胞位于导管周围(图3)。在DCIS中通常有多种结构模式,很少是唯一的组成部分。有时肿瘤性导管上皮细胞部分或完全填充乳头之间的间隙,形成不同的结构,包括筛状、实性、微乳头状或致密乳头状结构,可能掩盖了潜在的乳头状结构。肿瘤细胞通常为低至中级核,偶见高级别乳头状DCIS。已报道的二态细胞变异型,上皮细胞具有清晰的细胞形态,类似于肌上皮细胞,肌上皮标记阴性有助于确定其谱系。乳头状DCIS的临床行为与其他类型的DCIS相似。
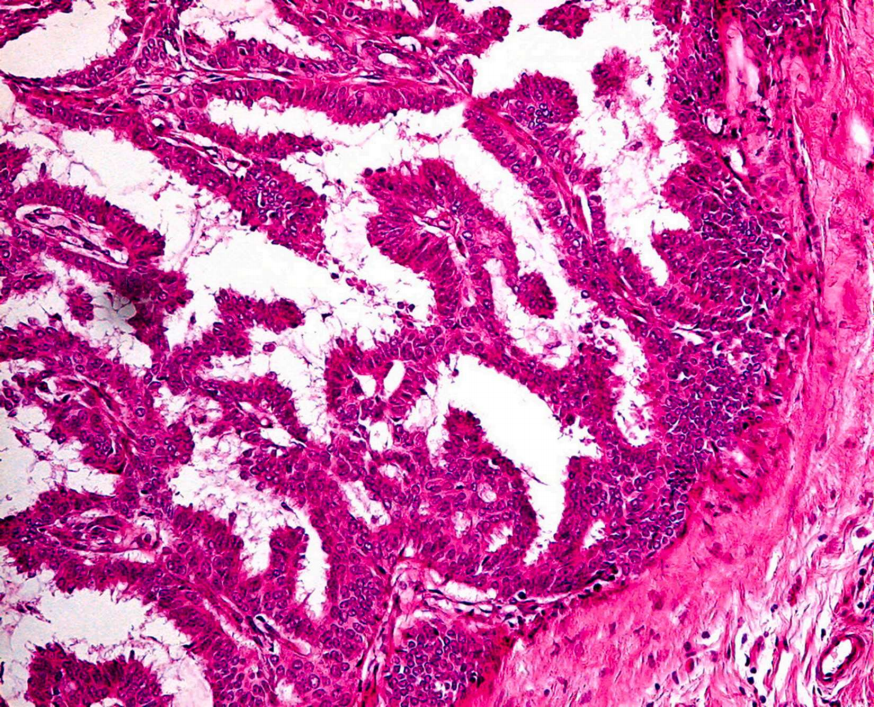
图3所示 乳头状DCIS的特征是导管内分支状纤维血管轴心缺乏肌上皮,内衬肿瘤性导管上皮,而肌上皮细胞存在于受累导管的周围。
包裹性乳头状癌
包裹性乳头状癌的特点是肿瘤呈圆形和推挤性边界,特征性的被不同厚度的纤维包膜包裹(图4A)。肿瘤由多个纤细的纤维血管轴心组成,内衬低至中级核的肿瘤上皮细胞,呈单层或多胞层排列,形成微乳头或筛状结构,填充乳头之间的间隙(图4B)。
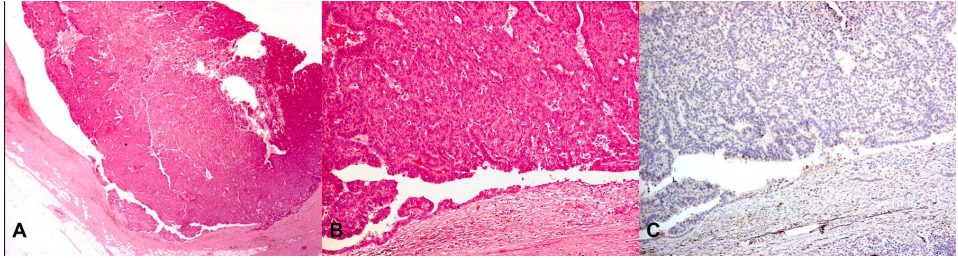
图4所示 A.包裹性乳头状癌的低倍镜观。B.包裹性乳头状癌的特征是肿瘤边缘呈圆形、推挤状,被纤维包膜包裹。肿瘤由纤细的纤维血管轴心组成,由低至中级核的肿瘤上皮细胞衬覆,上皮细胞呈筛状结构填充乳头之间的间隙。C. p63免疫组化染色显示乳头和病变周围没有肌上皮细胞。
虽然大多数包裹性乳头状癌表现出低至中级别核特征,但据报道,高级别包裹性乳头状癌的发生率为2.5%~14%。这些肿瘤往往激素受体阴性,体积较大,而且与间质浸润有关。
实性乳头状癌
实性乳头状癌由多个膨胀的结节组成,由具有纤细的纤维血管轴心的乳头(图5A)构成。一般来说,肿瘤细胞呈圆形、椭圆形、浆样或梭形,低至中级别核,胞浆苍白、嗜双色性、嗜酸性或颗粒状,伴神经内分泌分化(图5B-C)。常见细胞内和细胞外黏液,偶见印戒细胞(图5D)。纤维血管轴心周围的细胞常呈栅栏状排列。在有梭形细胞分化的情况下,呈流水样排列。偶见微囊状间隙,实性细胞结节周围肌上皮细胞缺失。
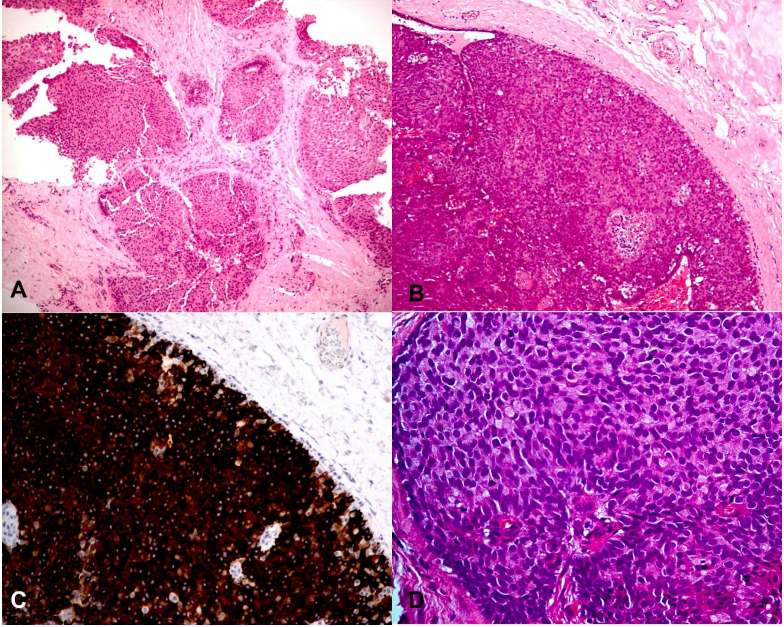
图5所示 A.多结节状原位实性乳头状癌低倍镜观。B.原位实性乳头状癌的特征是实性细胞结节被薄的纤维血管包绕。肿瘤细胞形态单一,嗜酸性颗粒状细胞质,提示神经内分泌分化。C.CgA免疫组化染色显示神经内分泌分化。D.原位实性乳头状癌中可见细胞内黏液。
原位实性乳头状癌的诊断方法是:实体结节有规则的圆形轮廓,周围肌上皮细胞存在、减少或缺失。原位实性乳头状癌可类似于DCIS及导管内乳头状瘤。然而,导管内乳头状瘤无论从形态还是IHC都可以被区分,在大部分病例中不会引起诊断困难。此外,两者均为原位病变,临床治疗无差异。原位实性乳头状癌常与浸润相关(图6)。
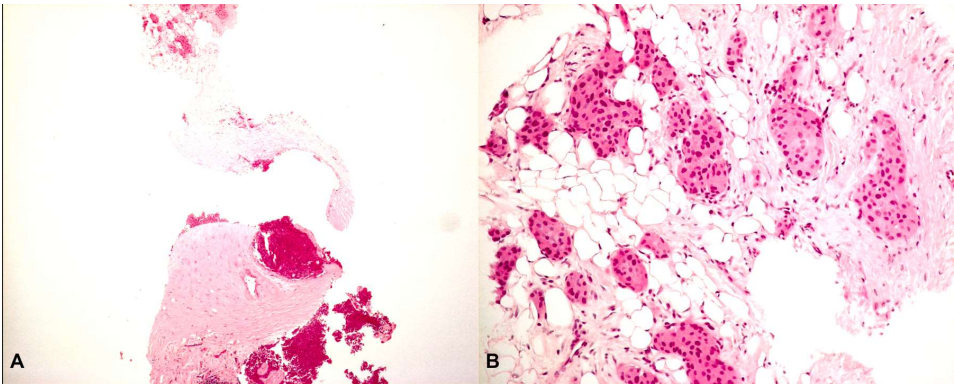
图6所示. A.原位实性乳头状癌(下半部分)周围伴浸润(上半部分)。B.肿瘤细胞巢不规则浸润脂肪组织。
罕见的浸润性实性乳头状癌已在第5版WHO乳腺肿瘤分类中作了正式定义。由于肿瘤结节轮廓不规则,缺乏肌上皮细胞,形成了伴有间质增生的地图样拼图结构,这种浸润性的实性乳头状模式可以单独存在,但更多的是与原位实性乳头状癌和传统浸润性癌伴发。
未完待续
参考文献及书籍:
1.WHO Classification of Breast Tumours.5th Edition.
2.Ni Y, Tse GM. Papillary lesions of the breast - review and practical issues. Semin Diagn Pathol. 2022 Sep;39(5):344-354. doi: 10.1053/j.semdp.2022.06.001. Epub 2022 Jun 11. PMID: 35718581.
3.Kulka J, Madaras L, Floris G, Lax SF. Papillary lesions of the breast. Virchows Arch. 2022;480(1):65-84.
4.Quinn CM, D'Arcy C, Wells C. Apocrine lesions of the breast.Virchows Arch. 2022;480(1):177-189.
5.Wei S. Papillary Lesions of the Breast: An Update.Arch Pathol Lab Med. 2016;140(7):628-643.
6.Rakha EA, Ellis IO. Diagnostic challenges in papillary lesions of the breast.Pathology. 2018;50(1):100-110.


