武大陈效/徐永红Biomaterials超声控释血小板介导的靶向声动力疗法诱导脑胶质瘤细胞准免疫原性死亡和巨噬细胞免疫兴奋性自噬
时间:2024-11-08 12:00:50 热度:37.1℃ 作者:网络
脑胶质瘤与声动力治疗
胶质母细胞瘤(GBM)是成人中致死率最高的原发性脑肿瘤,现有的标准治疗难度大、复发率高,多数患者预后不良。声动力疗法(SDT)是一种新兴的肿瘤治疗方式,对于治疗GBM有巨大潜力。SDT的基本原理是利用超声波激发肿瘤细胞摄取的声敏剂,赋能的声敏剂将环境中的分子氧转化为活性氧(ROS),后者可氧化损伤细胞内的生物大分子,从而引起细胞毒性乃至死亡。SDT依赖于GBM中富集足够的声敏剂,如何向GBM有效递送声敏剂是GBM SDT面临的一个挑战。同时,GBM组织是一个复杂的微生态,除了肿瘤细胞,其中还有大量的非肿瘤细胞,比如胶质细胞、巨噬细胞、中性粒细胞、内皮细胞和血小板等,它们与GBM细胞有着密切的交互作用,深刻地影响着GBM的病生过程及其对各种治疗的反应。SDT对这些细胞及其与GBM细胞的交互作用有何影响?此问题的解答对于阐明SDT治疗GBM的机制具有重要意义,但目前相关研究甚少。
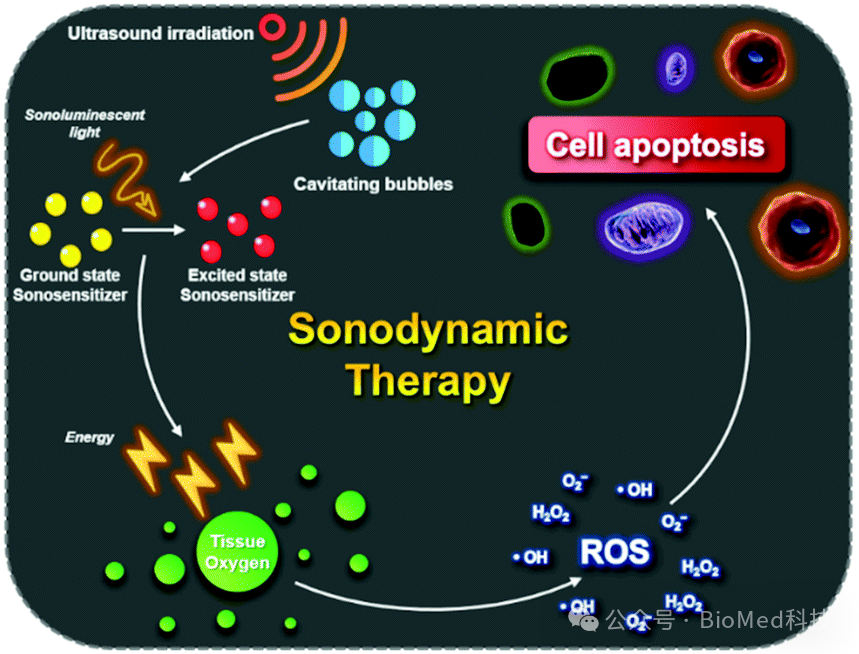
Source: Son et al. Chem. Soc. Rev., 2020,49, 3244-3261
“超声控释血小板”介导的GBM靶向SDT
针对如何向GBM有效递送声敏剂的挑战,武汉大学陈效/徐永红等在一项研究中提出一种“超声控释血小板”的药物递送策略,用于实现GBM靶向SDT。其基本原理如下:在体外利用血小板荷载声敏剂,荷载声敏剂的血小板经静脉注射入血并随血流分布到GBM血管床。此时以超声辐照GBM,利用声动力效应在血小板中产生ROS,后者立即引发GBM血管中载声敏剂血小板的活化和聚集,同时快速大量释放声敏剂。ROS对血管内皮的破坏可促进声敏剂在肿瘤组织中的渗透和扩散。待声敏剂分布至肿瘤细胞中,再次给予GBM超声辐照,从而引起肿瘤细胞的声动力损伤。该研究首先利用体外和动物体内GBM模型论证了该SDT策略的可行性和有效性,进而还阐述了其疗效机制涉及声动力作用对肿瘤细胞和巨噬细胞的不同效应以及血小板的参与。相关工作近期以”Targeted sonodynamic therapy induces tumor cell quasi-immunogenic ferroptosis and macrophage immunostimulatory autophagy in glioblastoma”为题发表于学术期刊Biomaterials。

【文章要点】
该研究使用了一种纳米声敏剂BNPD-Ce6,是利用经多聚甘油和阿霉素修饰的氮化硼纳米颗粒负载二氢卟吩e6而得到,BNPD-Ce6能被血小板稳定荷载。首先,体外研究显示 BNPD-Ce6 介导的声动力作用(SDA)会导致 GBM 细胞出现显著损伤和死亡,但却不会引起巨噬细胞死亡。随后发现,暴露于 SDA 的 GBM 细胞呈现铁死亡的表型;而暴露于 SDA 的巨噬细胞则发生免疫兴奋性的自噬,并可有效增强SDA 对GBM细胞的毒性(图1-3)。

图1. 暴露于SDA的GBM细胞呈现铁死亡的表型;而暴露于SDA的巨噬细胞则发生自噬。

图2. 暴露于SDA的GBM细胞呈现铁死亡的表型;而暴露于SDA的巨噬细胞则发生自噬。

图3. 暴露于SDA的巨噬细胞呈现免疫兴奋性的抗肿瘤表型。
进一步研究表明,SDA损伤的GBM细胞具有准免疫原性(quasi-immunogenicity),其特征是释放一些“损伤相关分子模式”(DAMPs),如 ATP、HSP90和CRT,但却不包括关键的HMGB1。因此,SDA 损伤的GBM细胞无法有效兴奋巨噬细胞。有趣的是,血小板作为HMGB1的供体可弥补这种缺陷(图4)。

图4. SDA诱导GBM细胞发生准免疫原性细胞死亡, 血小板的存在可恢复免疫原性。
在小鼠体内研究中,作者首先证明:可利用“超声控释血小板”策略,即利用超声触发荷载 BNPD-Ce6 的血小板(BNPD-Ce6@Plt),将 BNPD-Ce6 靶向递送到颅内GBM中,并对肿瘤造成显著的声动力损伤(图5)。
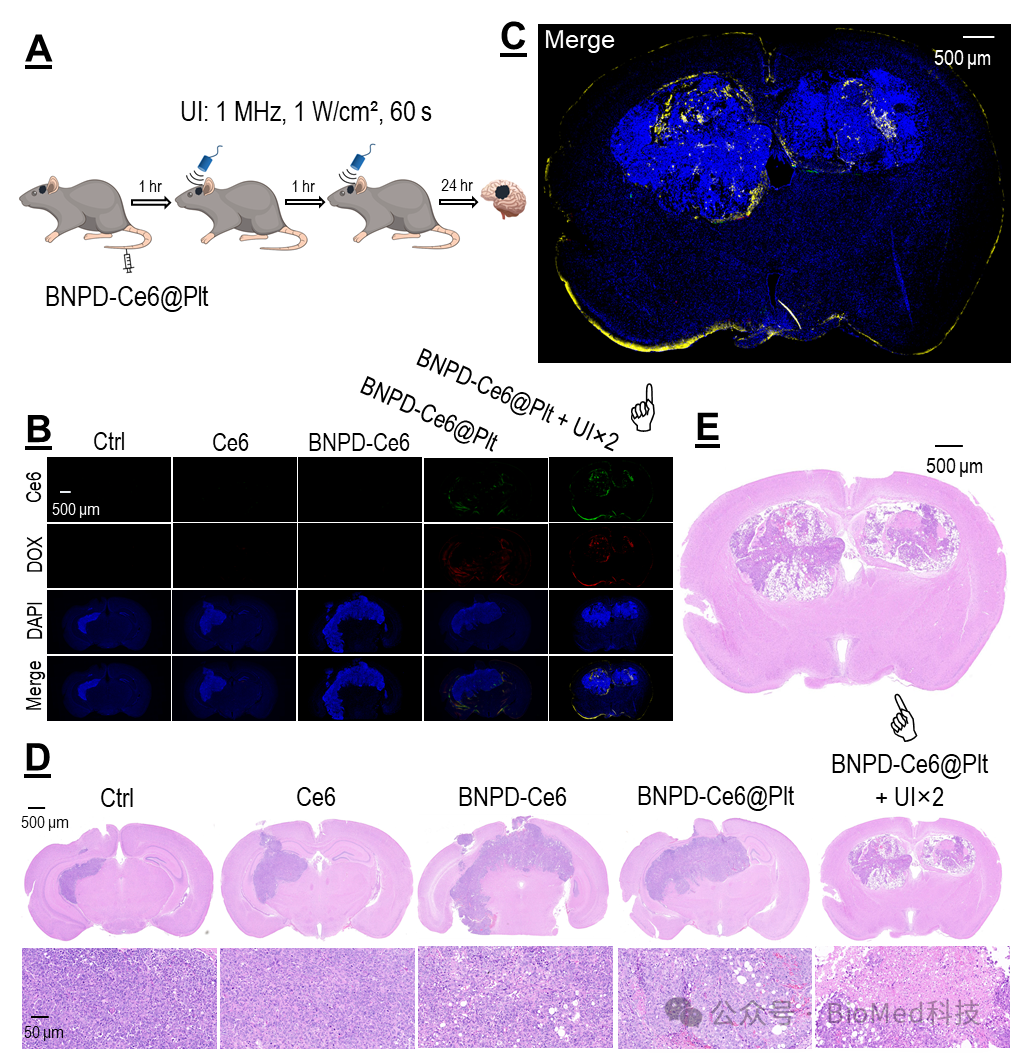
图5. 静脉给予BNPD-Ce6@Plt 联合两次肿瘤超声可靶向损伤颅内GBM。
随后表明SDA可引起颅内GBM中的肿瘤细胞发生铁死亡而巨噬细胞发生自噬。根据上述结果,作者设计并实施了一套有效的SDT 方案,可明显延缓颅内GBM的生长,并显著延长宿主的存活(图6)。病理检查显示,接受SDT的GBM有明显的组织坏死和结构破坏。最后,作者在皮下GBM模型中发现巨噬细胞的耗竭会削弱 SDT的疗效。
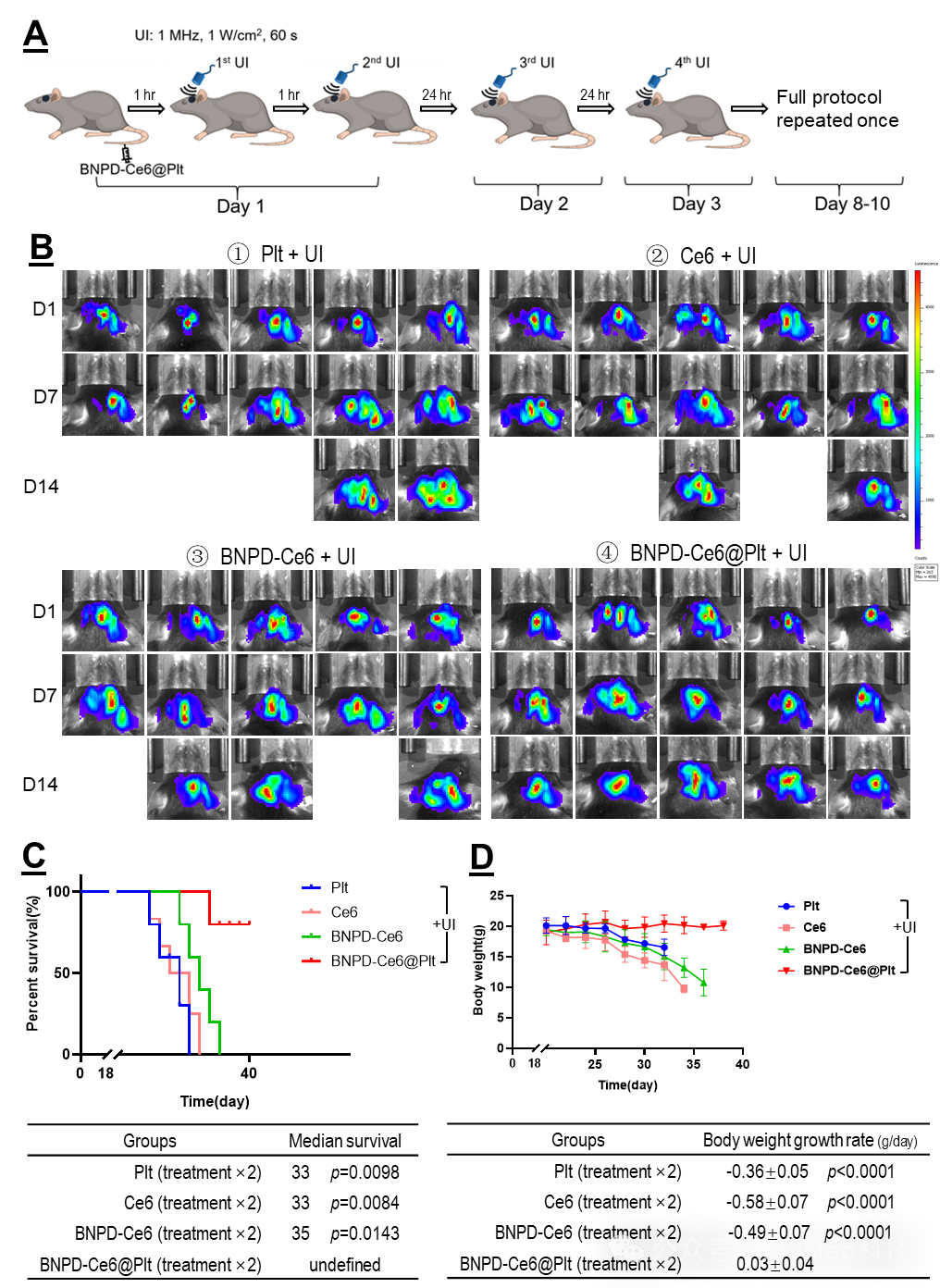
图6. BNPD-Ce6@Plt介导的靶向SDT的对小鼠颅内GBM具有良好疗效。
【结论与展望】
“超声控释血小板”介导的SDT是一种可行、有效且具有转化潜能的GBM 靶向治疗策略,其疗效机制涉及 SDA 诱导的肿瘤细胞铁死亡、巨噬细胞兴奋和血小板活化的协同作用(图7)。
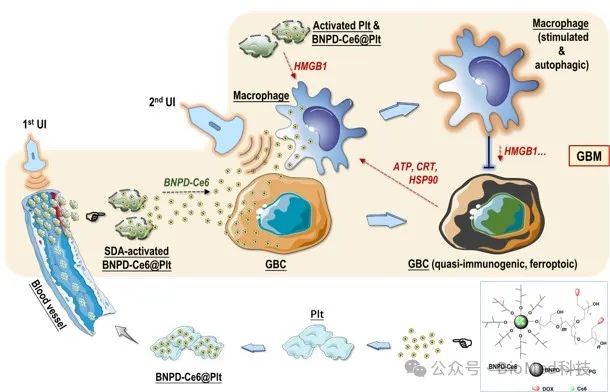
图7.“超声控释血小板”介导的GBM靶向SDT涉及 SDA 诱导的肿瘤细胞铁死亡、巨噬细胞兴奋和血小板活化的协同作用。
原文链接:
https://doi.org/10.1016/j.biomaterials.2024.122913


