Adv Healthc Mater 四川大学李一飞/华益民/郭俊凌教授团队开发新型多酚纳米工程化单核细胞用于心脏免疫治疗
时间:2024-11-19 06:00:13 热度:37.1℃ 作者:网络
心肌梗死(MI)是全球范围内导致死亡和致残的主要疾病之一,由于心脏快速的收缩-舒张循环和血液循环特性,传统药物难以在梗死区域维持高效浓度,尤其是在血液灌注不良的部位。在这个背景下,2024年11月11日,四川大学李一飞/华益民/郭俊凌教授团队在Advanced Healthcare Materials发表了题为“Polyphenol-Nanoengineered Monocyte Biohybrids for Targeted Cardiac Repair and Immunomodulation”的研究论文,本研究开发了一种创新的细胞生物混合治疗系统CTAs@MOs,为心肌梗死的治疗带来了突破性进展。

该系统通过金属-酚配位界面组装技术,将抗炎细胞因子IL-10和心肌再生微小RNA (miR-19a)制备为多酚功能化的纳米复合物,并精确附着在体外转移的单核细胞(MOs)表面,实现了对缺血心肌区域的精准靶向和富集。研究显示,CTAs@MOs能显著促进单核细胞向修复型M2型巨噬细胞分化,并有效激活心肌细胞增殖,显著改善了心脏功能,包括提升射血分数、缩短分数增加以及减少梗死面积,展现了强大的心脏保护和治疗潜力(图1)。
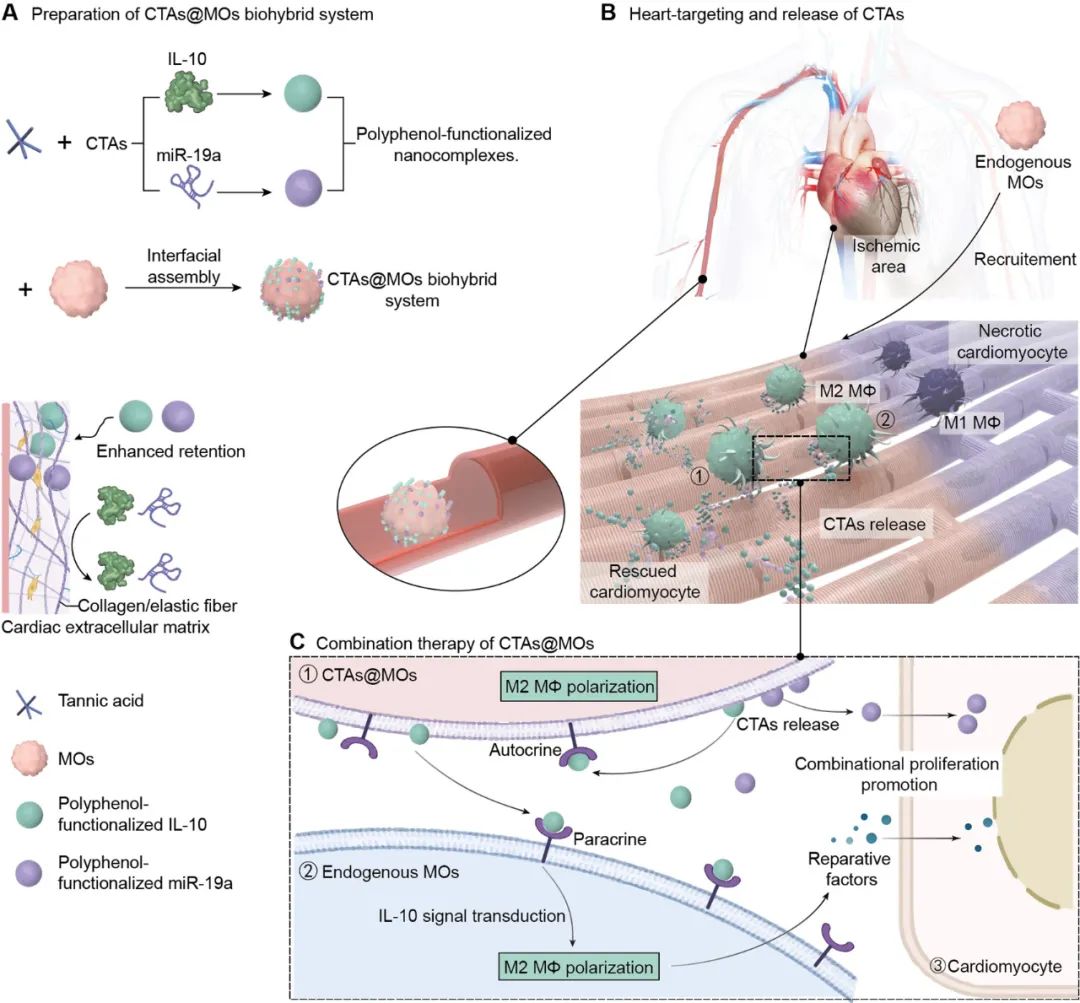
图1. CTAs@MOs组装和功能示意图
在小鼠心肌梗死模型中,研究团队系统性注射了CTAs@MOs、游离CTAs或生理盐水,并设立假手术对照组,全面评估了新型系统的心脏靶向性能和生物分布特性(图2A)。使用Langendorff装置分离心脏单细胞,并通过流式细胞术和生物分布成像分析,结果表明,CTAs@MOs在缺血心肌区域显著富集,相较于游离CTAs,miR-19a的信号强度明显增加,心脏靶向指数(HTI)达到0.20,较对照组提升8倍(图2B-2D)。激光共聚焦显微镜图像进一步证实,CTAs@MOs成功递送至梗死区,即使在血供减少的情况下仍表现出卓越的靶向能力(图2E)。此外,CTAs@MOs在注射后第5天体内miR-19a和IL-10表达显著增加,并在14天内逐渐恢复至基线水平,显示出稳定的药物递送和滞留效果(图2F-2G)。
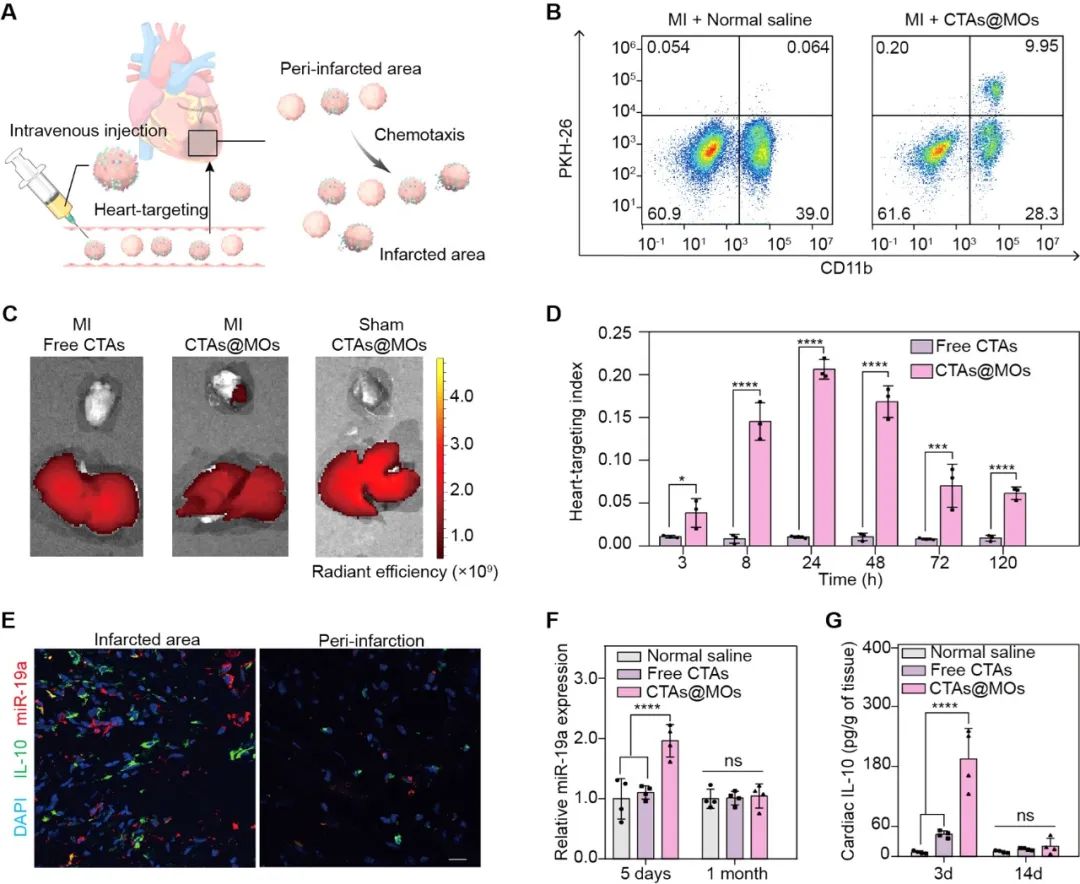
图2. CTAs@MOs的心脏靶向能力
为了进一步验证CTAs@MOs在心肌梗死修复中的治疗潜力,研究团队重点考察了巨噬细胞极化、心肌细胞增殖及其对缺血心脏局部微环境的调控(图3A)。实验结果显示,CTAs@MOs能显著促进转移的单核细胞向M2型巨噬细胞分化,并在28天内保持高水平CD206表达(图3B-3C)。通过旁分泌机制,CTAs@MOs提升了心脏中M2型巨噬细胞的比例,显著促进了心肌组织的修复(图3D-3H)。同时,心肌细胞中增殖标志物Ki67、PCNA和pH3的表达显著上调,表明心肌细胞再生能力增强(图3L-3M)。RNA测序结果揭示,CTAs@MOs能调控与心脏组织再生、收缩及有氧呼吸相关的基因上调,而炎症和纤维化相关基因下调,表明其在改善心肌功能和修复中的综合作用。这一研究展示了CTAs@MOs的巨大临床转化潜力,为心血管疾病治疗开辟了新方向。
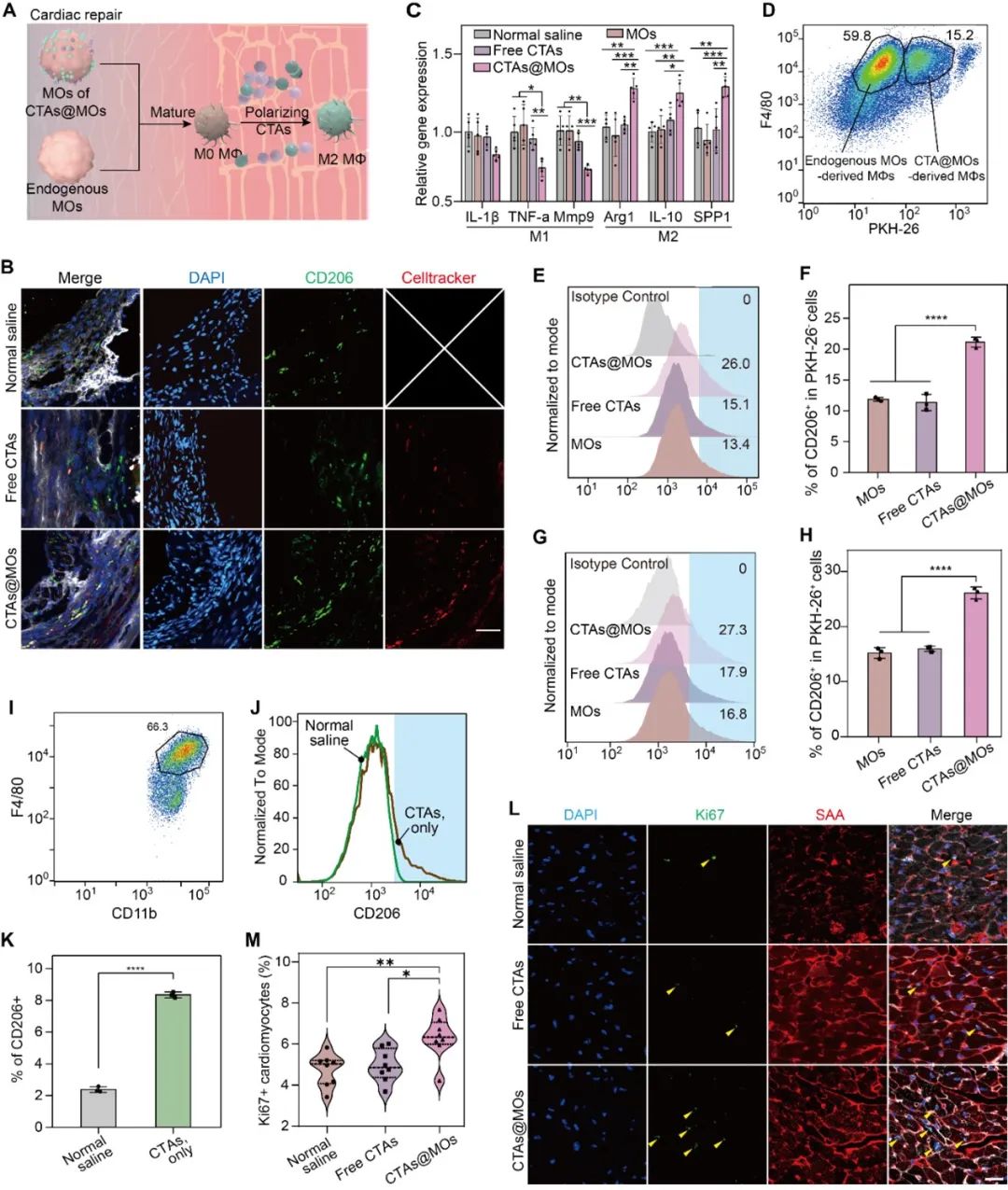
图3. CTAs@MOs调控单核细胞分化和促进心肌增殖
四川大学华西第二医院儿童心血管科李一飞教授与华益民教授、四川大学轻工学院郭俊凌教授为本文的共同通讯作者。四川大学华西第二医院博士生李佳文及四川大学轻工学院龚贵东副研究员为共同第一作者。
文章链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/adhm.202403595


